- •В.М. Васюков
- •Курс лекций
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •Основные понятия химии
- •Основные положения атомно-молекулярной теории
- •Газовые законы
- •Глава 2. Строение атома и периодический закон Модели строения атома
- •Квантовые числа электронов
- •Электронные конфигурации атомов
- •Ядро атома и радиоактивные превращения
- •Периодический закон
- •Глава 3. Химическая связь Валентность и степень окисления
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Межмолекулярные взаимодействия
- •Глава 4. Комплексные соединения
- •Глава 5. Состояние вещества
- •Глава 6. Физико-химические закономерности протекания химических реакций Химическая термодинамика
- •Химическая кинетика и катализ
- •Обратимые и необратимые реакции. Состояние химического равновесия
- •Глава 7. Физико-химическая теория растворов электролитов и неэлектролитов Механизм образования растворов и их классификация
- •Идеальные и реальные растворы. Растворение как физико-химический процесс
- •Зависимость растворимости различных веществ от природы растворителя, температуры и давления
- •Законы разбавленных растворов
- •Способы выражения концентрации (состава) растворов
- •Электролиты и электролитическая диссоциация
- •Гидролиз солей
- •Глава 8. Дисперсные системы
- •Классификации дисперсных систем
- •Оптические и молекулярно-кинетические свойства дисперсных систем
- •Поверхностные и адсорбционные явления
- •Коллоидные (коллоидно-дисперсные) системы
- •Глава 9. Теория окислительно-восстановительных процессов Окислительно-восстановительные реакции
- •Химические источники электрической энергии. Электродные потенциалы
- •1) Металлы, обладающие более электроотрицательным потенциалом, способны вытеснить менее активные металлы (с более положительным потенциалом) из водных растворов их солей;
- •Коррозия металлов
- •Электролиз
- •Восстанавливается вода Восстанавливается вода и катионы металла Восстанавливается катионы металла
- •Глава 10. Качественный и количественный анализ веществ
- •Качественный анализ
- •Классификация катионов на аналитические группы
- •Классификация анионов на аналитические группы
- •Количественный анализ
- •Химические методы анализа
- •Физические и физико-химические методы анализа
- •Часть II. Неорганическая химия
- •Глава 11. Важнейшие классы неорганических соединений
- •Основания (гидроксиды металлов)
- •Кислоты
- •Глава 12. Элементы I группы
- •Водород
- •Глава 13. Элементы II группы
- •Бериллий
- •Глава 14. Элементы III группы
- •Алюминий
- •Лантаноиды
- •Актиноиды
- •Глава 15. Элементы IV группы
- •Углерод
- •Кремний
- •Глава 16. Элементы V группы
- •Глава 17. Элементы VI группы
- •Кислород
- •Глава 18. Элементы VII группы
- •Глава 19. Элементы VIII группы
- •Часть III. Органическая химия Глава 20. Общая характеристика органических соединений
- •Теория строения органических соединений
- •Атомы в молекулах соединены между собой в определенном порядке химическими связями согласно их валентности; углерод во всех органических соединениях четырехвалентен.
- •Свойства вещества определяются не только качественным составом, но и его строением, взаимным влиянием атомов, как связанных между собой химическими связями, так и непосредственно не связанных.
- •Строение молекул может быть установлено на основе изучения их химических свойств.
- •Формулы органических соединений
- •Классификация органических соединений
- •Номенклатура органических соединений
- •Изомерия органических соединений
- •Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- •Общая характеристика органических реакций
- •Промышленное производство органических соединений
- •Глава 21. Алканы Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 22. Циклоалканы Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Глава 23. Алкены (олефины) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 24. Алкадиены (диеновые углеводороды) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 25. Алкины (ацетилены) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 26. Ароматические углеводороды (арены) Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Правила ориентации (замещения) в бензольном кольце
- •Применение
- •Глава 27. Гидроксильные соединения (спирты)
- •Одноатомные спирты (алкоголи) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Многоатомные спирты
- •Получение
- •Химические свойства
- •Применение
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 28. Карбонильные соединения (оксосоединения) Номенклатура и изомерия
- •Метаналь этаналь
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 29. Карбоновые кислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 30. Сложные эфиры. Жиры Номенклатура и изомерия
- •Физические свойства
- •Химические свойства
- •Жиры и масла
- •Глава 31. Углеводы (сахара)
- •Моносахариды Номенклатура и изомерия
- •Физические и химические свойства глюкозы
- •Дисахариды
- •Полисахариды
- •Глава 32. Амины
- •Предельные алифатические амины Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Ароматические амины
- •Физические свойства
- •Химические свойства
- •Применение
- •Глава 33. Аминокислоты, пептиды и белки
- •Аминокислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Пептиды
- •Физические свойства
- •Химические свойства
- •Биологическое значение белков
- •Глава 34. Гетероциклические соединения
- •Шестичленные гетероциклы
- •Пятичленные гетероциклы
- •Нуклеиновые кислоты Строение нуклеиновых кислот
- •Биологическая роль нуклеиновых кислот
- •Глава 35.Синтетические высокомолекулярные соединения
- •Общая характеристика полимеров
- •Пластмассы
- •Волокна
- •Каучуки
- •Литература
- •Приложения Растворимость неорганических веществ в воде при 25°c
Химические свойства
1. Анилин – гораздо более слабое основание, чем алифатические амины (Кb = 5,2-10-10). Это объясняется тем, что электронная пара атома азота, которая обусловливает основные свойства аминов, частично смещается в бензольное кольцо.
Анилин реагирует с сильными кислотами, образуя соли фениламмония С6Н5NН3+, которые растворимы в воде, но нерастворимы в неполярных органических растворителях:
![]()
2. Анилин весьма активен в реакциях электрофильного замещения в бензольном кольце. Это объясняется электронными эффектами, которые приводят к увеличению электронной плотности в кольце.
Анилин легко бромируетея даже под действием бромной воды, давая белый осадок 2,4,6-триброманилина:

С концентрированной азотной кислотой анилин реагирует со взрывом, поэтому непосредственное нитрование осуществить не удается. Можно, однако, на время реакции защитить аминогруппу, если перед нитрованием превратить ее в амидную группу –NH-CO-СН3 действием уксусного ангидрида (СН3СО)О, а после нитрования гидролизовать амид с образованием исходной аминогруппы. Данная последовательность реакций описывается схемой:

В этих реакциях образуется также небольшое количество орто-нитроанилина.
3. При реакции анилина с азотистой кислотой образуются диазо-соединения – соли диазония C6H5N2+:
![]()
Диазосоединения можно выделить в виде кристаллических, легко взрывающихся веществ. Благодаря способности диазониевой группы легко замещаться на другие функциональные группы, эти соединения широко используются в органических синтезах. Во многих случаях можно не выделять диазосоединения в кристаллическом виде, а использовать их свежеприготовленные растворы.
4. Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении. При действии хлорной извести Са(Сl)ОСl на водный раствор анилина появляется интенсивное фиолетовое окрашивание. Это – качественная реакция на анилин.
Применение
Основная область применения анилина – синтез красителей и лекарственных средств. В качестве примера приведем схему синтеза красителя метилового оранжевого (кислотно-основного индикатора):


Глава 33. Аминокислоты, пептиды и белки
Многие биологически активные молекулы включают несколько химически различных функциональных групп, способных к взаимодействию между собой или с функциональными группами других молекул. Один из примеров – моносахариды, в состав которых входят несколько гидроксильных групп и одна карбонильная группа. Другой важный пример бифункциональных природных соединений – аминокислоты.
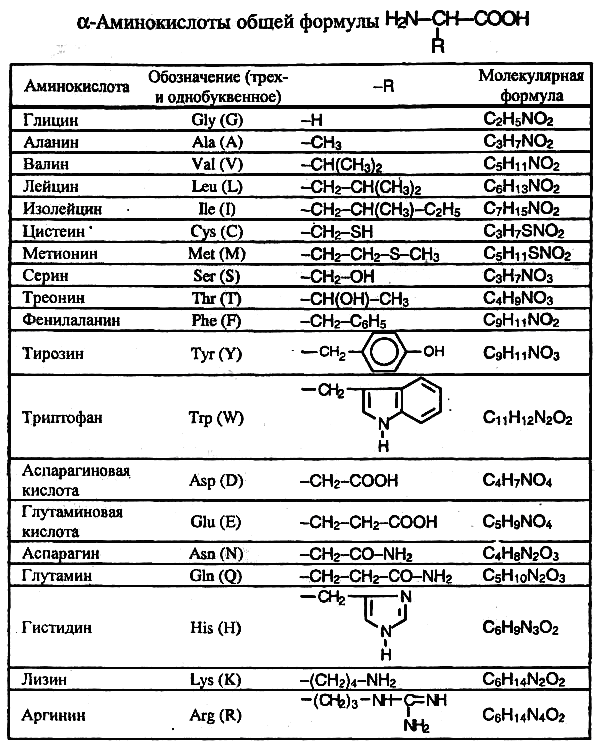
Аминокислоты Номенклатура и изомерия
Аминокислоты – это органические бифункциональные соединения, в состав которых входят карбоксильная группа –СООН и аминогруппа –NH2. В зависимости от взаимного расположения обеих функциональных групп различают α-, β-аминокислоты и т.д.

Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы. Рассматрим только α-аминокислоты, поскольку другие аминокислоты в природе встречаются значительно реже.
В состав белков входят 19 основных аминокислот и одна иминокислота. Все природные аминокислоты имеют тривиальные названия.
Иминокислота пролин (молекулярная формула C5H9NO2) имеет структуру

Простейшая аминокислота – глицин (аминоуксусная кислота). Остальные природные аминокислоты можно разделить на следующие основные группы:
гомологи глицина – аланин, валин, лейцин, изолейцин;
серосодержащие аминокислоты – цистеин, метионин;
аминокислоты с алифатической гидроксильной группой – серии, треонин;
4) ароматические аминокислоты – фенилаланин, тирозин, триптофан;
5) аминокислоты с кислотным радикалом – аспарагиновая и глутаминовая кислоты;
аминокислоты с амидной группой – аспарагин, глутамин;
аминокислоты с основным радикалом – гистидин, лизин, аргинин.
Изомерия. Во всех α-аминокислотах, кроме глицина, α-углеродный атом связан с четырьмя разными заместителями, поэтому все эти аминокислоты могут существовать в виде двух изомеров (энантиомеров), являющихся зеркальными отражениями друг друга (оптическая изомерия). Каждый изомер относят к D- или L-ряду в зависимости от того, совпадает его конфигурация с конфигурацией D-глицеринового альдегида или нет:

В состав белков животных организмов входят только α-аминокислоты L-ряда.