
- •В.М. Васюков
- •Курс лекций
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •Основные понятия химии
- •Основные положения атомно-молекулярной теории
- •Газовые законы
- •Глава 2. Строение атома и периодический закон Модели строения атома
- •Квантовые числа электронов
- •Электронные конфигурации атомов
- •Ядро атома и радиоактивные превращения
- •Периодический закон
- •Глава 3. Химическая связь Валентность и степень окисления
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Межмолекулярные взаимодействия
- •Глава 4. Комплексные соединения
- •Глава 5. Состояние вещества
- •Глава 6. Физико-химические закономерности протекания химических реакций Химическая термодинамика
- •Химическая кинетика и катализ
- •Обратимые и необратимые реакции. Состояние химического равновесия
- •Глава 7. Физико-химическая теория растворов электролитов и неэлектролитов Механизм образования растворов и их классификация
- •Идеальные и реальные растворы. Растворение как физико-химический процесс
- •Зависимость растворимости различных веществ от природы растворителя, температуры и давления
- •Законы разбавленных растворов
- •Способы выражения концентрации (состава) растворов
- •Электролиты и электролитическая диссоциация
- •Гидролиз солей
- •Глава 8. Дисперсные системы
- •Классификации дисперсных систем
- •Оптические и молекулярно-кинетические свойства дисперсных систем
- •Поверхностные и адсорбционные явления
- •Коллоидные (коллоидно-дисперсные) системы
- •Глава 9. Теория окислительно-восстановительных процессов Окислительно-восстановительные реакции
- •Химические источники электрической энергии. Электродные потенциалы
- •1) Металлы, обладающие более электроотрицательным потенциалом, способны вытеснить менее активные металлы (с более положительным потенциалом) из водных растворов их солей;
- •Коррозия металлов
- •Электролиз
- •Восстанавливается вода Восстанавливается вода и катионы металла Восстанавливается катионы металла
- •Глава 10. Качественный и количественный анализ веществ
- •Качественный анализ
- •Классификация катионов на аналитические группы
- •Классификация анионов на аналитические группы
- •Количественный анализ
- •Химические методы анализа
- •Физические и физико-химические методы анализа
- •Часть II. Неорганическая химия
- •Глава 11. Важнейшие классы неорганических соединений
- •Основания (гидроксиды металлов)
- •Кислоты
- •Глава 12. Элементы I группы
- •Водород
- •Глава 13. Элементы II группы
- •Бериллий
- •Глава 14. Элементы III группы
- •Алюминий
- •Лантаноиды
- •Актиноиды
- •Глава 15. Элементы IV группы
- •Углерод
- •Кремний
- •Глава 16. Элементы V группы
- •Глава 17. Элементы VI группы
- •Кислород
- •Глава 18. Элементы VII группы
- •Глава 19. Элементы VIII группы
- •Часть III. Органическая химия Глава 20. Общая характеристика органических соединений
- •Теория строения органических соединений
- •Атомы в молекулах соединены между собой в определенном порядке химическими связями согласно их валентности; углерод во всех органических соединениях четырехвалентен.
- •Свойства вещества определяются не только качественным составом, но и его строением, взаимным влиянием атомов, как связанных между собой химическими связями, так и непосредственно не связанных.
- •Строение молекул может быть установлено на основе изучения их химических свойств.
- •Формулы органических соединений
- •Классификация органических соединений
- •Номенклатура органических соединений
- •Изомерия органических соединений
- •Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- •Общая характеристика органических реакций
- •Промышленное производство органических соединений
- •Глава 21. Алканы Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 22. Циклоалканы Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Глава 23. Алкены (олефины) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 24. Алкадиены (диеновые углеводороды) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 25. Алкины (ацетилены) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 26. Ароматические углеводороды (арены) Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Правила ориентации (замещения) в бензольном кольце
- •Применение
- •Глава 27. Гидроксильные соединения (спирты)
- •Одноатомные спирты (алкоголи) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Многоатомные спирты
- •Получение
- •Химические свойства
- •Применение
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 28. Карбонильные соединения (оксосоединения) Номенклатура и изомерия
- •Метаналь этаналь
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 29. Карбоновые кислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 30. Сложные эфиры. Жиры Номенклатура и изомерия
- •Физические свойства
- •Химические свойства
- •Жиры и масла
- •Глава 31. Углеводы (сахара)
- •Моносахариды Номенклатура и изомерия
- •Физические и химические свойства глюкозы
- •Дисахариды
- •Полисахариды
- •Глава 32. Амины
- •Предельные алифатические амины Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Ароматические амины
- •Физические свойства
- •Химические свойства
- •Применение
- •Глава 33. Аминокислоты, пептиды и белки
- •Аминокислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Пептиды
- •Физические свойства
- •Химические свойства
- •Биологическое значение белков
- •Глава 34. Гетероциклические соединения
- •Шестичленные гетероциклы
- •Пятичленные гетероциклы
- •Нуклеиновые кислоты Строение нуклеиновых кислот
- •Биологическая роль нуклеиновых кислот
- •Глава 35.Синтетические высокомолекулярные соединения
- •Общая характеристика полимеров
- •Пластмассы
- •Волокна
- •Каучуки
- •Литература
- •Приложения Растворимость неорганических веществ в воде при 25°c
Химические свойства
1. Благодаря наличию электронной пары на атоме азота, все амины обладают основными свойствами, причем алифатические амины являются более сильными основаниями, чем аммиак. Водные растворы аминов имеют щелочную реакцию:
![]()
Амины в чистом виде или в растворах взаимодействуют с кислотами, образуя соли, которые являются аналогами солей аммония:
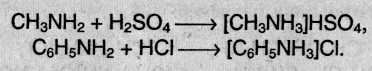
Соли аминов – твердые вещества, хорошо растворимые в воде и плохо растворимые в неполярных органических растворителях. Щелочи превращают соли аминов в свободные амины подобно тому, как из солей аммония щелочи вытесняют аммиак.
![]()
2. Амины – органические аналоги аммиака, поэтому они могут образовывать комплексные соединения с переходными металлами:
![]()
Неподеленная пара электронов амина в этих комплексах занимает свободную орбиталь во внешнем слое центрального атома, образуя донорно-акцепторную связь.
3. Первичные и вторичные амины реагируют с азотистой кислотой, образующейся при добавлении нитрита натрия к разбавленной соляной кислоте:
![]()
Первичные амины под действием азотистой кислоты превращаются в спирты:
![]()
Промежуточным соединением в этой реакции является неустойчивый ион диазония [R-N ≡ N]+.
Вторичные амины с азотистой кислотой дают N-нитрозамины – маслянистые жидкости с характерным запахом:
![]()
Третичные алифатические амины с азотистой кислотой не реагируют. Таким образом, азотистая кислота – реагент, позволяющий определять тип амина.
4. При сгорании аминов образуются углекислый газ, азот и вода:
![]()
Применение
Низшие алифатические амины используются для синтеза лекарственных средств, пестицидов и пластмасс.
Ароматические амины
Анилин (фениламин) C6H5NH2 – родоначальник класса ароматических аминов, в которых аминогруппа непосредственно связана с бензольным кольцом. Эта связь приводит к важным последствиям.
Неподеленная электронная пара атома азота взаимодействует с π-электронной системой бензольного кольца. Данное взаимодействие можно описать следующими предельными (или резонансными) структурами:
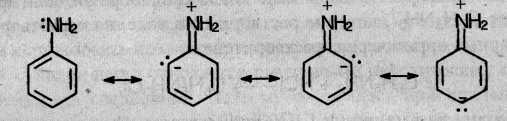
Молекула анилина представляет собой среднее между изображенными четырьмя структурами.
Эти структурные формулы показывают, что электронная пара азота втягивается в бензольное кольцо, при этом на атоме азота появляется частичный положительный заряд, и основные свойства аминогруппы уменьшаются. В бензольном кольце, напротив, электронная плотность увеличивается, причем наиболее сильно – в положениях 2, 4 и 6 (орто- и пара-) по отношению к аминогруппе.
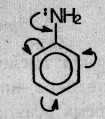
Приведенные выше структурные формулы можно объединить в одну, в которой смещение электронной плотности (+M-эффект группы NH2) изображено стрелками:
Физические свойства
Анилин – бесцветная маслянистая жидкость, немного тяжелее воды, мало растворима в воде, растворима в этиловом спирте и в бензоле.
Основной способ получения анилина – восстановление нитробензола. В промышленных условиях восстановление проводят водородом при 250-350°С на никелевом или медном катализаторе:
![]()
В лаборатории для этой цели используют цинк в кислой среде:
![]()
или алюминий в щелочной среде:
![]()
В последних двух реакциях реальный восстановитель – водород в момент выделения.
