
- •В.М. Васюков
- •Курс лекций
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •Основные понятия химии
- •Основные положения атомно-молекулярной теории
- •Газовые законы
- •Глава 2. Строение атома и периодический закон Модели строения атома
- •Квантовые числа электронов
- •Электронные конфигурации атомов
- •Ядро атома и радиоактивные превращения
- •Периодический закон
- •Глава 3. Химическая связь Валентность и степень окисления
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Межмолекулярные взаимодействия
- •Глава 4. Комплексные соединения
- •Глава 5. Состояние вещества
- •Глава 6. Физико-химические закономерности протекания химических реакций Химическая термодинамика
- •Химическая кинетика и катализ
- •Обратимые и необратимые реакции. Состояние химического равновесия
- •Глава 7. Физико-химическая теория растворов электролитов и неэлектролитов Механизм образования растворов и их классификация
- •Идеальные и реальные растворы. Растворение как физико-химический процесс
- •Зависимость растворимости различных веществ от природы растворителя, температуры и давления
- •Законы разбавленных растворов
- •Способы выражения концентрации (состава) растворов
- •Электролиты и электролитическая диссоциация
- •Гидролиз солей
- •Глава 8. Дисперсные системы
- •Классификации дисперсных систем
- •Оптические и молекулярно-кинетические свойства дисперсных систем
- •Поверхностные и адсорбционные явления
- •Коллоидные (коллоидно-дисперсные) системы
- •Глава 9. Теория окислительно-восстановительных процессов Окислительно-восстановительные реакции
- •Химические источники электрической энергии. Электродные потенциалы
- •1) Металлы, обладающие более электроотрицательным потенциалом, способны вытеснить менее активные металлы (с более положительным потенциалом) из водных растворов их солей;
- •Коррозия металлов
- •Электролиз
- •Восстанавливается вода Восстанавливается вода и катионы металла Восстанавливается катионы металла
- •Глава 10. Качественный и количественный анализ веществ
- •Качественный анализ
- •Классификация катионов на аналитические группы
- •Классификация анионов на аналитические группы
- •Количественный анализ
- •Химические методы анализа
- •Физические и физико-химические методы анализа
- •Часть II. Неорганическая химия
- •Глава 11. Важнейшие классы неорганических соединений
- •Основания (гидроксиды металлов)
- •Кислоты
- •Глава 12. Элементы I группы
- •Водород
- •Глава 13. Элементы II группы
- •Бериллий
- •Глава 14. Элементы III группы
- •Алюминий
- •Лантаноиды
- •Актиноиды
- •Глава 15. Элементы IV группы
- •Углерод
- •Кремний
- •Глава 16. Элементы V группы
- •Глава 17. Элементы VI группы
- •Кислород
- •Глава 18. Элементы VII группы
- •Глава 19. Элементы VIII группы
- •Часть III. Органическая химия Глава 20. Общая характеристика органических соединений
- •Теория строения органических соединений
- •Атомы в молекулах соединены между собой в определенном порядке химическими связями согласно их валентности; углерод во всех органических соединениях четырехвалентен.
- •Свойства вещества определяются не только качественным составом, но и его строением, взаимным влиянием атомов, как связанных между собой химическими связями, так и непосредственно не связанных.
- •Строение молекул может быть установлено на основе изучения их химических свойств.
- •Формулы органических соединений
- •Классификация органических соединений
- •Номенклатура органических соединений
- •Изомерия органических соединений
- •Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- •Общая характеристика органических реакций
- •Промышленное производство органических соединений
- •Глава 21. Алканы Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 22. Циклоалканы Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Глава 23. Алкены (олефины) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 24. Алкадиены (диеновые углеводороды) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 25. Алкины (ацетилены) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 26. Ароматические углеводороды (арены) Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Правила ориентации (замещения) в бензольном кольце
- •Применение
- •Глава 27. Гидроксильные соединения (спирты)
- •Одноатомные спирты (алкоголи) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Многоатомные спирты
- •Получение
- •Химические свойства
- •Применение
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 28. Карбонильные соединения (оксосоединения) Номенклатура и изомерия
- •Метаналь этаналь
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 29. Карбоновые кислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 30. Сложные эфиры. Жиры Номенклатура и изомерия
- •Физические свойства
- •Химические свойства
- •Жиры и масла
- •Глава 31. Углеводы (сахара)
- •Моносахариды Номенклатура и изомерия
- •Физические и химические свойства глюкозы
- •Дисахариды
- •Полисахариды
- •Глава 32. Амины
- •Предельные алифатические амины Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Ароматические амины
- •Физические свойства
- •Химические свойства
- •Применение
- •Глава 33. Аминокислоты, пептиды и белки
- •Аминокислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Пептиды
- •Физические свойства
- •Химические свойства
- •Биологическое значение белков
- •Глава 34. Гетероциклические соединения
- •Шестичленные гетероциклы
- •Пятичленные гетероциклы
- •Нуклеиновые кислоты Строение нуклеиновых кислот
- •Биологическая роль нуклеиновых кислот
- •Глава 35.Синтетические высокомолекулярные соединения
- •Общая характеристика полимеров
- •Пластмассы
- •Волокна
- •Каучуки
- •Литература
- •Приложения Растворимость неорганических веществ в воде при 25°c
Применение
Формальдегид – газ с резким раздражающим запахом. 40% водный раствор формальдегида называется формалином. Формальдегид получают в промышленности в крупных масштабах окислением метана или метанола. При нагревании формальдегида с аммиаком А.М. Бутлеров синтезировал гексаметилентетрамин (уротропин, сухое горючее):
6СН2О + 4 NН3 → (СН2)6N4 + 6Н2О
Уротропин применяется в медицине как противовоспалительное средство, используется в больших количествах в производстве полимеров, взрывчатых веществ.
Формальдегид обладает бактерицидным действием и применяется в качестве дезинфицирующего средства для обработки зерно- и овощехранилищ, для протравливания семян, для консервации анатомических препаратов. На основе реакции поликонденсации формальдегида с фенолом получают фенолформальдегидные смолы, с мочевиной – карбамидные смолы.
Ацетальдегид – легкокипящая жидкость (температура кипения 21°С) с запахом зеленой листвы. Применяется для получения многих органических соединений уксусной кислоты, этилацетата, хлороформа и др.
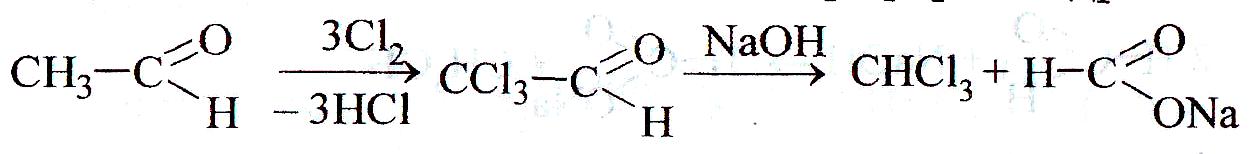
Ацетон – бесцветная жидкость с характерным запахом, смешивается с водой во всех Соотношениях, хороший растворитель органических веществ. Основным способом синтеза ацетона является кумольный метод совместного получения фенола и ацетона. Ацетон используют как растворитель лаков, красок, в производстве ацетатного волокна, бездымного пороха и других химических продуктов.
Глава 29. Карбоновые кислоты Номенклатура и изомерия
Карбоновыми кислотами называют соединения, содержащие карбоксильную группу
![]()
По числу карбоксильных групп карбоновые кислоты делят на монокарбоновые, или одноосновные (одна группа –СООН), дикарбоновые, или двухосновные (две группы –СООН) и т.д. В зависимости от строения углеводородного радикала, с которым связана карбоксильная группа, карбоновые кислоты бывают алифатическими (например, уксусная или акриловая), алициклическими (например, циклогексанкарбоновая) или ароматическими (бензойная, фталевая).
В основе названий карбоновых кислот лежат названия соответствующих углеводородов. Наличие карбоксильной группы отражается окончанием -овая кислота. Низшие карбоновые кислоты часто имеют тривиальные названия: муравьиная, уксусная, масляная и др.
 Углеводородную
цепь нумеруют начиная с атома углерода
карбоксильной группы, например:
Углеводородную
цепь нумеруют начиная с атома углерода
карбоксильной группы, например:
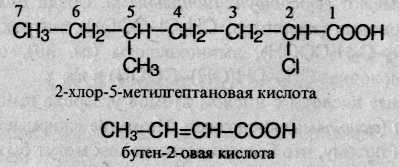
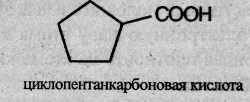
Часто карбоксильную группу рассматривают как заместитель в молекуле углеводорода. При этом в названии употребляют словосочетание «карбоновая кислота» и в нумерацию атомов углерода цепи атом углерода карбоксильной группы не включают:
Названия дикарбоновых кислот производят от названия соответствующего углеводорода с добавлением суффикса «диовая» и слова «кислота». Например, этандиовая кислота (НООС-СООН).
При рассмотрении карбоксильной группы как заместителя, название двухосновной кислоты производят от названия углеводородного радикала с добавлением словосочетания «дикарбоновая кислота». Например, малоновую кислоту (НООС-СН2-СООН) называют метандикарбоновой кислотой.
Если в углеводородном радикале карбоновых кислот атом (атомы) водорода замещен на другие функциональные группы, то такие кислоты называют гетерофункциональными. Среди них различают галогенкарбоновые (например, СН2Сl–СООН), нитрокислоты (например, NO2–C6H4COOH), аминокислоты, оксикислоты (например, молочная СН3–СН(ОН)–СООН) и др.
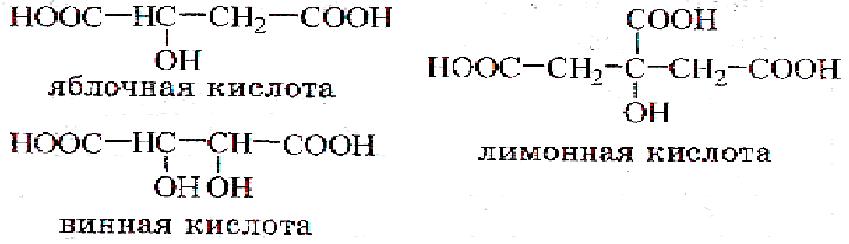

Карбоновые кислоты с числом атомов углерода выше 6 называют высшими (жирными) кислотами. Название «жирные» эти кислоты получили потому, что большинство из них могут быть выделены из жиров.
Карбоксильная группа –СООН состоит из карбонильной группы –С=О и гидроксильной группы –ОН. Свойства карбоксильной группы отличаются от свойств составляющих ее групп, которые оказывают взаимное влияние друг на друга. В группе СО атом углерода несет частичный положительный заряд и притягивает к себе неподеленную электронную пару атома кислорода в группе ОН. При этом электронная плотность на атоме кислорода уменьшается, и связь О–Н ослабляется:

В свою очередь, группа ОН «гасит» положительный заряд на группе СО, которая из-за этого теряет способность к реакциям присоединения, характерным для карбонильных соединений.
Карбоновые кислоты не единственный (хотя и самый многочисленный) класс органических веществ, обладающих кислотными свойствами; кислотные свойства имеет фенолы, пятичленный азотсодержащий гетероцикл пиррол.
Очень сильными органическими кислотами являются сульфокислоты – соединения, содержащие сульфогруппу –SO3H (например, метансульфокислота CH3SO3H). Особенно важное значение имеют сульфокислоты ароматического ряда и их производные. Они являются промежуточными продуктами для синтеза различных органических веществ.
У карбоновых кислот возможны следующие виды изомерии:
1. Изомерия углеродной цепи. Она начинается с бутановой кислоты (С3Н7СООН), которая существует в виде двух изомеров:
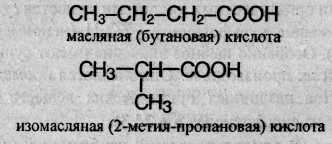
2. Изомерия положения кратной связи, например:

3. Цис- транс- изомерия, например.
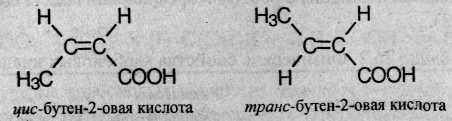
4. Межклассовая изомерия: например, масляной кислоте (СН3СН2СН2СООН) изомерны метиловый эфир пропановой кислоты (СН3СН2-СО-О-СН3) и этиловый эфир уксусной кислоты (СН3-СО-О-СН2СН3).
5. У гетерофункциональных кислот имеется изомерия, связанная с положением функциональных групп, например, существуют три изомера хлормасляной кислоты:
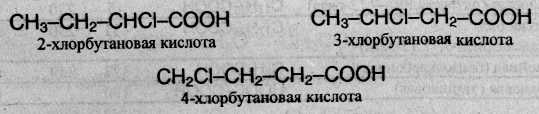
Для гетерофункциональных кислот возможна также оптическая изомерия (например, оптические изомеры молочной кислоты или аминокислот).
