
- •В.М. Васюков
- •Курс лекций
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •Основные понятия химии
- •Основные положения атомно-молекулярной теории
- •Газовые законы
- •Глава 2. Строение атома и периодический закон Модели строения атома
- •Квантовые числа электронов
- •Электронные конфигурации атомов
- •Ядро атома и радиоактивные превращения
- •Периодический закон
- •Глава 3. Химическая связь Валентность и степень окисления
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Межмолекулярные взаимодействия
- •Глава 4. Комплексные соединения
- •Глава 5. Состояние вещества
- •Глава 6. Физико-химические закономерности протекания химических реакций Химическая термодинамика
- •Химическая кинетика и катализ
- •Обратимые и необратимые реакции. Состояние химического равновесия
- •Глава 7. Физико-химическая теория растворов электролитов и неэлектролитов Механизм образования растворов и их классификация
- •Идеальные и реальные растворы. Растворение как физико-химический процесс
- •Зависимость растворимости различных веществ от природы растворителя, температуры и давления
- •Законы разбавленных растворов
- •Способы выражения концентрации (состава) растворов
- •Электролиты и электролитическая диссоциация
- •Гидролиз солей
- •Глава 8. Дисперсные системы
- •Классификации дисперсных систем
- •Оптические и молекулярно-кинетические свойства дисперсных систем
- •Поверхностные и адсорбционные явления
- •Коллоидные (коллоидно-дисперсные) системы
- •Глава 9. Теория окислительно-восстановительных процессов Окислительно-восстановительные реакции
- •Химические источники электрической энергии. Электродные потенциалы
- •1) Металлы, обладающие более электроотрицательным потенциалом, способны вытеснить менее активные металлы (с более положительным потенциалом) из водных растворов их солей;
- •Коррозия металлов
- •Электролиз
- •Восстанавливается вода Восстанавливается вода и катионы металла Восстанавливается катионы металла
- •Глава 10. Качественный и количественный анализ веществ
- •Качественный анализ
- •Классификация катионов на аналитические группы
- •Классификация анионов на аналитические группы
- •Количественный анализ
- •Химические методы анализа
- •Физические и физико-химические методы анализа
- •Часть II. Неорганическая химия
- •Глава 11. Важнейшие классы неорганических соединений
- •Основания (гидроксиды металлов)
- •Кислоты
- •Глава 12. Элементы I группы
- •Водород
- •Глава 13. Элементы II группы
- •Бериллий
- •Глава 14. Элементы III группы
- •Алюминий
- •Лантаноиды
- •Актиноиды
- •Глава 15. Элементы IV группы
- •Углерод
- •Кремний
- •Глава 16. Элементы V группы
- •Глава 17. Элементы VI группы
- •Кислород
- •Глава 18. Элементы VII группы
- •Глава 19. Элементы VIII группы
- •Часть III. Органическая химия Глава 20. Общая характеристика органических соединений
- •Теория строения органических соединений
- •Атомы в молекулах соединены между собой в определенном порядке химическими связями согласно их валентности; углерод во всех органических соединениях четырехвалентен.
- •Свойства вещества определяются не только качественным составом, но и его строением, взаимным влиянием атомов, как связанных между собой химическими связями, так и непосредственно не связанных.
- •Строение молекул может быть установлено на основе изучения их химических свойств.
- •Формулы органических соединений
- •Классификация органических соединений
- •Номенклатура органических соединений
- •Изомерия органических соединений
- •Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- •Общая характеристика органических реакций
- •Промышленное производство органических соединений
- •Глава 21. Алканы Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 22. Циклоалканы Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Глава 23. Алкены (олефины) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 24. Алкадиены (диеновые углеводороды) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 25. Алкины (ацетилены) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 26. Ароматические углеводороды (арены) Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Правила ориентации (замещения) в бензольном кольце
- •Применение
- •Глава 27. Гидроксильные соединения (спирты)
- •Одноатомные спирты (алкоголи) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Многоатомные спирты
- •Получение
- •Химические свойства
- •Применение
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 28. Карбонильные соединения (оксосоединения) Номенклатура и изомерия
- •Метаналь этаналь
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 29. Карбоновые кислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 30. Сложные эфиры. Жиры Номенклатура и изомерия
- •Физические свойства
- •Химические свойства
- •Жиры и масла
- •Глава 31. Углеводы (сахара)
- •Моносахариды Номенклатура и изомерия
- •Физические и химические свойства глюкозы
- •Дисахариды
- •Полисахариды
- •Глава 32. Амины
- •Предельные алифатические амины Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Ароматические амины
- •Физические свойства
- •Химические свойства
- •Применение
- •Глава 33. Аминокислоты, пептиды и белки
- •Аминокислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Пептиды
- •Физические свойства
- •Химические свойства
- •Биологическое значение белков
- •Глава 34. Гетероциклические соединения
- •Шестичленные гетероциклы
- •Пятичленные гетероциклы
- •Нуклеиновые кислоты Строение нуклеиновых кислот
- •Биологическая роль нуклеиновых кислот
- •Глава 35.Синтетические высокомолекулярные соединения
- •Общая характеристика полимеров
- •Пластмассы
- •Волокна
- •Каучуки
- •Литература
- •Приложения Растворимость неорганических веществ в воде при 25°c
Физические свойства
В обычных условиях первые четыре члена гомологического ряда алканов (C1 – С4) – газы. Нормальные алканы от пентана до гептадекана (C5 – С17 ) – жидкости, начиная с C18 и выше – твердые вещества. По мере увеличения числа атомов углерода в цепи, т.е. с ростом относительной молекулярной массы, возрастают температуры кипения и плавления алканов. При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы.
Алканы практически нерастворимы в воде, так как их молекулы малополярны и не взаимодействуют с молекулами воды, они хорошо растворяются в неполярных органических растворителях, таких как бензол, тетрахлорметан и др. Жидкие алканы легко смешиваются друг с другом.
Способы получения
Основные природные источники алканов – нефть и природный газ. Различные фракции нефти содержат алканы от C5H12 до С30Н62. Природный газ состоит из метана (95%) с примесью этана и пропана.
Из синтетических методов получения алканов можно выделить следующие:
1. Получение из ненасыщенных углеводородов. Взаимодействие алкенов или алкинов с водородом («гидрирование») происходит в присутствии металлических катализаторов (Ni, Pd) при нагревании:
![]()
2. Получение из галогенпроизводных. При нагревании моногалогензамещенных алканов с металлическим натрием получают алканы с удвоенным числом атомов углерода (реакция Вюрца):
![]()
Подобную реакцию не проводят с двумя разными галогензамещенными алканами, поскольку при этом получается смесь трех различных алканов.
3. Получение из солей карбоновых кислот. При сплавлении безводных солей карбоновых кислот с щелочами получают алканы, содержащие на один атом углерода меньше по сравнению с углеродной цепью исходных карбоновых кислот (реакция Дюма):
![]()
4. Получение метана. В электрической дуге, горящей в атмосфере водорода, образуется значительное количество метана:
![]()
Такая же реакция идет при нагревании углерода в атмосфере водорода но 400-500 °С при повышенном давлении в присутствии катализатора.
В лабораторных условиях метан можно получить из карбида алюминия:
![]()
Химические свойства
В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированными серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями – перманганатом калия КМnO4 и т.п.
Химическая устойчивость алканов объясняется высокой прочностью σ-связей С–С и С–Н, а также их неполярностью. Неполярные связи С–С и С–Н в алканах не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны радикальные реакции, в результате которых получаются соединения, где атомы водорода замещены на другие атомы или группы атомов. Следовательно, алканы вступают в реакции, протекающие по механизму радикального замещения, обозначаемого символом SR (от англ. substitution radicalic). По этому механизму легче всего замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода.
1. Галогенирование. При взаимодействии алканов с галогенами (хлором и бромом) под действием УФ-излучения или высокой температуры образуется смесь продуктов от моно- до полигалогензамещенных алканов. Общая схема этой реакции показана на примере метана:
![]()
Реакция имеет цепной характер. В цепной реакции выделяют несколько стадий: инициирование (зарождение цепи), рост цепи и обрыв цепи.
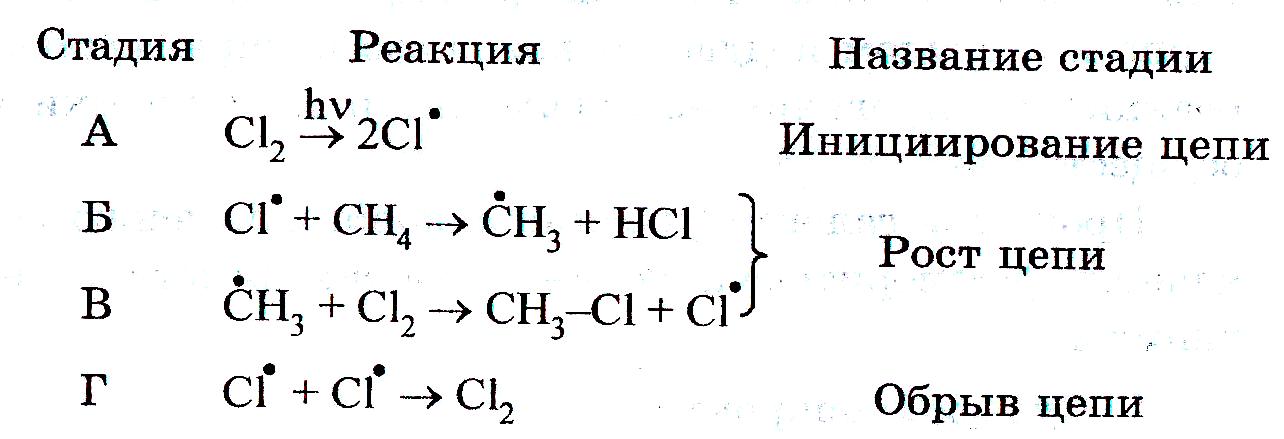
Развитие теории цепных свободнорадикальных реакций тесно связано с именем выдающегося русского ученого, лауреата Нобелевской премии Н.Н. Семенова (1896-1986).
2. Нитрование (реакция Коновалова). При действии разбавленной азотной кислоты на алканы при 140 °С и небольшом давлении протекает радикальная реакция:
![]()
Как отмечено выше, при радикальных реакциях (галогенирование, нитрование) в первую очередь замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода. Это объясняется тем, что легче всего разрывается гомолитически связь третичного атома углерода с водородом (энергия связи 376 кДж/моль), затем – вторичного (390 кДж/моль) и только потом – первичного (415 кДж/моль).
3. Изомеризация. Нормальные алканы при определенных условиях могут превращаться в алканы с разветвленной цепью:
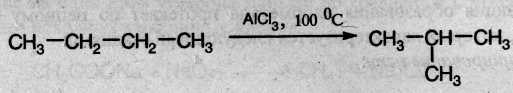
4. Крекинг – это гемолитический разрыв связей С–С, который протекает при нагревании и под действием катализаторов. При крекинге высших алканов образуются алкены и низшие алканы, при крекинге метана и этана образуются ацетилен:
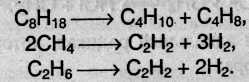
Эти реакции имеют большое промышленное значение. Таким путем высококипящие фракции нефти (мазут) превращают в бензин, керосин и другие ценные продукты.
5. Окисление. При мягком окислении метана кислородом воздуха в присутствии различных катализаторов могут быть получены метиловый спирт, формальдегид, муравьиная кислота:
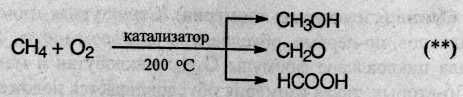
Мягкое каталитическое окисление бутана кислородом воздуха – один из промышленных способов получения уксусной кислоты:
![]()
На воздухе алканы сгорают до СО2 и Н2О:
![]()
