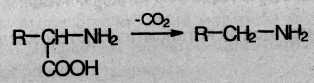- •В.М. Васюков
- •Курс лекций
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •Основные понятия химии
- •Основные положения атомно-молекулярной теории
- •Газовые законы
- •Глава 2. Строение атома и периодический закон Модели строения атома
- •Квантовые числа электронов
- •Электронные конфигурации атомов
- •Ядро атома и радиоактивные превращения
- •Периодический закон
- •Глава 3. Химическая связь Валентность и степень окисления
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Межмолекулярные взаимодействия
- •Глава 4. Комплексные соединения
- •Глава 5. Состояние вещества
- •Глава 6. Физико-химические закономерности протекания химических реакций Химическая термодинамика
- •Химическая кинетика и катализ
- •Обратимые и необратимые реакции. Состояние химического равновесия
- •Глава 7. Физико-химическая теория растворов электролитов и неэлектролитов Механизм образования растворов и их классификация
- •Идеальные и реальные растворы. Растворение как физико-химический процесс
- •Зависимость растворимости различных веществ от природы растворителя, температуры и давления
- •Законы разбавленных растворов
- •Способы выражения концентрации (состава) растворов
- •Электролиты и электролитическая диссоциация
- •Гидролиз солей
- •Глава 8. Дисперсные системы
- •Классификации дисперсных систем
- •Оптические и молекулярно-кинетические свойства дисперсных систем
- •Поверхностные и адсорбционные явления
- •Коллоидные (коллоидно-дисперсные) системы
- •Глава 9. Теория окислительно-восстановительных процессов Окислительно-восстановительные реакции
- •Химические источники электрической энергии. Электродные потенциалы
- •1) Металлы, обладающие более электроотрицательным потенциалом, способны вытеснить менее активные металлы (с более положительным потенциалом) из водных растворов их солей;
- •Коррозия металлов
- •Электролиз
- •Восстанавливается вода Восстанавливается вода и катионы металла Восстанавливается катионы металла
- •Глава 10. Качественный и количественный анализ веществ
- •Качественный анализ
- •Классификация катионов на аналитические группы
- •Классификация анионов на аналитические группы
- •Количественный анализ
- •Химические методы анализа
- •Физические и физико-химические методы анализа
- •Часть II. Неорганическая химия
- •Глава 11. Важнейшие классы неорганических соединений
- •Основания (гидроксиды металлов)
- •Кислоты
- •Глава 12. Элементы I группы
- •Водород
- •Глава 13. Элементы II группы
- •Бериллий
- •Глава 14. Элементы III группы
- •Алюминий
- •Лантаноиды
- •Актиноиды
- •Глава 15. Элементы IV группы
- •Углерод
- •Кремний
- •Глава 16. Элементы V группы
- •Глава 17. Элементы VI группы
- •Кислород
- •Глава 18. Элементы VII группы
- •Глава 19. Элементы VIII группы
- •Часть III. Органическая химия Глава 20. Общая характеристика органических соединений
- •Теория строения органических соединений
- •Атомы в молекулах соединены между собой в определенном порядке химическими связями согласно их валентности; углерод во всех органических соединениях четырехвалентен.
- •Свойства вещества определяются не только качественным составом, но и его строением, взаимным влиянием атомов, как связанных между собой химическими связями, так и непосредственно не связанных.
- •Строение молекул может быть установлено на основе изучения их химических свойств.
- •Формулы органических соединений
- •Классификация органических соединений
- •Номенклатура органических соединений
- •Изомерия органических соединений
- •Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- •Общая характеристика органических реакций
- •Промышленное производство органических соединений
- •Глава 21. Алканы Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 22. Циклоалканы Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Глава 23. Алкены (олефины) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 24. Алкадиены (диеновые углеводороды) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 25. Алкины (ацетилены) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 26. Ароматические углеводороды (арены) Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Правила ориентации (замещения) в бензольном кольце
- •Применение
- •Глава 27. Гидроксильные соединения (спирты)
- •Одноатомные спирты (алкоголи) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Многоатомные спирты
- •Получение
- •Химические свойства
- •Применение
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 28. Карбонильные соединения (оксосоединения) Номенклатура и изомерия
- •Метаналь этаналь
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 29. Карбоновые кислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 30. Сложные эфиры. Жиры Номенклатура и изомерия
- •Физические свойства
- •Химические свойства
- •Жиры и масла
- •Глава 31. Углеводы (сахара)
- •Моносахариды Номенклатура и изомерия
- •Физические и химические свойства глюкозы
- •Дисахариды
- •Полисахариды
- •Глава 32. Амины
- •Предельные алифатические амины Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Ароматические амины
- •Физические свойства
- •Химические свойства
- •Применение
- •Глава 33. Аминокислоты, пептиды и белки
- •Аминокислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Пептиды
- •Физические свойства
- •Химические свойства
- •Биологическое значение белков
- •Глава 34. Гетероциклические соединения
- •Шестичленные гетероциклы
- •Пятичленные гетероциклы
- •Нуклеиновые кислоты Строение нуклеиновых кислот
- •Биологическая роль нуклеиновых кислот
- •Глава 35.Синтетические высокомолекулярные соединения
- •Общая характеристика полимеров
- •Пластмассы
- •Волокна
- •Каучуки
- •Литература
- •Приложения Растворимость неорганических веществ в воде при 25°c
Глава 32. Амины
Амины – органические соединения, которые рассматривают как производные аммиака, в котором атомы водорода (один, два или три) замещены на углеводородные радикалы.
Амины подразделяют на первичные, вторичные, третичные в зависимости от того, сколько атомов водорода замещено на радикал:

Существуют также органические аналоги солей аммония – это четвертичные соли типа [R4N]+Cl-.
В зависимости от природы радикалов, амины могут быть алифатическими (предельными и непредельными), алициклическими, ароматическими или смешанными.
Предельные алифатические амины Номенклатура и изомерия
Общая формула предельных алифатических аминов CnH2n+3N.
Названия аминов обычно производят, перечисляя углеводородные радикалы (в алфавитном порядке) и добавляя окончание -амин, например:
![]()
По другой системе названия первичных аминов строят, исходя из названия родоначального углеводорода и добавляя окончание -амин с указанием номера атома углерода, связанного с аминогруппой.
Атом азота в молекулах аминов находится в состоянии sp3-гибридизации. Три из четырех гибридных орбиталей участвуют в образовании σ-связей N–C и N-H, на четвертой орбитали находится неподеленная электронная пара, которая обусловливает основные свойства аминов:
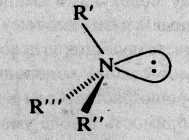
Электронодонорные заместители (предельные углеводородные радикалы) увеличивают электронную плотность на атоме азота и усиливают основные свойства аминов, поэтому вторичные амины – более сильные основания, чем первичные, поскольку два радикала создают на атоме азота большую электронную плотность, чем один.
 В
третичных аминах важную роль играет
пространственный фактор: три радикала
загораживают электронную пару атома
азота и затрудняют ее взаимодействие
с другими молекулами, поэтому основность
третичных аминов меньше, чем первичных
или вторичных.
В
третичных аминах важную роль играет
пространственный фактор: три радикала
загораживают электронную пару атома
азота и затрудняют ее взаимодействие
с другими молекулами, поэтому основность
третичных аминов меньше, чем первичных
или вторичных.
Изомерия аминов связана со строением углеродного скелета и положением аминогруппы:
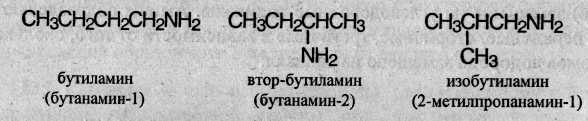
Кроме того, первичные, вторичные и третичные амины, содержащие одинаковое число атомов углерода, изомерны между собой, например:
![]()
Физические свойства
Метиламин, диметиламин и триметиламин – газы, средние члены алифатического ряда – жидкости, высшие – твердые вещества. Между молекулами аминов в жидкой фазе образуются слабые водородные связи, поэтому температуры кипения аминов выше, чем у соответствующих углеводородов.
Амины также образуют слабые водородные связи с водой, поэтому низшие амины хорошо растворимы в воде, по мере роста углеродного скелета растворимость в воде уменьшается. Низшие амины имеют характерный «рыбный» запах, высшие не имеют запаха.
Получение
1. Основной способ получения аминов – алкилирование аммиака, которое происходит при нагревании алкилгалогенидов с аммиаком:
![]()
При избытке алкилгалогенида полученный первичный амин также может вступать в реакцию алкилирования, превращаясь во вторичный или третичный амин, например:
![]()
Практически в таких реакциях получается смесь солей первичного, вторичного и третичного аминов, из которой амины выделяют под действием щелочи и разделяют путем перегонки.
2. Первичные амины также получают восстановлением нитросоединений по схеме:
![]()
Для восстановления используют сульфид аммония (реакция Зинина), цинк или железо в кислой среде, алюминий в щелочной среде или непосредственно водород в газовой фазе.
3. Первичные амины можно получать восстановлением нитрилов:
![]()
В качестве восстановителя используют алюмогидрид лития LiAlH4.
4. В биологических системах может происходить ферментативное декарбоксилирование аминокислот: