
- •В.М. Васюков
- •Курс лекций
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •Основные понятия химии
- •Основные положения атомно-молекулярной теории
- •Газовые законы
- •Глава 2. Строение атома и периодический закон Модели строения атома
- •Квантовые числа электронов
- •Электронные конфигурации атомов
- •Ядро атома и радиоактивные превращения
- •Периодический закон
- •Глава 3. Химическая связь Валентность и степень окисления
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Межмолекулярные взаимодействия
- •Глава 4. Комплексные соединения
- •Глава 5. Состояние вещества
- •Глава 6. Физико-химические закономерности протекания химических реакций Химическая термодинамика
- •Химическая кинетика и катализ
- •Обратимые и необратимые реакции. Состояние химического равновесия
- •Глава 7. Физико-химическая теория растворов электролитов и неэлектролитов Механизм образования растворов и их классификация
- •Идеальные и реальные растворы. Растворение как физико-химический процесс
- •Зависимость растворимости различных веществ от природы растворителя, температуры и давления
- •Законы разбавленных растворов
- •Способы выражения концентрации (состава) растворов
- •Электролиты и электролитическая диссоциация
- •Гидролиз солей
- •Глава 8. Дисперсные системы
- •Классификации дисперсных систем
- •Оптические и молекулярно-кинетические свойства дисперсных систем
- •Поверхностные и адсорбционные явления
- •Коллоидные (коллоидно-дисперсные) системы
- •Глава 9. Теория окислительно-восстановительных процессов Окислительно-восстановительные реакции
- •Химические источники электрической энергии. Электродные потенциалы
- •1) Металлы, обладающие более электроотрицательным потенциалом, способны вытеснить менее активные металлы (с более положительным потенциалом) из водных растворов их солей;
- •Коррозия металлов
- •Электролиз
- •Восстанавливается вода Восстанавливается вода и катионы металла Восстанавливается катионы металла
- •Глава 10. Качественный и количественный анализ веществ
- •Качественный анализ
- •Классификация катионов на аналитические группы
- •Классификация анионов на аналитические группы
- •Количественный анализ
- •Химические методы анализа
- •Физические и физико-химические методы анализа
- •Часть II. Неорганическая химия
- •Глава 11. Важнейшие классы неорганических соединений
- •Основания (гидроксиды металлов)
- •Кислоты
- •Глава 12. Элементы I группы
- •Водород
- •Глава 13. Элементы II группы
- •Бериллий
- •Глава 14. Элементы III группы
- •Алюминий
- •Лантаноиды
- •Актиноиды
- •Глава 15. Элементы IV группы
- •Углерод
- •Кремний
- •Глава 16. Элементы V группы
- •Глава 17. Элементы VI группы
- •Кислород
- •Глава 18. Элементы VII группы
- •Глава 19. Элементы VIII группы
- •Часть III. Органическая химия Глава 20. Общая характеристика органических соединений
- •Теория строения органических соединений
- •Атомы в молекулах соединены между собой в определенном порядке химическими связями согласно их валентности; углерод во всех органических соединениях четырехвалентен.
- •Свойства вещества определяются не только качественным составом, но и его строением, взаимным влиянием атомов, как связанных между собой химическими связями, так и непосредственно не связанных.
- •Строение молекул может быть установлено на основе изучения их химических свойств.
- •Формулы органических соединений
- •Классификация органических соединений
- •Номенклатура органических соединений
- •Изомерия органических соединений
- •Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- •Общая характеристика органических реакций
- •Промышленное производство органических соединений
- •Глава 21. Алканы Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 22. Циклоалканы Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Глава 23. Алкены (олефины) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 24. Алкадиены (диеновые углеводороды) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 25. Алкины (ацетилены) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 26. Ароматические углеводороды (арены) Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Правила ориентации (замещения) в бензольном кольце
- •Применение
- •Глава 27. Гидроксильные соединения (спирты)
- •Одноатомные спирты (алкоголи) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Многоатомные спирты
- •Получение
- •Химические свойства
- •Применение
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 28. Карбонильные соединения (оксосоединения) Номенклатура и изомерия
- •Метаналь этаналь
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 29. Карбоновые кислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 30. Сложные эфиры. Жиры Номенклатура и изомерия
- •Физические свойства
- •Химические свойства
- •Жиры и масла
- •Глава 31. Углеводы (сахара)
- •Моносахариды Номенклатура и изомерия
- •Физические и химические свойства глюкозы
- •Дисахариды
- •Полисахариды
- •Глава 32. Амины
- •Предельные алифатические амины Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Ароматические амины
- •Физические свойства
- •Химические свойства
- •Применение
- •Глава 33. Аминокислоты, пептиды и белки
- •Аминокислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Пептиды
- •Физические свойства
- •Химические свойства
- •Биологическое значение белков
- •Глава 34. Гетероциклические соединения
- •Шестичленные гетероциклы
- •Пятичленные гетероциклы
- •Нуклеиновые кислоты Строение нуклеиновых кислот
- •Биологическая роль нуклеиновых кислот
- •Глава 35.Синтетические высокомолекулярные соединения
- •Общая характеристика полимеров
- •Пластмассы
- •Волокна
- •Каучуки
- •Литература
- •Приложения Растворимость неорганических веществ в воде при 25°c
Химические свойства
Химические свойства спиртов определяются присутствием в их молекулах группы -ОН.
Связи С–О и О–Н сильно полярны и способны к разрыву. Различают два основных типа реакций спиртов с участием функциональной группы -ОН:
Реакции с разрывом связи О–Н: а) взаимодействие спиртов с щелочными и щелочноземельными металлами с образованием алкоголятов; б) реакции спиртов с органическими и минеральными кислотами с образованием сложных эфиров; в) окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений. Скорость реакций, при которых разрывается связь О–Н, уменьшается в ряду: первичные спирты > вторичные > третичные.
Реакции, сопровождающиеся разрывом связи С–О: а) каталитическая дегидратация с образованием алкенов (внутримолекулярная дегидратация) или простых эфиров (межмолекулярная дегидратация); б) замещение группы –ОН галогеном, например при действии галогеноводородов с образованием алкилгалогенидов. Скорость реакций, при которых разрывается связь С–О, уменьшается в ряду: третичные спирты > вторичные > первичные.
Спирты – амфотерные соединения.
Реакции с разрывом связи О–Н.
1. Кислотные свойства спиртов выражены очень слабо. Низшие спирты бурно реагируют со щелочными металлами:
![]()
но не реагируют со щелочами. С увеличением длины углеводородного радикала скорость этой реакции замедляется.
В присутствии следов влаги соли спиртов (алкоголяты) гидролизуются до исходных спиртов:
![]()
Это доказывает, что спирты – более слабые кислоты, чем вода.
2. При действии на спирты минеральных и органических кислот образуются сложные эфиры. Образование сложных эфиров протекает по механизму нуклеофильного присоединения-отщепления:

Отличительной особенностью первой из этих реакций является то, что атом водорода отщепляется от спирта, а группа ОН – от кислоты.
3) Спирты окисляются под действием дихромата или перманганата калия до карбонильных соединений. Первичные спирты окисляются в альдегиды, которые, в свою очередь, могут окисляться в карбоновые кислоты:
![]()
Вторичные спирты окисляются в кетоны:
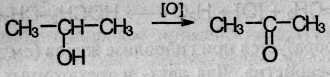
Третичные спирты могут окисляться только с разрывом С–С связей.
Реакции с разрывом связи С–О.
1) Реакции дегидратации протекают при нагревании спиртов с водоотнимающими веществами. При сильном нагревании происходит внутримолекулярная дегидратация с образованием алкенов:
![]()
При более слабом нагревании происходит межмолекулярная дегидратация с образованием простых эфиров:
![]()
2) Спирты обратимо реагируют с галогеноводородными кислотами по механизму нуклеофильного замещения SN :
![]()
Третичные спирты реагируют быстро, вторичные и первичные – медленно.
Применение
Спирты главным образом используют в промышленности органического синтеза.
Метиловый спирт СН3ОН – ядовитая жидкость температурой кипения 65°С, легко смешивается с водой. Главное промышленное применение метанола – получение формальдегида, метанол используется также качестве растворителя органических веществ. Токсичен в любых дозах, в малых количествах вызывает слепоту, больших – смерть.
Этиловый спирт С2Н5ОН – бесцветная жидкость температурой кипения 78°С, смешивается с водой в любых соотношениях. Этанол относится к числу наиболее важных технических продуктов. 80% вырабатываемого спирта используется на технические нужды. Этанол является исходным веществом для получения многих органически соединений, используется в качестве растворителя, как дезинфицирующее средство в медицине, для изготовления лекарственных препаратов и парфюмерно-косметических средств. Предназначенный для технических целей спирт денатурируют – делают непригодным для питья, добавляв к нему метиловый спирт, формалин, пиридин. Такой спирт особенно ядовит.
Высшие жирные спирты (ВЖС) содержат более десяти углеродных атомов. Сырье для их получения поставляет нефтехимическая промышленность. Мировое производство ВЖС составляет около 1 млн. т в год. Применяются ВЖС в качестве поверхностно-активных веществ (ПАВ) – антииспарителей (защита водоемов), пенообразователей (флотация руд), для получения синтетических моющих средств, которые полностью разрушаются при биохимической очистке сточных вод и потому не загрязняют водоемы. Цетиловый спирт С16Н33ОН и мирициловый спирт С30Н61ОН встречаются в природе. Первый из них в виде сложного эфира пальмитиновой кислоты составляет главную часть спермацета, добываемого из черепных полостей китов. Мирициловый спирт в виде эфира пальмитиновой кислоты входит в состав пчелиного воска.
