
- •В.М. Васюков
- •Курс лекций
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •Основные понятия химии
- •Основные положения атомно-молекулярной теории
- •Газовые законы
- •Глава 2. Строение атома и периодический закон Модели строения атома
- •Квантовые числа электронов
- •Электронные конфигурации атомов
- •Ядро атома и радиоактивные превращения
- •Периодический закон
- •Глава 3. Химическая связь Валентность и степень окисления
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Межмолекулярные взаимодействия
- •Глава 4. Комплексные соединения
- •Глава 5. Состояние вещества
- •Глава 6. Физико-химические закономерности протекания химических реакций Химическая термодинамика
- •Химическая кинетика и катализ
- •Обратимые и необратимые реакции. Состояние химического равновесия
- •Глава 7. Физико-химическая теория растворов электролитов и неэлектролитов Механизм образования растворов и их классификация
- •Идеальные и реальные растворы. Растворение как физико-химический процесс
- •Зависимость растворимости различных веществ от природы растворителя, температуры и давления
- •Законы разбавленных растворов
- •Способы выражения концентрации (состава) растворов
- •Электролиты и электролитическая диссоциация
- •Гидролиз солей
- •Глава 8. Дисперсные системы
- •Классификации дисперсных систем
- •Оптические и молекулярно-кинетические свойства дисперсных систем
- •Поверхностные и адсорбционные явления
- •Коллоидные (коллоидно-дисперсные) системы
- •Глава 9. Теория окислительно-восстановительных процессов Окислительно-восстановительные реакции
- •Химические источники электрической энергии. Электродные потенциалы
- •1) Металлы, обладающие более электроотрицательным потенциалом, способны вытеснить менее активные металлы (с более положительным потенциалом) из водных растворов их солей;
- •Коррозия металлов
- •Электролиз
- •Восстанавливается вода Восстанавливается вода и катионы металла Восстанавливается катионы металла
- •Глава 10. Качественный и количественный анализ веществ
- •Качественный анализ
- •Классификация катионов на аналитические группы
- •Классификация анионов на аналитические группы
- •Количественный анализ
- •Химические методы анализа
- •Физические и физико-химические методы анализа
- •Часть II. Неорганическая химия
- •Глава 11. Важнейшие классы неорганических соединений
- •Основания (гидроксиды металлов)
- •Кислоты
- •Глава 12. Элементы I группы
- •Водород
- •Глава 13. Элементы II группы
- •Бериллий
- •Глава 14. Элементы III группы
- •Алюминий
- •Лантаноиды
- •Актиноиды
- •Глава 15. Элементы IV группы
- •Углерод
- •Кремний
- •Глава 16. Элементы V группы
- •Глава 17. Элементы VI группы
- •Кислород
- •Глава 18. Элементы VII группы
- •Глава 19. Элементы VIII группы
- •Часть III. Органическая химия Глава 20. Общая характеристика органических соединений
- •Теория строения органических соединений
- •Атомы в молекулах соединены между собой в определенном порядке химическими связями согласно их валентности; углерод во всех органических соединениях четырехвалентен.
- •Свойства вещества определяются не только качественным составом, но и его строением, взаимным влиянием атомов, как связанных между собой химическими связями, так и непосредственно не связанных.
- •Строение молекул может быть установлено на основе изучения их химических свойств.
- •Формулы органических соединений
- •Классификация органических соединений
- •Номенклатура органических соединений
- •Изомерия органических соединений
- •Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- •Общая характеристика органических реакций
- •Промышленное производство органических соединений
- •Глава 21. Алканы Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 22. Циклоалканы Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Глава 23. Алкены (олефины) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 24. Алкадиены (диеновые углеводороды) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 25. Алкины (ацетилены) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 26. Ароматические углеводороды (арены) Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Правила ориентации (замещения) в бензольном кольце
- •Применение
- •Глава 27. Гидроксильные соединения (спирты)
- •Одноатомные спирты (алкоголи) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Многоатомные спирты
- •Получение
- •Химические свойства
- •Применение
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 28. Карбонильные соединения (оксосоединения) Номенклатура и изомерия
- •Метаналь этаналь
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 29. Карбоновые кислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 30. Сложные эфиры. Жиры Номенклатура и изомерия
- •Физические свойства
- •Химические свойства
- •Жиры и масла
- •Глава 31. Углеводы (сахара)
- •Моносахариды Номенклатура и изомерия
- •Физические и химические свойства глюкозы
- •Дисахариды
- •Полисахариды
- •Глава 32. Амины
- •Предельные алифатические амины Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Ароматические амины
- •Физические свойства
- •Химические свойства
- •Применение
- •Глава 33. Аминокислоты, пептиды и белки
- •Аминокислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Пептиды
- •Физические свойства
- •Химические свойства
- •Биологическое значение белков
- •Глава 34. Гетероциклические соединения
- •Шестичленные гетероциклы
- •Пятичленные гетероциклы
- •Нуклеиновые кислоты Строение нуклеиновых кислот
- •Биологическая роль нуклеиновых кислот
- •Глава 35.Синтетические высокомолекулярные соединения
- •Общая характеристика полимеров
- •Пластмассы
- •Волокна
- •Каучуки
- •Литература
- •Приложения Растворимость неорганических веществ в воде при 25°c
Физические свойства
Физические свойства алкенов похожи на свойства алканов, хотя все они имеют несколько более низкие температуры плавления и кипения, чем соответствующие алканы. Например, пентан имеет температуру кипения 36 °С, а пентен-1 – 30 °С. При обычных условиях алкены С2 – С4– газы, С5 – С15 – жидкости, начиная с C16 – твердые вещества. Алкены не растворимы в воде, хорошо растворимы в органических растворителях.
Получение
В природе алкены встречаются редко. Поскольку алкены являются ценным сырьем для промышленного органического синтеза, разработаны многие способы их получения.
1. Основным промышленным источником алкенов служит крекинг алканов, входящих в состав нефти:
![]()
Крекинг протекает по свободнорадикальному механизму при 400-700°С.
2. Другой промышленный способ получения алкенов – дегидрирование алканов:
![]()
3. В лабораторных условиях алкены получают по реакциям отщепления (элиминирования), при которых от соседних атомов углерода отщепляются два атома или две группы атомов, и образуется дополнительная π-связь. К таким реакциям относятся следующие.
1) Дегидратация спиртов происходит при их нагревании с водоотнимающими средствами, например с серной кислотой при температуре выше 150 °С:
![]()
2) Отщепление галогеноводородов проводят при действии спиртовых растворов щелочей на моноалкилгалогениды:
![]()
При отщеплении Н2О от спиртов, НВr и HCl от алкилгалогенидов атом водорода преимущественно отщепляется от того из соседних атомов углерода, который связан с наименьшим числом атомов водорода (от наименее гидрогенизированного атома углерода) – эта закономерность носит название правила Зайцева.
3) Дегалогенирование происходит при нагревании дигалогенидов, имеющих атомы галогена у соседних атомов углерода, с активными металлами:
![]()
Химические свойства
Химические свойства алкенов определяются наличием в их молекулах двойной связи. Электронная плотность π-связи достаточно подвижна и легко вступает в реакции с электрофильными частицами. Поэтому многие реакции алкенов протекают по механизму электрофильного присоединения, обозначаемому символом АЕ (от англ. addition electrophilic). Реакции электрофильного присоединения – это ионные процессы, протекающие в несколько стадий.
На первой стадии электрофильная частица (чаще всего это бывает протон Н+) взаимодействует с π-электронами двойной связи и образует π-комплекс, который затем превращается в карбокатион путем образования ковалентной σ-связи между электрофильной частицей и одним из атомов углерода:

На второй стадии карбокатион реагирует с анионом X , образуя вторую σ-связь за счет электронной пары аниона:
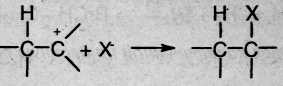
Ион водорода в реакциях электрофильного присоединения присоединяется к тому из атомов углерода при двойной связи, на котором больше отрицательный заряд. Распределение зарядов определяется смещением л- электронной плотности под влиянием заместителей:
![]()
Электронодонорные заместители, проявляющие +I-эффект, смещают π-электронную плотность к более гидрогенизированному атому углерода и создают на нем частичный отрицательный заряд.
Этим объясняется правило Марковникова: при присоединении полярных молекул типа НХ (X = Hal, ОН, CN и т.п.) к несимметричным алкенам водород преимущественно присоединяется к более гидрогенизированному атому углерода при двойной связи.
Рассмотрим конкретные примеры реакций присоединения.
1) Гидрогалогенирование. При взаимодействии алкенов с галогеноводородами (HCl, НВr) образуются алкилгалогениды:
![]()
Продукты реакции определяются правилом Марковникова.
Следует, однако, подчеркнуть, что в присутствии какого-либо органического пероксида полярные молекулы НХ реагируют с алкенами не по правилу Марковникова:
![]()
Это связано с тем, что присутствие перекиси обусловливает радикальный, а не ионный механизм реакции.
2) Гидратация. При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов. Присоединение воды также идет по правилу Марковникова:
![]()
3) Галогенирование. Алкены обесцвечивают бромную воду:
![]()
Эта реакция является качественной на двойную связь.
4) Гидрирование. Присоединение водорода происходит в присутствии металлических катализаторов:
![]()
5) Полимеризация алкенов и их производных в присутствии кислот протекает по механизму АЕ:
![]()
Где R = Н, СН3, Cl, С6Н5 и т.д. Молекула CH2=CHR называется мономером, полученное соединение – полимером, число п – степень полимеризации.
Полимеризация различных производных алкенов дает ценные промышленные продукты: полиэтилен, полипропилен, поливинилхлорид и другие.
Кроме присоединения, для алкенов характерны также реакции окисления. При мягком окислении алкенов водным раствором перманганата калия (реакция Вагнера) образуются двухатомные спирты:
![]()
В результате протекания этой реакции фиолетовый раствор перманганата калия быстро обесцвечивается и выпадает коричневый осадок оксида марганца (IV). Эта реакция, как и реакция обесцвечивания бромной воды, является качественной на двойную связь. При жестком окислении алкенов кипящим раствором перманганата калия в кислой среде происходит полный разрыв двойной связи с образованием кетонов, карбоновых кислот или СО2, например:
![]()
По продуктам окисления можно установить положение двойной связи в исходном алкене.
Как и все другие углеводороды, алкены горят, и при обильном доступе воздуха образуют диоксид углерода и воду:
![]()
При ограниченном доступе воздуха горение алкенов может приводить к образованию монооксида углерода и воды:
![]()
Если смешать алкен с кислородом и пропустить эту смесь над нагретым до 200°С серебряным катализатором, то образуется оксид алкена (эпоксиалкан), например:
![]()
При любых температурах алкены окисляются озоном (озон более сильный окислитель, чем кислород). Если газообразный озон пропускают через раствор какого-либо алкена в тетрахлорметане при температурах ниже комнатной, то происходит реакция присоединения и образуются соответствующие озониды (циклические перекиси). Озониды очень неустойчивы и могут легко взрываться. Поэтому обычно их не выделяют, а сразу после получения разлагают водой – при этом образуются карбонильные соединения (альдегиды или кетоны), строение которых указывает на строение подвергавшегося озонированию алкена.
