- •В.М. Васюков
- •Курс лекций
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •Основные понятия химии
- •Основные положения атомно-молекулярной теории
- •Газовые законы
- •Глава 2. Строение атома и периодический закон Модели строения атома
- •Квантовые числа электронов
- •Электронные конфигурации атомов
- •Ядро атома и радиоактивные превращения
- •Периодический закон
- •Глава 3. Химическая связь Валентность и степень окисления
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Межмолекулярные взаимодействия
- •Глава 4. Комплексные соединения
- •Глава 5. Состояние вещества
- •Глава 6. Физико-химические закономерности протекания химических реакций Химическая термодинамика
- •Химическая кинетика и катализ
- •Обратимые и необратимые реакции. Состояние химического равновесия
- •Глава 7. Физико-химическая теория растворов электролитов и неэлектролитов Механизм образования растворов и их классификация
- •Идеальные и реальные растворы. Растворение как физико-химический процесс
- •Зависимость растворимости различных веществ от природы растворителя, температуры и давления
- •Законы разбавленных растворов
- •Способы выражения концентрации (состава) растворов
- •Электролиты и электролитическая диссоциация
- •Гидролиз солей
- •Глава 8. Дисперсные системы
- •Классификации дисперсных систем
- •Оптические и молекулярно-кинетические свойства дисперсных систем
- •Поверхностные и адсорбционные явления
- •Коллоидные (коллоидно-дисперсные) системы
- •Глава 9. Теория окислительно-восстановительных процессов Окислительно-восстановительные реакции
- •Химические источники электрической энергии. Электродные потенциалы
- •1) Металлы, обладающие более электроотрицательным потенциалом, способны вытеснить менее активные металлы (с более положительным потенциалом) из водных растворов их солей;
- •Коррозия металлов
- •Электролиз
- •Восстанавливается вода Восстанавливается вода и катионы металла Восстанавливается катионы металла
- •Глава 10. Качественный и количественный анализ веществ
- •Качественный анализ
- •Классификация катионов на аналитические группы
- •Классификация анионов на аналитические группы
- •Количественный анализ
- •Химические методы анализа
- •Физические и физико-химические методы анализа
- •Часть II. Неорганическая химия
- •Глава 11. Важнейшие классы неорганических соединений
- •Основания (гидроксиды металлов)
- •Кислоты
- •Глава 12. Элементы I группы
- •Водород
- •Глава 13. Элементы II группы
- •Бериллий
- •Глава 14. Элементы III группы
- •Алюминий
- •Лантаноиды
- •Актиноиды
- •Глава 15. Элементы IV группы
- •Углерод
- •Кремний
- •Глава 16. Элементы V группы
- •Глава 17. Элементы VI группы
- •Кислород
- •Глава 18. Элементы VII группы
- •Глава 19. Элементы VIII группы
- •Часть III. Органическая химия Глава 20. Общая характеристика органических соединений
- •Теория строения органических соединений
- •Атомы в молекулах соединены между собой в определенном порядке химическими связями согласно их валентности; углерод во всех органических соединениях четырехвалентен.
- •Свойства вещества определяются не только качественным составом, но и его строением, взаимным влиянием атомов, как связанных между собой химическими связями, так и непосредственно не связанных.
- •Строение молекул может быть установлено на основе изучения их химических свойств.
- •Формулы органических соединений
- •Классификация органических соединений
- •Номенклатура органических соединений
- •Изомерия органических соединений
- •Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- •Общая характеристика органических реакций
- •Промышленное производство органических соединений
- •Глава 21. Алканы Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 22. Циклоалканы Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Глава 23. Алкены (олефины) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 24. Алкадиены (диеновые углеводороды) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 25. Алкины (ацетилены) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 26. Ароматические углеводороды (арены) Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Правила ориентации (замещения) в бензольном кольце
- •Применение
- •Глава 27. Гидроксильные соединения (спирты)
- •Одноатомные спирты (алкоголи) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Многоатомные спирты
- •Получение
- •Химические свойства
- •Применение
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 28. Карбонильные соединения (оксосоединения) Номенклатура и изомерия
- •Метаналь этаналь
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 29. Карбоновые кислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 30. Сложные эфиры. Жиры Номенклатура и изомерия
- •Физические свойства
- •Химические свойства
- •Жиры и масла
- •Глава 31. Углеводы (сахара)
- •Моносахариды Номенклатура и изомерия
- •Физические и химические свойства глюкозы
- •Дисахариды
- •Полисахариды
- •Глава 32. Амины
- •Предельные алифатические амины Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Ароматические амины
- •Физические свойства
- •Химические свойства
- •Применение
- •Глава 33. Аминокислоты, пептиды и белки
- •Аминокислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Пептиды
- •Физические свойства
- •Химические свойства
- •Биологическое значение белков
- •Глава 34. Гетероциклические соединения
- •Шестичленные гетероциклы
- •Пятичленные гетероциклы
- •Нуклеиновые кислоты Строение нуклеиновых кислот
- •Биологическая роль нуклеиновых кислот
- •Глава 35.Синтетические высокомолекулярные соединения
- •Общая характеристика полимеров
- •Пластмассы
- •Волокна
- •Каучуки
- •Литература
- •Приложения Растворимость неорганических веществ в воде при 25°c
Применение
Промышленное использование алканов подробно рассмотрено выше. Метан, этан, бутан, и другие алканы широко применяются как сырье для промышленных синтезов.
Глава 22. Циклоалканы Номенклатура и изомерия
Циклоалканы – это предельные циклические углеводороды. Простейшие представители этого ряда:
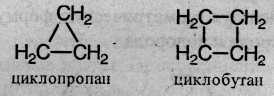
Общая формула гомологического ряда циклоалканов СnН2n. Точно такой же формулой описывается гомологический ряд алкенов, из чего следует, что каждому циклоалкану изомерен соответствующий алкен – это пример так называемой межклассовой изомерии.
Каждый атом углерода в циклоалканах находится в состоянии sр3-гибридизации и образует четыре σ-связи С-С и С-Н. Углы между связями зависят от размера цикла. В простейших циклах С3 и С4 углы между связями С-С сильно отличаются от тетраэдрического угла 109,5°, что создает в молекулах напряжение и обеспечивает их высокую реакционную способность. Свободное вращение вокруг связей С-С, образующих цикл, невозможно.
Для циклоалканов, как и для всех классов органических соединений, характерна изомерия углеродного скелета (структурная изомерия). Структурная изомерия для циклоалканов, во-первых, обусловлена размером цикла. Так, существуют два циклоалкана формулы С4Н8: циклобутан и метилциклопропан. Во-вторых, такая изомерия обусловливается положением заместителей в цикле (например, 1,1 и 1,2-диметилбутан).
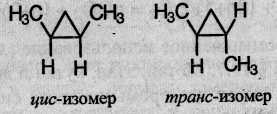
Отсутствие свободного вращения вокруг связей С-С в цикле создает предпосылки для существования пространственных изомеров у некоторых замещенных циклоалканов. Например, в молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цис- изомер) или по разные стороны (транс- изомер):
По размеру цикла циклоалканы делятся на ряд групп, из которых мы рассмотрим малые (С3, С4) и обычные (C5-С7) циклы.
Названия циклоалканов строятся путем добавления приставки цикло- к названию алкана с соответствующим числом атомов углерода. Нумерацию в цикле производят таким образом, чтобы заместители получили наименьшие номера.
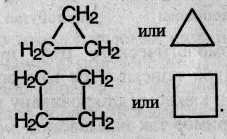
Структурные формулы циклоалканов обычно записывают в сокращенном виде, используя геометрическую форму цикла и опуская символы атомов углерода и водорода.
Физические свойства
При обычных условиях первые два члена ряда (С3 - С4) – газы, (C5 – C16) – жидкости, начиная с С17 – твердые вещества. Температуры кипения и плавления циклоалканов выше, чем у соответствующих алканов.
Получение
1. Основной способ получения циклоалканов - отщепление двух атомов галогена от дигалогеналканов:
2. При каталитическом гидрировании ароматических углеводородов образуются циклогексан или его производные:
![]()
Химические свойства
По химическим свойствам малые и обычные циклы существенно различаются между собою. Циклопропан и циклобутан склонны к реакциям присоединения, т.е. сходны в этом отношении с алкенами. Циклопентан и циклогексан по своему химическому поведению близки к алканам, так как вступают в реакции замещения.
1. Так, например, циклопропан и циклобутан способны присоединять бром (хотя реакция и вдет труднее, чем с прощеном или бутеном):
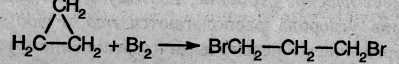
2. Циклопропан, циклобутан и даже циклопентан могут присоединять водород, давая соответствующие нормальные алканы. Присоединение происходит при нагревании в присутствии никелевого катализатора:
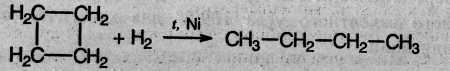
3. В реакцию присоединения с галогеноводородами опять же вступают только малые циклы. Присоединение к гомологам циклопропана происходит по правилу Марковникова:
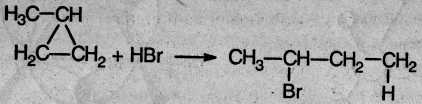
4. Реакции замещения. Обычные циклы (С6 и выше) устойчивы и вступают только в реакции радикального замещения подобно алканам:
![]()
5. Дегидрирование циклогексана в присутствии никелевого катализатора приводит к образованию бензола:
![]()
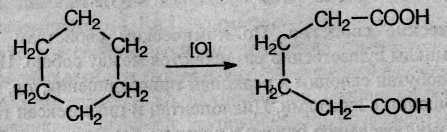
6. При действии сильных окислителей (например, 50%-ной азотной кислоты) на циклогексан в присутствии катализатора образуется адипиновая (гександиовая) кислота: