- •В.М. Васюков
- •Курс лекций
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •Основные понятия химии
- •Основные положения атомно-молекулярной теории
- •Газовые законы
- •Глава 2. Строение атома и периодический закон Модели строения атома
- •Квантовые числа электронов
- •Электронные конфигурации атомов
- •Ядро атома и радиоактивные превращения
- •Периодический закон
- •Глава 3. Химическая связь Валентность и степень окисления
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Межмолекулярные взаимодействия
- •Глава 4. Комплексные соединения
- •Глава 5. Состояние вещества
- •Глава 6. Физико-химические закономерности протекания химических реакций Химическая термодинамика
- •Химическая кинетика и катализ
- •Обратимые и необратимые реакции. Состояние химического равновесия
- •Глава 7. Физико-химическая теория растворов электролитов и неэлектролитов Механизм образования растворов и их классификация
- •Идеальные и реальные растворы. Растворение как физико-химический процесс
- •Зависимость растворимости различных веществ от природы растворителя, температуры и давления
- •Законы разбавленных растворов
- •Способы выражения концентрации (состава) растворов
- •Электролиты и электролитическая диссоциация
- •Гидролиз солей
- •Глава 8. Дисперсные системы
- •Классификации дисперсных систем
- •Оптические и молекулярно-кинетические свойства дисперсных систем
- •Поверхностные и адсорбционные явления
- •Коллоидные (коллоидно-дисперсные) системы
- •Глава 9. Теория окислительно-восстановительных процессов Окислительно-восстановительные реакции
- •Химические источники электрической энергии. Электродные потенциалы
- •1) Металлы, обладающие более электроотрицательным потенциалом, способны вытеснить менее активные металлы (с более положительным потенциалом) из водных растворов их солей;
- •Коррозия металлов
- •Электролиз
- •Восстанавливается вода Восстанавливается вода и катионы металла Восстанавливается катионы металла
- •Глава 10. Качественный и количественный анализ веществ
- •Качественный анализ
- •Классификация катионов на аналитические группы
- •Классификация анионов на аналитические группы
- •Количественный анализ
- •Химические методы анализа
- •Физические и физико-химические методы анализа
- •Часть II. Неорганическая химия
- •Глава 11. Важнейшие классы неорганических соединений
- •Основания (гидроксиды металлов)
- •Кислоты
- •Глава 12. Элементы I группы
- •Водород
- •Глава 13. Элементы II группы
- •Бериллий
- •Глава 14. Элементы III группы
- •Алюминий
- •Лантаноиды
- •Актиноиды
- •Глава 15. Элементы IV группы
- •Углерод
- •Кремний
- •Глава 16. Элементы V группы
- •Глава 17. Элементы VI группы
- •Кислород
- •Глава 18. Элементы VII группы
- •Глава 19. Элементы VIII группы
- •Часть III. Органическая химия Глава 20. Общая характеристика органических соединений
- •Теория строения органических соединений
- •Атомы в молекулах соединены между собой в определенном порядке химическими связями согласно их валентности; углерод во всех органических соединениях четырехвалентен.
- •Свойства вещества определяются не только качественным составом, но и его строением, взаимным влиянием атомов, как связанных между собой химическими связями, так и непосредственно не связанных.
- •Строение молекул может быть установлено на основе изучения их химических свойств.
- •Формулы органических соединений
- •Классификация органических соединений
- •Номенклатура органических соединений
- •Изомерия органических соединений
- •Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- •Общая характеристика органических реакций
- •Промышленное производство органических соединений
- •Глава 21. Алканы Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 22. Циклоалканы Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Глава 23. Алкены (олефины) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 24. Алкадиены (диеновые углеводороды) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 25. Алкины (ацетилены) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 26. Ароматические углеводороды (арены) Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Правила ориентации (замещения) в бензольном кольце
- •Применение
- •Глава 27. Гидроксильные соединения (спирты)
- •Одноатомные спирты (алкоголи) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Многоатомные спирты
- •Получение
- •Химические свойства
- •Применение
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 28. Карбонильные соединения (оксосоединения) Номенклатура и изомерия
- •Метаналь этаналь
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 29. Карбоновые кислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 30. Сложные эфиры. Жиры Номенклатура и изомерия
- •Физические свойства
- •Химические свойства
- •Жиры и масла
- •Глава 31. Углеводы (сахара)
- •Моносахариды Номенклатура и изомерия
- •Физические и химические свойства глюкозы
- •Дисахариды
- •Полисахариды
- •Глава 32. Амины
- •Предельные алифатические амины Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Ароматические амины
- •Физические свойства
- •Химические свойства
- •Применение
- •Глава 33. Аминокислоты, пептиды и белки
- •Аминокислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Пептиды
- •Физические свойства
- •Химические свойства
- •Биологическое значение белков
- •Глава 34. Гетероциклические соединения
- •Шестичленные гетероциклы
- •Пятичленные гетероциклы
- •Нуклеиновые кислоты Строение нуклеиновых кислот
- •Биологическая роль нуклеиновых кислот
- •Глава 35.Синтетические высокомолекулярные соединения
- •Общая характеристика полимеров
- •Пластмассы
- •Волокна
- •Каучуки
- •Литература
- •Приложения Растворимость неорганических веществ в воде при 25°c
Применение
На основе ацетилена развились многие отрасли промышленности органического синтеза. Выше уже отмечена возможность получения уксусного альдегида из ацетилена и различных кетонов из гомологов ацетилена по реакции Кучерова. В свою очередь, большой интерес представляют реакции алкинов с кетонами. Например, реакцией ацетилена с ацетоном можно получить изопрен – исходный продукт для получения синтетического каучука. Хлоропрен также получают из винилацетилена (см. выше реакцию димеризации ацетилена). Ацетилен используется для сварки (кислородно-ацетиленовая сварка) металлов, поскольку при его горении развивается высокая температура.
Глава 26. Ароматические углеводороды (арены) Номенклатура и изомерия
Ароматическими углеводородами (аренами) называют вещества, в молекулах которых содержится одно или несколько бензольных колец – циклических групп атомов углерода с особым характером связей.
Рассмотрим строение молекулы бензола. Молекулярная формула бензола – СбН6. Первая структура бензола была предложена в 1865 г. немецким ученым А. Кекуле:
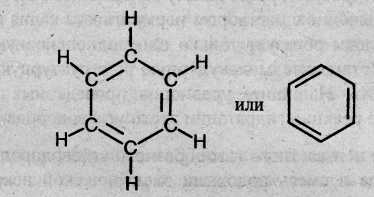
Эта формула правильно отражает равноценность шести атомов углерода, однако не объясняет ряд особых свойств бензола. Например, несмотря на ненасыщенность, бензол не проявляет склонности к реакциям присоединения: он не обесцвечивает бромную воду и раствор перманганата калия, т.е. не дает типичных для непредельных соединений качественных реакций. Поэтому вопрос о строении бензола привлекал внимание исследователей на протяжении десятков лет.
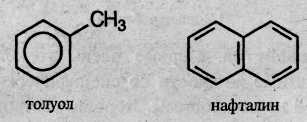
Условно арены можно разделить на два ряда. К первому относят производные бензола (например, толуол), ко второму – конденсированные арены (простейший из них – нафталин):
Рассмотрим гомологический ряд бензола с общей формулой CnH.2n-6.
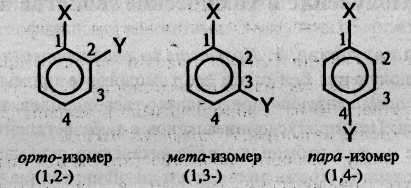
Структурная изомерия в ряду бензола обусловлена взаимным расположением заместителей в кольце. Если в бензольном кольце только один заместитель, то такое соединение не имеет ароматических изомеров, так как все атомы углерода в бензольном кольце равноценны. Если с кольцом связаны два заместителя, то они могут находиться в трех разных положениях относительно друг друга.
Положение заместителей указывают цифрами или обозначают словами: орто (о-), мета (м-), пара (n-):
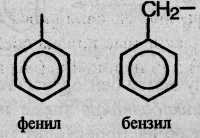
При отщеплении атома водорода от молекул ароматических углеводородов образуются ароматические радикалы общей формулы СnН2n-7 (их называют арильными радикалами), простейшие из которых – фенил и бензил:
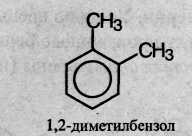
Название ароматических углеводородов происходит от слова «бензол» с указанием заместителей в бензольном кольце и их положения, например:
Особенности строения и свойств бензола удалось полностью объяснить только после развития современной квантовомеханической теории химических связей. По современным представлениям, все шесть атомов углерода в молекуле бензола находятся в sр2-гибридном состоянии. Каждый атом углерода образует σ-связи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Валентные углы между тремя σ-связями равны 120°. Таким образом, все шесть атомов углерода лежат в одной плоскости, образуя правильный шестиугольник (σ-скелет молекулы бензола).
Каждый атом углерода имеет одну негибридную p-орбиталь. Шесть таких орбиталей располагаются перпендикулярно плоскому σ-скелету и параллельно друг другу. Все шесть р-электронов взаимодействуют между собой, образуя π-связи, не локализованные в пары, как при образовании обычных двойных связей, а образующие единое π-электронное облако. Таким образом, в молекуле бензола осуществляется круговое сопряжение. Наибольшая π-электронная плотность в этой сопряженной системе располагается над и под плоскостью σ-скелета.
В результате все связи между атомами углерода в бензоле выравнены и имеют длину 0,139 нм. Эта величина является промежуточной между длиной одинарной связи в алканах (0,154 нм) и длиной двойной связи в алкенах (0,133 нм). Равноценность связей принято изображать кружком внутри цикла. Круговое сопряжение дает выигрыш в энергии 150 кДж/моль. Это значение составляет энергию сопряжения – количество энергии, которое нужно затратить, чтобы разрушить ароматическую систему бензола (сравните – энергия сопряжения в бутадиене равна всего 12 кДж/моль).
Такое
электронное строение объясняет все
особенности бензола. В частности,
понятно, почему бензол трудно вступает
в реакции  присоединения
– это приводит к нарушению сопряжения.
Такие реакции возможны только в очень
жестких условиях.
присоединения
– это приводит к нарушению сопряжения.
Такие реакции возможны только в очень
жестких условиях.
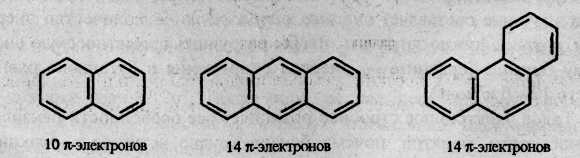
Совокупность свойств бензола принято называть проявлением ароматического характера, или ароматичности. В общем виде понятие ароматичности было сформулировано немецким физиком Э. Хюккелем в виде так называемого правила Хюккеля.
Согласно этому правилу, ароматические молекулы должны иметь плоский циклический σ-скелет и число обобщенных π-электронов, равное 4n + 2, где n= 1, 2, 3 и т.д. Только в этом случае молекула будет обладать ароматическим характером. Число обобщенных π-электронов может быть 6, 10, 14 и т.д. Примерами служат выделяемые из каменноугольной смолы полиядерные конденсированные ароматические углеводороды – нафталин, антрацен, фенантрен. В них бензольные кольца соединены друг с другом линейно (как в антрацене) или нелинейно (как в фенантрене):