
- •В.М. Васюков
- •Курс лекций
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •Основные понятия химии
- •Основные положения атомно-молекулярной теории
- •Газовые законы
- •Глава 2. Строение атома и периодический закон Модели строения атома
- •Квантовые числа электронов
- •Электронные конфигурации атомов
- •Ядро атома и радиоактивные превращения
- •Периодический закон
- •Глава 3. Химическая связь Валентность и степень окисления
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Межмолекулярные взаимодействия
- •Глава 4. Комплексные соединения
- •Глава 5. Состояние вещества
- •Глава 6. Физико-химические закономерности протекания химических реакций Химическая термодинамика
- •Химическая кинетика и катализ
- •Обратимые и необратимые реакции. Состояние химического равновесия
- •Глава 7. Физико-химическая теория растворов электролитов и неэлектролитов Механизм образования растворов и их классификация
- •Идеальные и реальные растворы. Растворение как физико-химический процесс
- •Зависимость растворимости различных веществ от природы растворителя, температуры и давления
- •Законы разбавленных растворов
- •Способы выражения концентрации (состава) растворов
- •Электролиты и электролитическая диссоциация
- •Гидролиз солей
- •Глава 8. Дисперсные системы
- •Классификации дисперсных систем
- •Оптические и молекулярно-кинетические свойства дисперсных систем
- •Поверхностные и адсорбционные явления
- •Коллоидные (коллоидно-дисперсные) системы
- •Глава 9. Теория окислительно-восстановительных процессов Окислительно-восстановительные реакции
- •Химические источники электрической энергии. Электродные потенциалы
- •1) Металлы, обладающие более электроотрицательным потенциалом, способны вытеснить менее активные металлы (с более положительным потенциалом) из водных растворов их солей;
- •Коррозия металлов
- •Электролиз
- •Восстанавливается вода Восстанавливается вода и катионы металла Восстанавливается катионы металла
- •Глава 10. Качественный и количественный анализ веществ
- •Качественный анализ
- •Классификация катионов на аналитические группы
- •Классификация анионов на аналитические группы
- •Количественный анализ
- •Химические методы анализа
- •Физические и физико-химические методы анализа
- •Часть II. Неорганическая химия
- •Глава 11. Важнейшие классы неорганических соединений
- •Основания (гидроксиды металлов)
- •Кислоты
- •Глава 12. Элементы I группы
- •Водород
- •Глава 13. Элементы II группы
- •Бериллий
- •Глава 14. Элементы III группы
- •Алюминий
- •Лантаноиды
- •Актиноиды
- •Глава 15. Элементы IV группы
- •Углерод
- •Кремний
- •Глава 16. Элементы V группы
- •Глава 17. Элементы VI группы
- •Кислород
- •Глава 18. Элементы VII группы
- •Глава 19. Элементы VIII группы
- •Часть III. Органическая химия Глава 20. Общая характеристика органических соединений
- •Теория строения органических соединений
- •Атомы в молекулах соединены между собой в определенном порядке химическими связями согласно их валентности; углерод во всех органических соединениях четырехвалентен.
- •Свойства вещества определяются не только качественным составом, но и его строением, взаимным влиянием атомов, как связанных между собой химическими связями, так и непосредственно не связанных.
- •Строение молекул может быть установлено на основе изучения их химических свойств.
- •Формулы органических соединений
- •Классификация органических соединений
- •Номенклатура органических соединений
- •Изомерия органических соединений
- •Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- •Общая характеристика органических реакций
- •Промышленное производство органических соединений
- •Глава 21. Алканы Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 22. Циклоалканы Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Глава 23. Алкены (олефины) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 24. Алкадиены (диеновые углеводороды) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 25. Алкины (ацетилены) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 26. Ароматические углеводороды (арены) Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Правила ориентации (замещения) в бензольном кольце
- •Применение
- •Глава 27. Гидроксильные соединения (спирты)
- •Одноатомные спирты (алкоголи) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Многоатомные спирты
- •Получение
- •Химические свойства
- •Применение
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 28. Карбонильные соединения (оксосоединения) Номенклатура и изомерия
- •Метаналь этаналь
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 29. Карбоновые кислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 30. Сложные эфиры. Жиры Номенклатура и изомерия
- •Физические свойства
- •Химические свойства
- •Жиры и масла
- •Глава 31. Углеводы (сахара)
- •Моносахариды Номенклатура и изомерия
- •Физические и химические свойства глюкозы
- •Дисахариды
- •Полисахариды
- •Глава 32. Амины
- •Предельные алифатические амины Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Ароматические амины
- •Физические свойства
- •Химические свойства
- •Применение
- •Глава 33. Аминокислоты, пептиды и белки
- •Аминокислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Пептиды
- •Физические свойства
- •Химические свойства
- •Биологическое значение белков
- •Глава 34. Гетероциклические соединения
- •Шестичленные гетероциклы
- •Пятичленные гетероциклы
- •Нуклеиновые кислоты Строение нуклеиновых кислот
- •Биологическая роль нуклеиновых кислот
- •Глава 35.Синтетические высокомолекулярные соединения
- •Общая характеристика полимеров
- •Пластмассы
- •Волокна
- •Каучуки
- •Литература
- •Приложения Растворимость неорганических веществ в воде при 25°c
Получение
1. Гидратация алкинов. Из ацетилена получают альдегид, из его гомологов – кетоны:

Из-за своей относительной дороговизны, а также из-за того, что: получаемые соединения загрязнены токсичными соединениями ртути, в настоящее время этот способ находит ограниченное применение.
2. Общий способ получения карбонильных соединений – окисление спиртов. В качестве окислителя можно использовать не только дихромат или перманганат калия, но и другие соединения, например, оксид меди (II) при нагревании:
![]()
3. При щелочном гидролизе дигалогеналканов, содержащих два атома галогена при одном атоме углерода, образуются двухатомные спирты, в которых две группы ОН соединены с одним атомом углерода. Эти вещества неустойчивы и отщепляют воду, превращаясь в карбонильные соединения:
![]()
4. Дегидрирование спиртов. Одним из промышленных способов получения альдегидов и кетонов является дегидрирование спиртов в газовой фазе над металлическими медью, серебром, хромом, никелем, оксидом цинка и др., например:

5. Окисление алкенов. Альдегиды и кетоны получают окислением углеводородов ряда этилена кислородом воздуха в присутствии хлоридов палладия (II) и меди. (II), например:

Этим экономичным способом в промышленности получают низшие альдегиды и кетоны.
6. Простейший кетон – ацетон – получают кумольным методом вместе с фенолом.
Химические свойства
Химические свойства альдегидов и кетонов определяются тем, что в состав их молекул входит карбонильная группа с полярной двойной связью.
Альдегиды и кетоны – химически активные соединения, которые склонны к реакциям присоединения по связи С=О. Эти реакции протекают по механизму нуклеофильного присоединения, обозначается AN (от англ. addition nucleophilic). Активность альдегидов и кетонов в реакциях присоединения определяется величиной положительного заряда δ+ на атоме углерода в карбонильной группе. Электронодонорные группы, связанные с группой СО, уменьшают величину этого заряда. Карбонильная группа кетонов связана с двумя углеводородными радикалами (которые являются электронодонорными группами), поэтому кетоны менее активны, чем альдегиды (в которых группа СО связана только с одним радикалом). Самый активный из альдегидов – формальдегид Н2СО.
Важнейшие реакции присоединения:
1. Присоединение водорода (восстановление). При взаимодействии альдегидов с водородом получаются первичные спирты:
![]()
Кетоны в аналогичной реакции дают вторичные спирты. В лабораторных условиях для восстановления карбонильных соединений используют алюмогидрид лития LiAlH4.
2.Присоединение циановодородной (синильной) кислоты:
![]()
Образовавшееся соединение содержит на один атом углерода больше, чем исходный альдегид или кетон, поэтому подобные реакции используют для удлинения углеродной цепи.
3. Взаимодействие со спиртами. Альдегиды могут взаимодействовать с одной или двумя молекулами спирта, образуя соответственно полуацетали и ацетали.
Полуацеталями называют соединения, содержащие при одном атоме углерода гидроксильную и алкоксильную (OR) группы. Ацетали – это соединения, содержащие при одном атоме углерода две алкоксильные группы:

Реакцию получения ацеталей широко используют в органических синтезах для «защиты» активной альдегидной группы от нежелательных реакций:

Особенно важное значение подобные реакции имеют в химии углеводов.
4. Присоединение гидросульфитов служит для выделения альдегидов из смесей с другими веществами и для получения их в чистом виде, поскольку полученное сульфопроизводное очень легко гидролизуется:
![]()
5. Присоединение реактива Гриньяра. В органическом синтезе часто используют реактив Гриньяра – одно из простейших металлоорганических соединений. При добавлении раствора галогеналкана в диэтиловом эфире к магниевой стружке легко происходит экзотермическая реакция, магний переходит в раствор и образуется реактив Гриньяра:
![]()
где R – алкильный или арильный радикал, X – галоген.
а) Взаимодействием реактива Гриньяра с формальдегидом можно получить практически любой первичный спирт (кроме метанола). Для этого продукт присоединения реактива Гриньяра гидролизуют водой:
б) При использовании любых других алифатических альдегидов могут быть получены вторичные спирты:

в) Взаимодействием реактивов Гриньяра с кетонами получают третичные спирты:
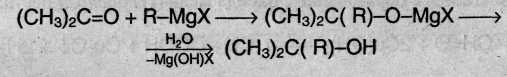
6. Присоединение воды. Альдегиды в водных растворах существуют в виде гидратных форм, образующихся в результате присоединения воды к карбонильной группе:

Реакция обратима, положение равновесия зависит от реакционной способности карбонильного соединения. Например, формальдегид гидратирован на 100%, менее активный ацетальдегид – только на 51%. Кетоны в водных растворах практически не гидратируются.
Реакции окисления. Альдегиды и кетоны по-разному относятся к действию окислителей. Альдегиды легко (значительно легче, чем спирты) окисляются в соответствующие карбоновые кислоты. Для их окисления можно использовать такие мягкие окислители, как оксид серебра и гидроксид меди (II).
Кетоны к действию окислителей инертны, в частности, они не окисляются кислородом воздуха. Кетоны реагируют только с очень сильными окислителями, способными разорвать связи С–С в их молекуле.
7. Реакция «серебряного зеркала» – это окисление альдегидов аммиачным раствором оксида серебра. В водном растворе аммиака оксид серебра образует комплексное соединение [Ag(NH3)2]OH, при действии которого на альдегид происходит окислительно-восстановительная реакция с образованием соли аммония:
![]()
Иногда эту реакцию записывают в упрощенном виде:
![]()
8. При окислении альдегидов гидроксидом меди (II) последний превращается в желтый гидроксид меди (I), который при нагревании разлагается с образованием оксида меди (I) красного цвета:
![]()
Данная реакция и реакция серебряного зеркала являются качественными реакциями на альдегиды.
9. Реакции поликонденсации. Для альдегидов характерны реакции поликонденсации – см. схему реакции фенола с формальдегидом.
