
- •В.М. Васюков
- •Курс лекций
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •Основные понятия химии
- •Основные положения атомно-молекулярной теории
- •Газовые законы
- •Глава 2. Строение атома и периодический закон Модели строения атома
- •Квантовые числа электронов
- •Электронные конфигурации атомов
- •Ядро атома и радиоактивные превращения
- •Периодический закон
- •Глава 3. Химическая связь Валентность и степень окисления
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Межмолекулярные взаимодействия
- •Глава 4. Комплексные соединения
- •Глава 5. Состояние вещества
- •Глава 6. Физико-химические закономерности протекания химических реакций Химическая термодинамика
- •Химическая кинетика и катализ
- •Обратимые и необратимые реакции. Состояние химического равновесия
- •Глава 7. Физико-химическая теория растворов электролитов и неэлектролитов Механизм образования растворов и их классификация
- •Идеальные и реальные растворы. Растворение как физико-химический процесс
- •Зависимость растворимости различных веществ от природы растворителя, температуры и давления
- •Законы разбавленных растворов
- •Способы выражения концентрации (состава) растворов
- •Электролиты и электролитическая диссоциация
- •Гидролиз солей
- •Глава 8. Дисперсные системы
- •Классификации дисперсных систем
- •Оптические и молекулярно-кинетические свойства дисперсных систем
- •Поверхностные и адсорбционные явления
- •Коллоидные (коллоидно-дисперсные) системы
- •Глава 9. Теория окислительно-восстановительных процессов Окислительно-восстановительные реакции
- •Химические источники электрической энергии. Электродные потенциалы
- •1) Металлы, обладающие более электроотрицательным потенциалом, способны вытеснить менее активные металлы (с более положительным потенциалом) из водных растворов их солей;
- •Коррозия металлов
- •Электролиз
- •Восстанавливается вода Восстанавливается вода и катионы металла Восстанавливается катионы металла
- •Глава 10. Качественный и количественный анализ веществ
- •Качественный анализ
- •Классификация катионов на аналитические группы
- •Классификация анионов на аналитические группы
- •Количественный анализ
- •Химические методы анализа
- •Физические и физико-химические методы анализа
- •Часть II. Неорганическая химия
- •Глава 11. Важнейшие классы неорганических соединений
- •Основания (гидроксиды металлов)
- •Кислоты
- •Глава 12. Элементы I группы
- •Водород
- •Глава 13. Элементы II группы
- •Бериллий
- •Глава 14. Элементы III группы
- •Алюминий
- •Лантаноиды
- •Актиноиды
- •Глава 15. Элементы IV группы
- •Углерод
- •Кремний
- •Глава 16. Элементы V группы
- •Глава 17. Элементы VI группы
- •Кислород
- •Глава 18. Элементы VII группы
- •Глава 19. Элементы VIII группы
- •Часть III. Органическая химия Глава 20. Общая характеристика органических соединений
- •Теория строения органических соединений
- •Атомы в молекулах соединены между собой в определенном порядке химическими связями согласно их валентности; углерод во всех органических соединениях четырехвалентен.
- •Свойства вещества определяются не только качественным составом, но и его строением, взаимным влиянием атомов, как связанных между собой химическими связями, так и непосредственно не связанных.
- •Строение молекул может быть установлено на основе изучения их химических свойств.
- •Формулы органических соединений
- •Классификация органических соединений
- •Номенклатура органических соединений
- •Изомерия органических соединений
- •Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- •Общая характеристика органических реакций
- •Промышленное производство органических соединений
- •Глава 21. Алканы Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 22. Циклоалканы Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Глава 23. Алкены (олефины) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 24. Алкадиены (диеновые углеводороды) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 25. Алкины (ацетилены) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 26. Ароматические углеводороды (арены) Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Правила ориентации (замещения) в бензольном кольце
- •Применение
- •Глава 27. Гидроксильные соединения (спирты)
- •Одноатомные спирты (алкоголи) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Многоатомные спирты
- •Получение
- •Химические свойства
- •Применение
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 28. Карбонильные соединения (оксосоединения) Номенклатура и изомерия
- •Метаналь этаналь
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 29. Карбоновые кислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 30. Сложные эфиры. Жиры Номенклатура и изомерия
- •Физические свойства
- •Химические свойства
- •Жиры и масла
- •Глава 31. Углеводы (сахара)
- •Моносахариды Номенклатура и изомерия
- •Физические и химические свойства глюкозы
- •Дисахариды
- •Полисахариды
- •Глава 32. Амины
- •Предельные алифатические амины Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Ароматические амины
- •Физические свойства
- •Химические свойства
- •Применение
- •Глава 33. Аминокислоты, пептиды и белки
- •Аминокислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Пептиды
- •Физические свойства
- •Химические свойства
- •Биологическое значение белков
- •Глава 34. Гетероциклические соединения
- •Шестичленные гетероциклы
- •Пятичленные гетероциклы
- •Нуклеиновые кислоты Строение нуклеиновых кислот
- •Биологическая роль нуклеиновых кислот
- •Глава 35.Синтетические высокомолекулярные соединения
- •Общая характеристика полимеров
- •Пластмассы
- •Волокна
- •Каучуки
- •Литература
- •Приложения Растворимость неорганических веществ в воде при 25°c
Дисахариды
Важнейшие дисахариды – сахароза, мальтоза и лактоза. Все они являются изомерами и имеют формулу С12Н22О11, однако их строение различно.
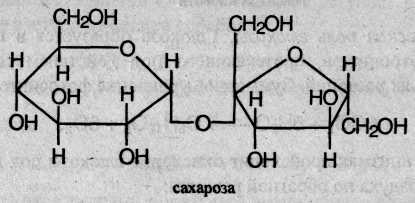
Молекула сахарозы состоит из двух циклов: шестичленного (остатка α-глюкозы в пиранозной форме) и пятичленного (остатка β-фруктозы в фуранозной форме), соединенных за счет гликозидного гидроксила глюкозы:
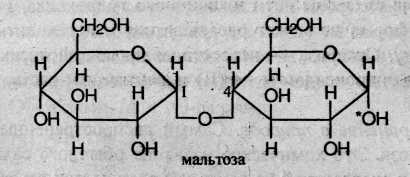
Молекула мальтозы состоит из двух остатков глюкозы (левый – α-глюкоза) в пиранозной форме, соединенных через 1-й и 4-й атомы углерода:
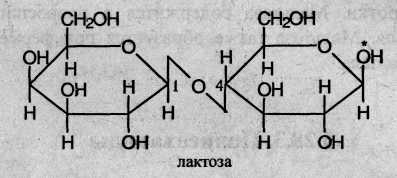
Лактоза состоит из остатков β-галактозы и глюкозы в пиранозной форме, соединенных через 1-й и 4-й атомы углерода:
Все эти вещества представляют собой бесцветные кристаллы сладкого вкуса, хорошо растворимые в воде.
Химические свойства дисахаридов определяются их строением. При гидролизе дисахаридов в кислой среде или под действием ферментов связь между двумя циклами разрывается и образуются соответствующие моносахариды, например:
![]()
По отношению к окислителям дисахариды делят на два типа: восстанавливающие и невосстанавливающие. К первым относятся мальтоза и лактоза, которые реагируют с аммиачным раствором оксида серебра по упрощенному уравнению:
![]()
Эти дисахариды могут также восстанавливать гидроксид меди (II) до оксида меди (I):
![]()
Восстановительные свойства мальтозы и лактозы обусловлены тем, что их циклические формы содержат гликозидный гидроксил (обозначен звездочкой) и, следовательно, эти дисахариды могут переходить из циклической формы в альдегидную, которая и реагирует с Аg2О и Сu(ОН)2.
В молекуле сахарозы нет гликозидного гидроксила, поэтому ее циклическая форма не может раскрываться и переходить в альдегидную форму. Сахароза – невосстанавливающий дисахарид; она не окисляется гидроксидом меди (II) и аммиачным раствором оксида серебра.
Распространение в природе. Самый распространенный дисахарид – сахароза. Это химическое название обычного сахара, который получают экстракцией из сахарной свеклы или сахарного тростника. Сахароза – главный источник углеводов в пище человека.
Лактоза содержится в молоке (от 2 до 8%) и получается из молочной сыворотки. Мальтоза содержится в проросших семенах хлебных злаков. Мальтоза также образуется при ферментативное гидролизе крахмала.
Полисахариды
Молекулы полисахаридов можно рассматривать как продукт поликонденсации моносахаридов. Общая формула полисахаридов (С6Н10О5)n. Мы рассмотрим важнейшие природные полисахаридов – крахмал и целлюлозу.
Крахмал образуется в растениях при фотосинтезе и откладывается в корнях и семенах. Он представляет собой белый порошок, нерастворимый в холодной воде и образующий коллоидный раствор в горячей воде.
Крахмал – это природный полимер, образованный остатками α-глюкозы. Он существует в двух формах: амилоза и амилопектин. Амилоза растворима в воде и представляет собой линейный полимер, в котором остатки α-глюкозы связаны друг с другом через первый и четвертый атомы углерода. Фрагмент амилозы выглядит следующим образом:

Линейная полимерная цепь в молекуле амилозы свернута в спираль. Внутри спирали находится канал размером 0,5 им, который может захватывать некоторые молекулы, например молекулу иода. Образующийся комплекс амилозы и иода имеет характерное синее окрашивание. Эта реакция служит для обнаружения иода.
В отличие от амилозы, амилопектин не растворим в воде и имеет разветвленное строение. В его молекуле остатки α-глюкозы связаны не только 1,4-связями, но и 1,6-связями:

Химические свойства. При нагревании в кислой среде крахмал гидролизуется с разрывом связей между остатками α -глюкозы. При этом образуется ряд промежуточных продуктов, в частности мальтоза. Конечным продуктом гидролиза является глюкоза:
(С6Н10О5)n + nН2О → nС6Н12О6
Эта реакция имеет важное промышленное значение, поскольку из глюкозы получают этанол, молочную кислоту и другие ценные продукты.
Крахмал – это ценный питательный продукт. Он входит в состав хлеба, картофеля, круп и наряду с сахарозой является важнейшим источником углеводов в человеческом организме.
Целлюлоза (клетчатка) – основное вещество растительных клеток. Древесина на 50% состоит из целлюлозы, а хлопок и лен – это практически чистая целлюлоза.
Целлюлоза представляет собой твердое волокнистое вещество, нерастворимое в воде, но растворимое в аммиачном растворе гидроксида меди (II) (реактиве Швейцера).
Целлюлоза – природный полимер. В отличие от крахмала, ее молекулы состоят только из линейных цепей, содержащих остатки β-глюкозы, которые связаны через первый и четвертый атомы углерода. Фрагмент линейной структуры целлюлозы выглядит следующим образом:
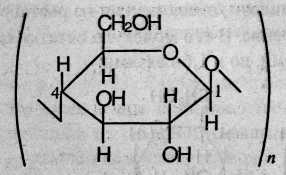
Химические свойства. Гидролиз целлюлозы происходит при нагревании в кислой среде. Конечным продуктом гидролиза является глюкоза.
Для целлюлозы характерны реакции образования сложных эфиров. Каждое структурное звено молекулы целлюлозы содержит по три группы ОН, которые могут реагировать с азотной и уксусной кислотой:
![]()
Тринитрат целлюлозы (пироксилин) – взрывчатое вещество, на его основе готовят бездымный порох. Из триацетата целлюлозы изготавливают лаки, кинопленку и ацетатное волокно.
