
- •В.М. Васюков
- •Курс лекций
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •Основные понятия химии
- •Основные положения атомно-молекулярной теории
- •Газовые законы
- •Глава 2. Строение атома и периодический закон Модели строения атома
- •Квантовые числа электронов
- •Электронные конфигурации атомов
- •Ядро атома и радиоактивные превращения
- •Периодический закон
- •Глава 3. Химическая связь Валентность и степень окисления
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Межмолекулярные взаимодействия
- •Глава 4. Комплексные соединения
- •Глава 5. Состояние вещества
- •Глава 6. Физико-химические закономерности протекания химических реакций Химическая термодинамика
- •Химическая кинетика и катализ
- •Обратимые и необратимые реакции. Состояние химического равновесия
- •Глава 7. Физико-химическая теория растворов электролитов и неэлектролитов Механизм образования растворов и их классификация
- •Идеальные и реальные растворы. Растворение как физико-химический процесс
- •Зависимость растворимости различных веществ от природы растворителя, температуры и давления
- •Законы разбавленных растворов
- •Способы выражения концентрации (состава) растворов
- •Электролиты и электролитическая диссоциация
- •Гидролиз солей
- •Глава 8. Дисперсные системы
- •Классификации дисперсных систем
- •Оптические и молекулярно-кинетические свойства дисперсных систем
- •Поверхностные и адсорбционные явления
- •Коллоидные (коллоидно-дисперсные) системы
- •Глава 9. Теория окислительно-восстановительных процессов Окислительно-восстановительные реакции
- •Химические источники электрической энергии. Электродные потенциалы
- •1) Металлы, обладающие более электроотрицательным потенциалом, способны вытеснить менее активные металлы (с более положительным потенциалом) из водных растворов их солей;
- •Коррозия металлов
- •Электролиз
- •Восстанавливается вода Восстанавливается вода и катионы металла Восстанавливается катионы металла
- •Глава 10. Качественный и количественный анализ веществ
- •Качественный анализ
- •Классификация катионов на аналитические группы
- •Классификация анионов на аналитические группы
- •Количественный анализ
- •Химические методы анализа
- •Физические и физико-химические методы анализа
- •Часть II. Неорганическая химия
- •Глава 11. Важнейшие классы неорганических соединений
- •Основания (гидроксиды металлов)
- •Кислоты
- •Глава 12. Элементы I группы
- •Водород
- •Глава 13. Элементы II группы
- •Бериллий
- •Глава 14. Элементы III группы
- •Алюминий
- •Лантаноиды
- •Актиноиды
- •Глава 15. Элементы IV группы
- •Углерод
- •Кремний
- •Глава 16. Элементы V группы
- •Глава 17. Элементы VI группы
- •Кислород
- •Глава 18. Элементы VII группы
- •Глава 19. Элементы VIII группы
- •Часть III. Органическая химия Глава 20. Общая характеристика органических соединений
- •Теория строения органических соединений
- •Атомы в молекулах соединены между собой в определенном порядке химическими связями согласно их валентности; углерод во всех органических соединениях четырехвалентен.
- •Свойства вещества определяются не только качественным составом, но и его строением, взаимным влиянием атомов, как связанных между собой химическими связями, так и непосредственно не связанных.
- •Строение молекул может быть установлено на основе изучения их химических свойств.
- •Формулы органических соединений
- •Классификация органических соединений
- •Номенклатура органических соединений
- •Изомерия органических соединений
- •Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- •Общая характеристика органических реакций
- •Промышленное производство органических соединений
- •Глава 21. Алканы Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 22. Циклоалканы Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Глава 23. Алкены (олефины) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 24. Алкадиены (диеновые углеводороды) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 25. Алкины (ацетилены) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 26. Ароматические углеводороды (арены) Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Правила ориентации (замещения) в бензольном кольце
- •Применение
- •Глава 27. Гидроксильные соединения (спирты)
- •Одноатомные спирты (алкоголи) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Многоатомные спирты
- •Получение
- •Химические свойства
- •Применение
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 28. Карбонильные соединения (оксосоединения) Номенклатура и изомерия
- •Метаналь этаналь
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 29. Карбоновые кислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 30. Сложные эфиры. Жиры Номенклатура и изомерия
- •Физические свойства
- •Химические свойства
- •Жиры и масла
- •Глава 31. Углеводы (сахара)
- •Моносахариды Номенклатура и изомерия
- •Физические и химические свойства глюкозы
- •Дисахариды
- •Полисахариды
- •Глава 32. Амины
- •Предельные алифатические амины Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Ароматические амины
- •Физические свойства
- •Химические свойства
- •Применение
- •Глава 33. Аминокислоты, пептиды и белки
- •Аминокислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Пептиды
- •Физические свойства
- •Химические свойства
- •Биологическое значение белков
- •Глава 34. Гетероциклические соединения
- •Шестичленные гетероциклы
- •Пятичленные гетероциклы
- •Нуклеиновые кислоты Строение нуклеиновых кислот
- •Биологическая роль нуклеиновых кислот
- •Глава 35.Синтетические высокомолекулярные соединения
- •Общая характеристика полимеров
- •Пластмассы
- •Волокна
- •Каучуки
- •Литература
- •Приложения Растворимость неорганических веществ в воде при 25°c
Правила ориентации (замещения) в бензольном кольце
Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов.
В молекулах, имеющих только σ-связи, взаимное влияние атомов осуществляется через индуктивный эффект. В молекулах, представляющих собой сопряженные системы, проявляется действие мезомерного эффекта.
Влияние заместителей, передающееся по сопряженной системе π-связей, называют мезомерным (М) эффектом.
В молекуле бензола π-электронное облако распределено равномерно по всем атомам углерода за счет сопряжения. Если же в бензольное кольцо ввести какой-нибудь заместитель, это равномерное распределение нарушается и происходит перераспределение электронной плотности в кольце. Место вступления второго заместителя в бензольное кольцо определяется природой уже имеющегося заместителя.
Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): электронодонорные и электроноакцепторные.
Электронодонорные заместители проявляют +М и/или +I-эффект и повышают электронную плотность в сопряженной системе. К ним относятся гидроксильная группа –ОН и аминогруппа –NH2. Неподеленная пара электронов в этих группах вступает в общее сопряжение с π-электронной системой бензольного кольца и увеличивает длину сопряженной системы. В результате электронная плотность сосредоточивается в орто- и пара-положениях.
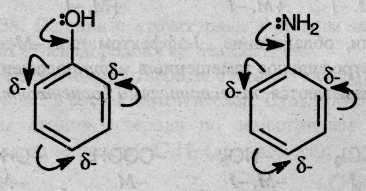
Алкильные группы не могут участвовать в общем сопряжении, но они проявляют +/–эффект, под действием которого происходит аналогичное перераспределение π-электронной плотности.
 Электроноакцепторные
заместители проявляют –М
эффект и/или –I-эффект и
снижают электронную плотность в
сопряженной системе. Нитрогруппа –NO2,
сульфогруппа –SO3H,
альдегидная –СНО и карбоксильная –СООН
группы проявляют –М-эффект. Эти
заместители образуют с бензольным
кольцом общую сопряженную систему, но
общее электронное облако смещается в
сторону этих групп. Таким образом, общая
электронная плотность в кольце
уменьшается, причем меньше всего она
уменьшается в мета-положениях:
Электроноакцепторные
заместители проявляют –М
эффект и/или –I-эффект и
снижают электронную плотность в
сопряженной системе. Нитрогруппа –NO2,
сульфогруппа –SO3H,
альдегидная –СНО и карбоксильная –СООН
группы проявляют –М-эффект. Эти
заместители образуют с бензольным
кольцом общую сопряженную систему, но
общее электронное облако смещается в
сторону этих групп. Таким образом, общая
электронная плотность в кольце
уменьшается, причем меньше всего она
уменьшается в мета-положениях:

Полностью галогенированные алкильные радикалы (например, –ССl3) проявляют –I-эффект и также способствуют понижению электронной плотности кольца.
Закономерности преимущественного направления замещения в бензольном кольце называют правилами ориентации.
Заместители, обладающие +I-эффектом или +М-эффектом, способствуют электрофильному замещению в орто- и пара-положения бензольного кольца и называются заместителями (ориентантами) первого рода:
![]()
Заместители, обладающие –I-эффектом или –М-эффектом, направляют электрофильное замещение в мета- положения бензольного кольца и называются заместителями (ориентантами) второго рода:
![]()
Например, толуол, содержащий заместитель первого рода, нитруется и бромируется в пара- и opтo-положения:
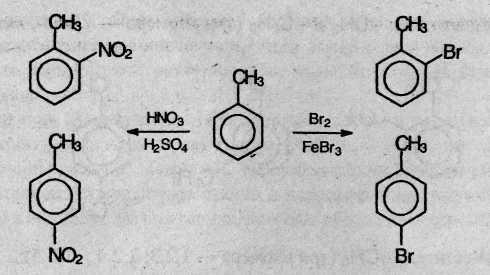
Нитробензол, содержащий заместитель второго рода, нитруется и бромируется в мета-положение:
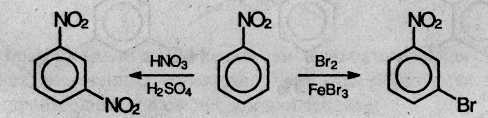
Помимо ориентирующего действия, заместители оказывают влияние и на реакционную способность бензольного кольца: ориентанты первого рода (кроме галогенов) облегчают вступление второго заместителя; ориентанты второго рода (и галогены) затрудняют его.
