- •В.М. Васюков
- •Курс лекций
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •Основные понятия химии
- •Основные положения атомно-молекулярной теории
- •Газовые законы
- •Глава 2. Строение атома и периодический закон Модели строения атома
- •Квантовые числа электронов
- •Электронные конфигурации атомов
- •Ядро атома и радиоактивные превращения
- •Периодический закон
- •Глава 3. Химическая связь Валентность и степень окисления
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Межмолекулярные взаимодействия
- •Глава 4. Комплексные соединения
- •Глава 5. Состояние вещества
- •Глава 6. Физико-химические закономерности протекания химических реакций Химическая термодинамика
- •Химическая кинетика и катализ
- •Обратимые и необратимые реакции. Состояние химического равновесия
- •Глава 7. Физико-химическая теория растворов электролитов и неэлектролитов Механизм образования растворов и их классификация
- •Идеальные и реальные растворы. Растворение как физико-химический процесс
- •Зависимость растворимости различных веществ от природы растворителя, температуры и давления
- •Законы разбавленных растворов
- •Способы выражения концентрации (состава) растворов
- •Электролиты и электролитическая диссоциация
- •Гидролиз солей
- •Глава 8. Дисперсные системы
- •Классификации дисперсных систем
- •Оптические и молекулярно-кинетические свойства дисперсных систем
- •Поверхностные и адсорбционные явления
- •Коллоидные (коллоидно-дисперсные) системы
- •Глава 9. Теория окислительно-восстановительных процессов Окислительно-восстановительные реакции
- •Химические источники электрической энергии. Электродные потенциалы
- •1) Металлы, обладающие более электроотрицательным потенциалом, способны вытеснить менее активные металлы (с более положительным потенциалом) из водных растворов их солей;
- •Коррозия металлов
- •Электролиз
- •Восстанавливается вода Восстанавливается вода и катионы металла Восстанавливается катионы металла
- •Глава 10. Качественный и количественный анализ веществ
- •Качественный анализ
- •Классификация катионов на аналитические группы
- •Классификация анионов на аналитические группы
- •Количественный анализ
- •Химические методы анализа
- •Физические и физико-химические методы анализа
- •Часть II. Неорганическая химия
- •Глава 11. Важнейшие классы неорганических соединений
- •Основания (гидроксиды металлов)
- •Кислоты
- •Глава 12. Элементы I группы
- •Водород
- •Глава 13. Элементы II группы
- •Бериллий
- •Глава 14. Элементы III группы
- •Алюминий
- •Лантаноиды
- •Актиноиды
- •Глава 15. Элементы IV группы
- •Углерод
- •Кремний
- •Глава 16. Элементы V группы
- •Глава 17. Элементы VI группы
- •Кислород
- •Глава 18. Элементы VII группы
- •Глава 19. Элементы VIII группы
- •Часть III. Органическая химия Глава 20. Общая характеристика органических соединений
- •Теория строения органических соединений
- •Атомы в молекулах соединены между собой в определенном порядке химическими связями согласно их валентности; углерод во всех органических соединениях четырехвалентен.
- •Свойства вещества определяются не только качественным составом, но и его строением, взаимным влиянием атомов, как связанных между собой химическими связями, так и непосредственно не связанных.
- •Строение молекул может быть установлено на основе изучения их химических свойств.
- •Формулы органических соединений
- •Классификация органических соединений
- •Номенклатура органических соединений
- •Изомерия органических соединений
- •Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- •Общая характеристика органических реакций
- •Промышленное производство органических соединений
- •Глава 21. Алканы Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 22. Циклоалканы Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Глава 23. Алкены (олефины) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 24. Алкадиены (диеновые углеводороды) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 25. Алкины (ацетилены) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 26. Ароматические углеводороды (арены) Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Правила ориентации (замещения) в бензольном кольце
- •Применение
- •Глава 27. Гидроксильные соединения (спирты)
- •Одноатомные спирты (алкоголи) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Многоатомные спирты
- •Получение
- •Химические свойства
- •Применение
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 28. Карбонильные соединения (оксосоединения) Номенклатура и изомерия
- •Метаналь этаналь
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 29. Карбоновые кислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 30. Сложные эфиры. Жиры Номенклатура и изомерия
- •Физические свойства
- •Химические свойства
- •Жиры и масла
- •Глава 31. Углеводы (сахара)
- •Моносахариды Номенклатура и изомерия
- •Физические и химические свойства глюкозы
- •Дисахариды
- •Полисахариды
- •Глава 32. Амины
- •Предельные алифатические амины Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Ароматические амины
- •Физические свойства
- •Химические свойства
- •Применение
- •Глава 33. Аминокислоты, пептиды и белки
- •Аминокислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Пептиды
- •Физические свойства
- •Химические свойства
- •Биологическое значение белков
- •Глава 34. Гетероциклические соединения
- •Шестичленные гетероциклы
- •Пятичленные гетероциклы
- •Нуклеиновые кислоты Строение нуклеиновых кислот
- •Биологическая роль нуклеиновых кислот
- •Глава 35.Синтетические высокомолекулярные соединения
- •Общая характеристика полимеров
- •Пластмассы
- •Волокна
- •Каучуки
- •Литература
- •Приложения Растворимость неорганических веществ в воде при 25°c
Физические свойства
Первые члены гомологического ряда бензола – бесцветные жидкости со специфическим запахом. Они легче воды и в ней не растворимы. Хорошо растворяются в органических растворителях и сами являются хорошими растворителями для многих органических веществ. Бензол имеет характерный, достаточно приятный запах, но при этом сильно токсичен.
Вдыхание паров бензола вызывает головокружение и головную боль. При высоких концентрациях бензола возможны случаи потери сознания. Его пары раздражают глаза и слизистую оболочку. Жидкий бензол проникает в организм через кожу, и это может привести к отравлению. Особенно опасно выпить бензол. Поэтому работа с бензолом (и его гомологами) требует особой осторожности.
Способы получения
1. Получение из алифатических углеводородов. Для получения бензола и его гомологов в промышленности используют ароматизацию предельных углеводородов, входящих в состав нефти. При пропускании алканов с неразветвленной цепью, имеющих не менее 6 атомов углерода в молекуле, над нагретой платиной или оксидом хрома происходит дегидрирование с одновременным замыканием цикла (дегидроциклизация):
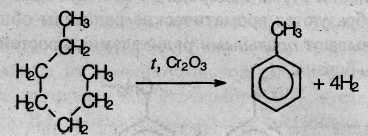
Из гексана при этом получается бензол, а из гептана – толуол.
2. Дегидрирование циклоалканов также приводит к ароматическим углеводородам. Реакция происходит при пропускании паров циклогексана и его гомологов над нагретой платиной:

3. Бензол можно получить при тримерпзации ацетилена. Реакция происходит при пропускании ацетилена над активированным углем при 600 °С:
![]()
4. Гомологи бензола получают из бензола при его взаимодействии с алкилгалогенидами в присутствии галогенидов алюминия (реакция алкилирования, или Фриделя-Крафтса):
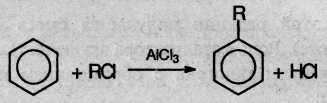
5. При сплавлении солей ароматических кислот со щелочью выделяются арены в газообразном виде:
![]()
Химические свойства
Ароматическое ядро, обладающее подвижной системой π-электронов, является удобным объектом для атаки электрофильными реагентами. Этому способствует также пространственное расположение π-электронного облака с двух сторон плоского σ-скелета молекулы.
Для аренов наиболее характерны реакции, протекающие по механизму электрофилъного замещения, обозначаемого символом SE (от англ. substitution electrophilic).
Механизм реакции SE можно представить следующим образом:
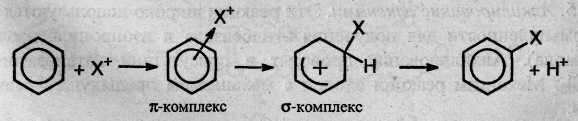
На первой стадии электрофильная частица X притягивается к π-электронному облаку и образует с ним π-комплекс. Затем два из шести π-электронов кольца образуют σ-связь между X и одним из атомов углерода. При этом ароматичность системы нарушается, т.к. в кольце остается только четыре π-электрона, распределенные между пятью атомами углерода (σ-комплекс). Для восстановления ароматичности σ-комплекс выбрасывает протон, а два электрона связи С-Н переходят в π-электронную систему.
 По
механизму электрофильного замещения
протекают следующие реакции
ароматических углеводородов:
По
механизму электрофильного замещения
протекают следующие реакции
ароматических углеводородов:
1. Галогенирование. Бензол и его гомологи взаимодействуют с хлором или бромом в присутствии катализаторов – безводных AlCl3, FeCl3,AlBr3 :
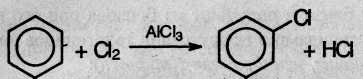
Из толуола по этой реакции получается смесь орто- и пара- изомеров (см. ниже). Роль катализатора заключается в поляризации нейтральной молекулы галогена с образованием из нее электрофильной частицы:
![]()
Нитрование. Бензол очень медленно реагирует с концентрированной азотной кислотой даже при сильном нагревании. Однако при действии нитрующей смеси (смеси концентрированных азотной и серной кислот) реакция нитрования проходит достаточно легко:
![]()
3. Сульфирование. Реакция легко проходит под действием «дымящей» серной кислоты (олеума):
![]()
4. Алкилирование по Фриделю-Крафтсу:
5. Алкилирование алкенами. Эти реакции широко используются в промышленности для получения этилбензола и изопропилбензола (кумола). Алкилирование проводят в присутствий катализатора АlСl3. Механизм реакции сходен с механизмом предыдущей реакции:
![]()
Все рассмотренные выше реакции протекают по механизму электрофильного замещения Se.
Наряду с реакциями замещения, ароматические углеводороды могут вступать в реакции присоединения, однако эти реакции приводят к разрушению ароматической системы и поэтому требуют больших затрат энергии и протекают только в жестких условиях:
6. Гидрирование бензола идет при нагревании и высоком давлении в присутствии металлических катализаторов (Ni, Pt, Pd). Бензол превращается в циклогексан:
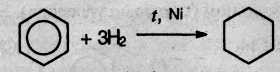
Гомологи бензола при гидрировании дают производные циклогексана:
![]()
7. Радикальное галогенирование бензола происходит при взаимодействии его паров с хлором только под воздействием жесткого ультрафиолетового излучения. При этом бензол присоединяет три молекулы хлора и образует твердый продукт – гексахлорциклогексан (гексахлоран) СбН6Сlб:
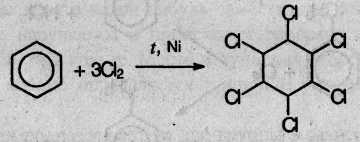
(атомы водорода в молекуле СбН6Сlб не указаны).
8. Окисление кислородом воздуха. По устойчивости к действию окислителей бензол напоминает алканы. Только при сильном нагревании (400 °С) паров бензола с кислородом воздуха в присутствии катализатора V2O5 получается смесь малеиновой кислоты и ее ангидрида:
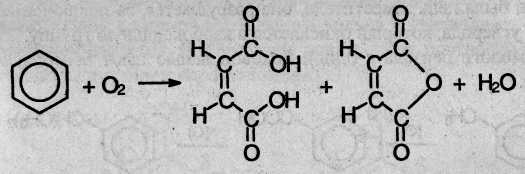
Гомологи бензола имеют ряд отличных от бензола химических свойств, связанных со взаимным влиянием алкильного радикала и бензольного кольца.
Реакции
в боковой цепи. По химическим свойствам
алкильные радикалы подобны алканам.
Атомы водорода в них замещаются на
галоген по радикальному механизму (SR).
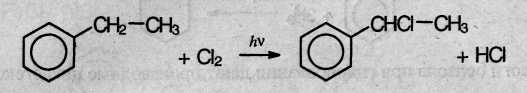
Поэтому в отсутствие катализатора
при нагревании или УФ облучении идет
радикальная реакция замещения в боковой цепи. Влияние
бензольного кольца на алкильные
заместители приводит к тому, что в первую
очередь замещается атом водорода у
атома углерода, непосредственно
связанного с бензольные кольцом (α-атома
углерода).
реакция замещения в боковой цепи. Влияние
бензольного кольца на алкильные
заместители приводит к тому, что в первую
очередь замещается атом водорода у
атома углерода, непосредственно
связанного с бензольные кольцом (α-атома
углерода).
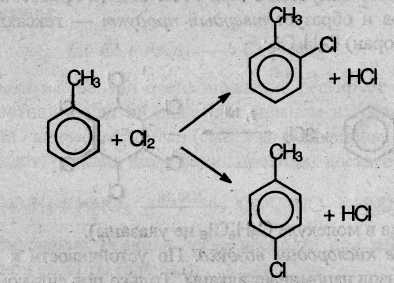
Замещение в бензольном кольце возможно только по механизму Se в присутствии катализатора (АlСl3 или FeCl3). Замещение в: кольце происходит в орто- и пара- положения по отношению к алкильному радикалу:
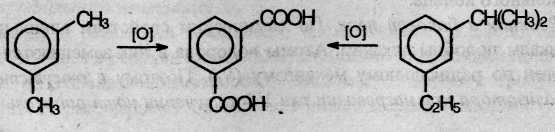
При действии перманганата калия и других сильных окислите лей на гомологи бензола боковые цепи окисляются. Какой бы сложной ни была цепь заместителя, она разрушается, за исключением он атома углерода, который окисляется в карбоксильную группу.
Гомологи бензола с одной боковой цепью дают бензойную кислоту:
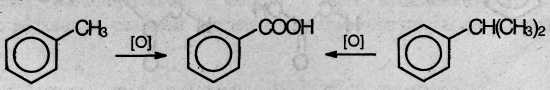
Гомологи, содержащие две боковые цепи, дают двухосновные кислоты: