
- •В.М. Васюков
- •Курс лекций
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •Основные понятия химии
- •Основные положения атомно-молекулярной теории
- •Газовые законы
- •Глава 2. Строение атома и периодический закон Модели строения атома
- •Квантовые числа электронов
- •Электронные конфигурации атомов
- •Ядро атома и радиоактивные превращения
- •Периодический закон
- •Глава 3. Химическая связь Валентность и степень окисления
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Межмолекулярные взаимодействия
- •Глава 4. Комплексные соединения
- •Глава 5. Состояние вещества
- •Глава 6. Физико-химические закономерности протекания химических реакций Химическая термодинамика
- •Химическая кинетика и катализ
- •Обратимые и необратимые реакции. Состояние химического равновесия
- •Глава 7. Физико-химическая теория растворов электролитов и неэлектролитов Механизм образования растворов и их классификация
- •Идеальные и реальные растворы. Растворение как физико-химический процесс
- •Зависимость растворимости различных веществ от природы растворителя, температуры и давления
- •Законы разбавленных растворов
- •Способы выражения концентрации (состава) растворов
- •Электролиты и электролитическая диссоциация
- •Гидролиз солей
- •Глава 8. Дисперсные системы
- •Классификации дисперсных систем
- •Оптические и молекулярно-кинетические свойства дисперсных систем
- •Поверхностные и адсорбционные явления
- •Коллоидные (коллоидно-дисперсные) системы
- •Глава 9. Теория окислительно-восстановительных процессов Окислительно-восстановительные реакции
- •Химические источники электрической энергии. Электродные потенциалы
- •1) Металлы, обладающие более электроотрицательным потенциалом, способны вытеснить менее активные металлы (с более положительным потенциалом) из водных растворов их солей;
- •Коррозия металлов
- •Электролиз
- •Восстанавливается вода Восстанавливается вода и катионы металла Восстанавливается катионы металла
- •Глава 10. Качественный и количественный анализ веществ
- •Качественный анализ
- •Классификация катионов на аналитические группы
- •Классификация анионов на аналитические группы
- •Количественный анализ
- •Химические методы анализа
- •Физические и физико-химические методы анализа
- •Часть II. Неорганическая химия
- •Глава 11. Важнейшие классы неорганических соединений
- •Основания (гидроксиды металлов)
- •Кислоты
- •Глава 12. Элементы I группы
- •Водород
- •Глава 13. Элементы II группы
- •Бериллий
- •Глава 14. Элементы III группы
- •Алюминий
- •Лантаноиды
- •Актиноиды
- •Глава 15. Элементы IV группы
- •Углерод
- •Кремний
- •Глава 16. Элементы V группы
- •Глава 17. Элементы VI группы
- •Кислород
- •Глава 18. Элементы VII группы
- •Глава 19. Элементы VIII группы
- •Часть III. Органическая химия Глава 20. Общая характеристика органических соединений
- •Теория строения органических соединений
- •Атомы в молекулах соединены между собой в определенном порядке химическими связями согласно их валентности; углерод во всех органических соединениях четырехвалентен.
- •Свойства вещества определяются не только качественным составом, но и его строением, взаимным влиянием атомов, как связанных между собой химическими связями, так и непосредственно не связанных.
- •Строение молекул может быть установлено на основе изучения их химических свойств.
- •Формулы органических соединений
- •Классификация органических соединений
- •Номенклатура органических соединений
- •Изомерия органических соединений
- •Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- •Общая характеристика органических реакций
- •Промышленное производство органических соединений
- •Глава 21. Алканы Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 22. Циклоалканы Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Глава 23. Алкены (олефины) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 24. Алкадиены (диеновые углеводороды) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 25. Алкины (ацетилены) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 26. Ароматические углеводороды (арены) Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Правила ориентации (замещения) в бензольном кольце
- •Применение
- •Глава 27. Гидроксильные соединения (спирты)
- •Одноатомные спирты (алкоголи) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Многоатомные спирты
- •Получение
- •Химические свойства
- •Применение
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 28. Карбонильные соединения (оксосоединения) Номенклатура и изомерия
- •Метаналь этаналь
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 29. Карбоновые кислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 30. Сложные эфиры. Жиры Номенклатура и изомерия
- •Физические свойства
- •Химические свойства
- •Жиры и масла
- •Глава 31. Углеводы (сахара)
- •Моносахариды Номенклатура и изомерия
- •Физические и химические свойства глюкозы
- •Дисахариды
- •Полисахариды
- •Глава 32. Амины
- •Предельные алифатические амины Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Ароматические амины
- •Физические свойства
- •Химические свойства
- •Применение
- •Глава 33. Аминокислоты, пептиды и белки
- •Аминокислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Пептиды
- •Физические свойства
- •Химические свойства
- •Биологическое значение белков
- •Глава 34. Гетероциклические соединения
- •Шестичленные гетероциклы
- •Пятичленные гетероциклы
- •Нуклеиновые кислоты Строение нуклеиновых кислот
- •Биологическая роль нуклеиновых кислот
- •Глава 35.Синтетические высокомолекулярные соединения
- •Общая характеристика полимеров
- •Пластмассы
- •Волокна
- •Каучуки
- •Литература
- •Приложения Растворимость неорганических веществ в воде при 25°c
Изомерия органических соединений
Изомерия – существование разных веществ с одинаковой молекулярной формулой. Данное явление обусловлено тем, что одни и те же атомы могут по-разному соединяться друг с другом. Все изомеры делят на два больших класса – структурные изомеры и пространственные изомеры (стереоизомеры).
Структурными называют изомеры, отвечающие различным структурным формулам органических соединений (с разным порядком соединения атомов).
Стереоизомерами называют соединения, имеющие одинаковый состав и одинаковый порядок соединения атомов, но отличающиеся расположением атомов в пространстве.
 Структурные
изомеры. В соответствии с приведенной
выше классификацией органических
соединений по типам среди структурных
изомеров выделяют три группы:
Структурные
изомеры. В соответствии с приведенной
выше классификацией органических
соединений по типам среди структурных
изомеров выделяют три группы:
1) соединения, содержащие различные функциональные группы и относящиеся к различным классам органических соединений, например:
![]()
2) соединения, отличающиеся углеродными скелетами:
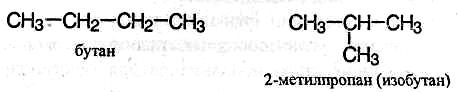
3) соединения, отличающиеся положением заместителя или кратной связи в молекуле:

Пространственные изомеры (стереоизомеры). Стереоизомеры можно разделить на два типа: геометрические изомеры и оптические изомеры.
Геометрическая изомерия характерна для соединений, содержащих двойную связь или цикл. В таких молекулах часто возможно провести условную плоскость таким образом, что заместители у различных атомов углерода могут оказаться по одну сторону (цис-) или по разные стороны (транс-) от этой плоскости. Если изменение ориентации этих заместителей относительно плоскости возможно только за счет разрыва одной из химических связей, то говорят о наличии геометрических изомеров.
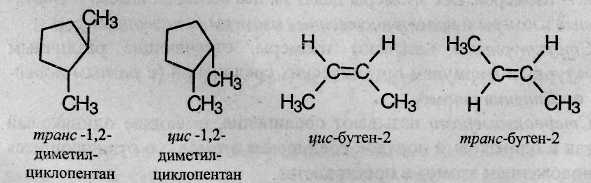
Геометрические изомеры могут существенно отличаться своими физическими и химическими свойствами.
Оптическими изомерами называют молекулы, зеркальные изображения которых не совместимы друг с другом. Их можно разделить на два типа: энантиомеры и диастереомеры.
Стереоизомеры, имеющие зеркальную конфигурацию асимметрических (хиральных) центров, называют энантиомерами или оптическими антиподами.
Энантиомерия характерна для молекул, имеющих один асимметрический (хиральный) атом углерода, т.е. атом, связанный с четырьмя различными атомами или группами атомов. Молекулы энантиомеров относятся друг к другу как предмет и несовместимое с ним зеркальное отображение. Энантиомеры имеют одинаковые физические и химические свойства, но отличаются знаком вращения поляризованного света.
В виде энантиомеров существует, например, молочная кислота СН3-СН(ОН)-СООН:
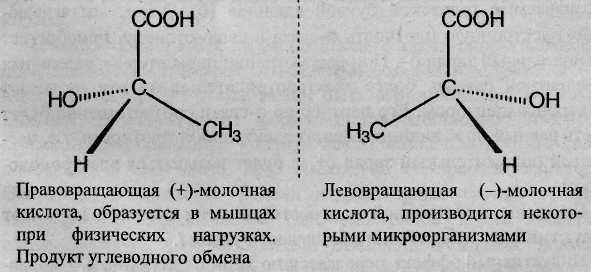
Эквимолярная смесь (+) и (–) энантиомеров оптически неактивна и называется рацемической смесью или рацематом.
Диастереомеры – пространственные изомеры, молекулы которых не являются зеркальными изображениями друг друга. Диастереомеры отличаются друг от друга физическими и химическими свойствами.
Взаимное влияние атомов в молекуле и реакционная способность органических соединений
Химические свойства атомов, входящих в молекулы, меняются в зависимости от того, с какими другими атомами они связаны. Наиболее сильно влияют друг на друга непосредственно связанные атомы, однако и атомы, непосредственно не связанные, оказывают влияние друг на друга. Объясняется это перераспределением электронной плотности в молекулах под действием атомов и атомных групп, образующих полярные связи.
Взаимное влияние, передающееся по цепи σ-связей, называется индуктивным эффектом (I) атома или группы, а передающееся по цепи π-связей - мезомерным эффектом или эффектом сопряжения (M).
Заместители проявляют отрицательный индуктивный эффект (-I), если они смещают к себе электронную плотность σ-связи от атома углерода сильнее, чем водород. Таким свойством обладают группы, содержащие полярные связи, и атомы более электроотрицательные, чем углерод:
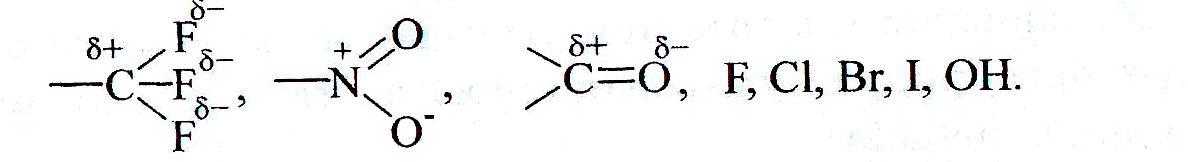
Заместители характеризуются положительным индуктивным эффектом (+I), если они отталкивают электронную плотность σ-связи к углероду. +I проявляют металлы I-III групп периодической системы и алкильные группы:
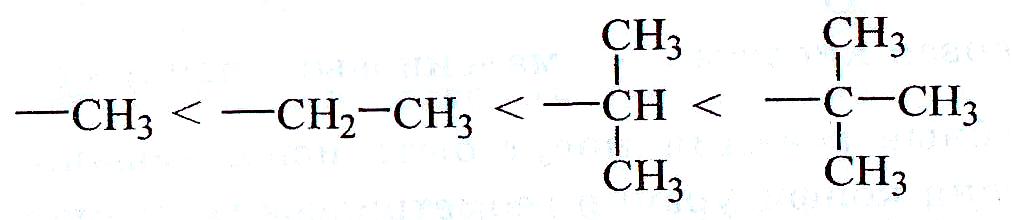
Индуктивный эффект быстро убывает с расстоянием, «затухает» по цепи, исчезая через 2-3 σ-связи. Наибольшее индуктивное влияние заместители оказывают на соседний (α) углеродный атом.
![]()
Мезомерный эффект – это перераспределение электронной плотности в сопряженных π,π- (и π,р)-системах. В соответствии с квантовохимической моделью сопряжением (или мезомерией) называют образование общей π-системы.
Положительный мезомерный эффект (+М) проявляют атомы азота, кислорода и галогенов, непосредственно связанные с ненасыщенными атомами углерода.
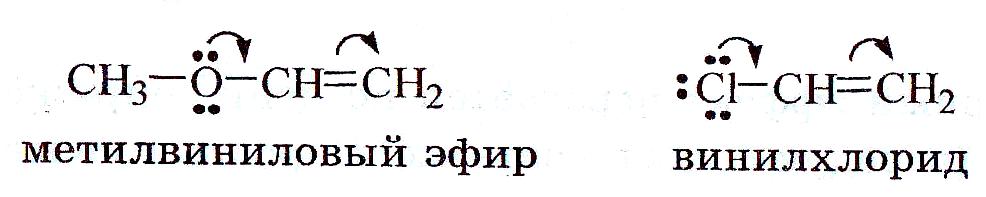
Сопряженные системы изображают: 1) изогнутой стрелкой; 2) с помощью предельных (резонансных) структур, между которыми ставят двустороннюю стрелку ↔ (символ мезомерии или резонанса); 3) мезомерной формулой, в которой делокализованную π-связь изображают пунктиром, а знаками δ+ и δ- - частичные заряды, возникающие на атомах.
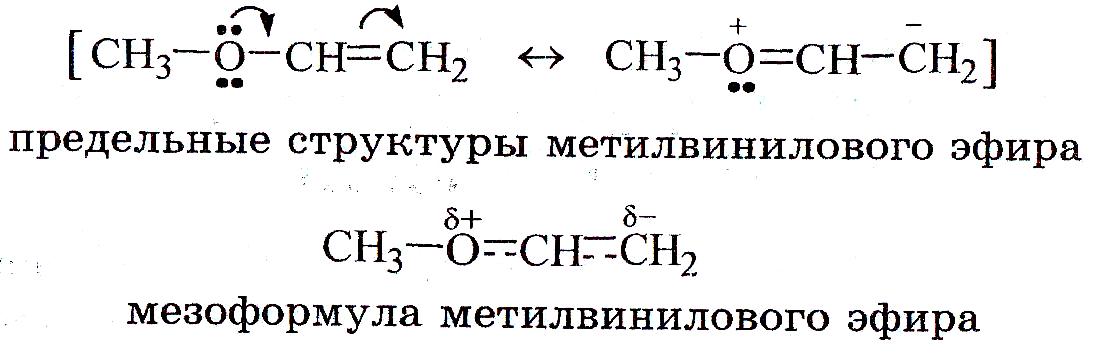
Отрицательный мезомерный эффект (-М) проявляют заместители, имеющие π-связи между атомами с различной электроотрицательностью:
![]()
Например, в непредельном альдегиде имеет место π,π-сопряжение и электронная плотность смещена к атому кислорода:
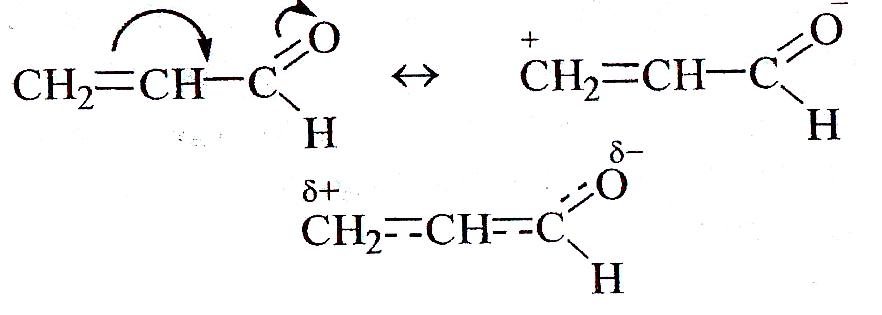
Мезомерный эффект передается по цепи сопряженных связей (чередующихся кратных и простых связей) без затухания.
