
- •В.М. Васюков
- •Курс лекций
- •Часть I. Теоретическая химия
- •Глава 1. Основные понятия и законы химии
- •Основные понятия химии
- •Основные положения атомно-молекулярной теории
- •Газовые законы
- •Глава 2. Строение атома и периодический закон Модели строения атома
- •Квантовые числа электронов
- •Электронные конфигурации атомов
- •Ядро атома и радиоактивные превращения
- •Периодический закон
- •Глава 3. Химическая связь Валентность и степень окисления
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Межмолекулярные взаимодействия
- •Глава 4. Комплексные соединения
- •Глава 5. Состояние вещества
- •Глава 6. Физико-химические закономерности протекания химических реакций Химическая термодинамика
- •Химическая кинетика и катализ
- •Обратимые и необратимые реакции. Состояние химического равновесия
- •Глава 7. Физико-химическая теория растворов электролитов и неэлектролитов Механизм образования растворов и их классификация
- •Идеальные и реальные растворы. Растворение как физико-химический процесс
- •Зависимость растворимости различных веществ от природы растворителя, температуры и давления
- •Законы разбавленных растворов
- •Способы выражения концентрации (состава) растворов
- •Электролиты и электролитическая диссоциация
- •Гидролиз солей
- •Глава 8. Дисперсные системы
- •Классификации дисперсных систем
- •Оптические и молекулярно-кинетические свойства дисперсных систем
- •Поверхностные и адсорбционные явления
- •Коллоидные (коллоидно-дисперсные) системы
- •Глава 9. Теория окислительно-восстановительных процессов Окислительно-восстановительные реакции
- •Химические источники электрической энергии. Электродные потенциалы
- •1) Металлы, обладающие более электроотрицательным потенциалом, способны вытеснить менее активные металлы (с более положительным потенциалом) из водных растворов их солей;
- •Коррозия металлов
- •Электролиз
- •Восстанавливается вода Восстанавливается вода и катионы металла Восстанавливается катионы металла
- •Глава 10. Качественный и количественный анализ веществ
- •Качественный анализ
- •Классификация катионов на аналитические группы
- •Классификация анионов на аналитические группы
- •Количественный анализ
- •Химические методы анализа
- •Физические и физико-химические методы анализа
- •Часть II. Неорганическая химия
- •Глава 11. Важнейшие классы неорганических соединений
- •Основания (гидроксиды металлов)
- •Кислоты
- •Глава 12. Элементы I группы
- •Водород
- •Глава 13. Элементы II группы
- •Бериллий
- •Глава 14. Элементы III группы
- •Алюминий
- •Лантаноиды
- •Актиноиды
- •Глава 15. Элементы IV группы
- •Углерод
- •Кремний
- •Глава 16. Элементы V группы
- •Глава 17. Элементы VI группы
- •Кислород
- •Глава 18. Элементы VII группы
- •Глава 19. Элементы VIII группы
- •Часть III. Органическая химия Глава 20. Общая характеристика органических соединений
- •Теория строения органических соединений
- •Атомы в молекулах соединены между собой в определенном порядке химическими связями согласно их валентности; углерод во всех органических соединениях четырехвалентен.
- •Свойства вещества определяются не только качественным составом, но и его строением, взаимным влиянием атомов, как связанных между собой химическими связями, так и непосредственно не связанных.
- •Строение молекул может быть установлено на основе изучения их химических свойств.
- •Формулы органических соединений
- •Классификация органических соединений
- •Номенклатура органических соединений
- •Изомерия органических соединений
- •Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- •Общая характеристика органических реакций
- •Промышленное производство органических соединений
- •Глава 21. Алканы Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 22. Циклоалканы Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Глава 23. Алкены (олефины) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 24. Алкадиены (диеновые углеводороды) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 25. Алкины (ацетилены) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 26. Ароматические углеводороды (арены) Номенклатура и изомерия
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Правила ориентации (замещения) в бензольном кольце
- •Применение
- •Глава 27. Гидроксильные соединения (спирты)
- •Одноатомные спирты (алкоголи) Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Многоатомные спирты
- •Получение
- •Химические свойства
- •Применение
- •Физические свойства
- •Способы получения
- •Химические свойства
- •Применение
- •Глава 28. Карбонильные соединения (оксосоединения) Номенклатура и изомерия
- •Метаналь этаналь
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 29. Карбоновые кислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Глава 30. Сложные эфиры. Жиры Номенклатура и изомерия
- •Физические свойства
- •Химические свойства
- •Жиры и масла
- •Глава 31. Углеводы (сахара)
- •Моносахариды Номенклатура и изомерия
- •Физические и химические свойства глюкозы
- •Дисахариды
- •Полисахариды
- •Глава 32. Амины
- •Предельные алифатические амины Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Ароматические амины
- •Физические свойства
- •Химические свойства
- •Применение
- •Глава 33. Аминокислоты, пептиды и белки
- •Аминокислоты Номенклатура и изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Пептиды
- •Физические свойства
- •Химические свойства
- •Биологическое значение белков
- •Глава 34. Гетероциклические соединения
- •Шестичленные гетероциклы
- •Пятичленные гетероциклы
- •Нуклеиновые кислоты Строение нуклеиновых кислот
- •Биологическая роль нуклеиновых кислот
- •Глава 35.Синтетические высокомолекулярные соединения
- •Общая характеристика полимеров
- •Пластмассы
- •Волокна
- •Каучуки
- •Литература
- •Приложения Растворимость неорганических веществ в воде при 25°c
1) Металлы, обладающие более электроотрицательным потенциалом, способны вытеснить менее активные металлы (с более положительным потенциалом) из водных растворов их солей;
2) металлы, выступающие в качестве отрицательного электрода по отношению к водородному (в ряду левее Н), вытесняют водород из кислот, а металлы с более положительным электродным потенциалом (в ряду правее Н) не обладают этим свойством.
Пример простейшего электрохимического элемента – гальванический элемент Даниэля-Якоби, состоит из медного и цинкового электродов в растворах их солей (рис.).
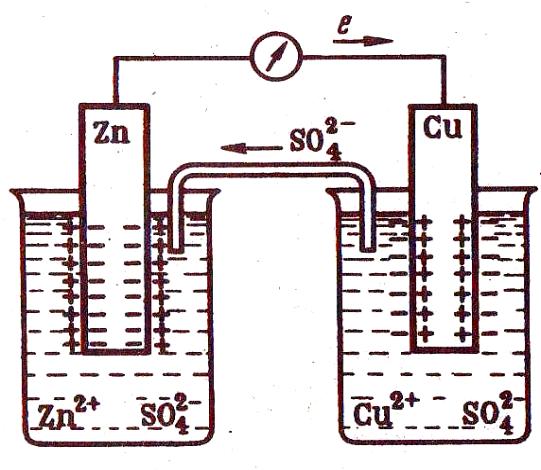
При работе элемента, т.е. при замкнутой внешней цепи, наблюдается направленное перемещение электронов от анода к катоду, а в растворе (по внутренней цепи) осуществляется движение анионов от катода к аноду.
Так, цинк окисляется – на поверхности его соприкосновения с растровом атомы цинка превращаются в ионы и, гидратируясь, переходят в раствор; высвобожденные при этом электроны движутся по внешней цепи к медному электроду:
анодный процесс: Zn0 = Zn2+ + 2ē, Е° (Zn0/Zn2+)= +0,76 В
На медном электроде протекает восстановление ионов меди – электроны, приходящие от цинкового электрода, соединяются с выходящими из раствора дегидратирующимися ионами меди и образуются атомы меды, выделяющиеся в виде металла:
катодный процесс: Cu2+ + 2ē = Cu0, Е° (Cu2+/Cu0) = +0,34 В
Во внутренней цепи ионы SO42–, оказавшиеся в избытке в катодном пространстве в результате восстановления ионов Cu2+, переходят в анодное пространство, где уравновешивают образовавшиеся при окислении анода ионы цинка Zn2+.
Суммируя полуреакции получим:
![]()
Э.д.с. (электродвижущая сила) элемента равна сумме +0,76 + 0,34 = 1,10 В. Положительный знак э.д.с. определяет направление самопроизвольного протекания реакции слева направо.
Максимальное напряжение электрохимического элемента, соответствующее обратимому протеканию реакции, называется электродвижущей силой (э.д.с.) этого элемента.
Э.д.с. электрохимического элемента возникает за счет протекания окислительно-восстановительной реакции. Движущей силой химической реакции является убыль свободной энергии Гиббса (∆G). С другой стороны, ее убыль определяет максимальную работу химической реакции. Для реакции, осуществляемой в гальваническом элементе, работа (А), производимая системой, равна A = IUt = QU, где I – сила тока в цепи, U – падение напряжения, t – время, Q – количество электричества.
Для одного моль вещества, вступившего в реакцию, Q = Amax = nFE, где n – число электронов, принимаемых или отдаваемых веществом (заряд иона), F = 96485 Кл/моль – постоянная Фарадея, т.е. количество электричества, необходимое для выделения одного эквивалента вещества. Тогда максимальная работа химической реакции равна убыли энергии Гиббса: –∆G = Amax = n∙F∙E
При стандартных условиях: –∆G = n∙F∙E°,
где E° – э.д.с. гальванического элемента при стандартных условиях.
Взаимосвязь между э.д.с. гальванического элемента и изменением свободной энергии Гиббса дает возможность непосредственного определения величины ∆G.
Э.д.с. гальванических элементов в процессе работы уменьшается вследствие электродной поляризации. Поляризация – изменение потенциала электрода при прохождении электрического тока по сравнению с состоянием равновесия.
Электродный потенциал металла, как отмечалось выше, зависит не только от его природы, но и от концентрации ионов данного металла в растворе и температуры. Эта зависимость выражается уравнением Нернста:
![]()
Из данного уравнения следует, что при с = с0 (= 1 моль/л) электродный потенциал Е = Е°. При росте концентрации по сравнению со стандартной (с > с0) электродный потенциал увеличивается (становиться более положительным). Так же действует и увеличение температуры. Соответственно при с < с0 электродный потенциал становиться меньше стандартного значения.
