
- •Билет №1
- •Вопрос 1: Показатель политропы в изотермическом, изобарном, изохорном, адиабатном и политропных процессах.
- •Показатель политропы:
- •Вопрос 2: Законы гидрогазодинамики. Физические свойства жидкостей (газов).
- •Билет №2
- •Вопрос 1: Дифференциальное уравнение равновесия Эйлера (вывод). Основное уравнение гидростатики. Дифференциальные уравнения равновесия Эйлера
- •После преобразования находим:
- •Таким образом, условия равновесия элементарного параллелепипеда выражаются системой уравнений:
- •Основное уравнение гидростатики
- •Вопрос 2: Уравнения теплоемкостей в изотермическом, изобарном, изохорном, адиабатном и политропных процессах.
- •43.Уравнения изменений энтальпии в изотермическом, изобарном, изохорном, адиабатном и политропных процессах.
- •3.Основные характеристики движения жидкости. Гидравлический радиус и эквивалентный диаметр.
- •4.Дифференциальное уравнение для установившегося и неустановившегося потока.
- •42.Уравнения изменений внутренней энергии в изотермическом, изобарном, изохорном, адиабатном и политропных процессах.
- •5.Режимы движения жидкостей и расход жидкости при ламинарном движении потока.
- •41.Уравнения количества теплоты, сообщаемое в адиабатном и политропном процессах.
- •6.Дифференциальное уравнение неразрывности потока. Практическое приложение.
- •Вопрос 2
- •Работа при адиабатическом процессе
- •Расчёт теплоты и работы политропных процессов сжатия газов
- •Вопрос 7
- •7. Дифференциальное уравнение движения идеальной жидкости (уравнение эйлера).
- •Вопрос 2
- •9.Вывод уравнения Бернулли. Практическое применение.
- •9.Вывод уравнения Бернулли. Практическое применение.
- •Вопрос 2
- •10.Теория подобия – метод научного обобщения экспериментов.
- •Вопрос 2
- •11. Условия и теория подобия.
- •Вопрос 2
- •36.Простейшие термодинамические процессы идеальных газов.
- •4Адиабатный процесс
- •5. Политропный процесс
- •Вопрос 13
- •12. Первая теорема подобия. Преобразование дифференциального уравнения в критериальное. Подобие начальных и граничных условий
- •Вопрос 2
- •35.Параметр состояния термодинамической системы – энтропия. Вывод.
- •13. Вторая теорема подобия. Пример использования.
- •Вопрос 2
- •34. Второй закон термодинамики. Основные постулаты, вытекающие изз второго закона термодинамики.
- •14. Третья теорема подобия. Раскрыть ее сущность.
- •Вопрос 2
- •33.Уравнение Майера.
- •Вопрос 16
- •15. Преобразование дифференциального уравнения Навье-Стокса в критериальное. Гидравлическое подобие
- •Для установившегося потока
- •Вопрос 2
- •32.Первый закон термодинамики. Раскрыть сущность.
- •16. Модифицированные и производные критерии подобия
- •Вопрос 2
- •30.Работа и теплота
- •28. Внутренняя энергия системы. Внутренняя энергия идеального газа.
- •29. Энтальпия идеального газа.
- •19. Гидравлическое сопротивление при движении жидкостей (газов) в трубах и каналах.
- •26. Смеси идеальных газов. Массовая и молярная концентрация. Парциальное давление. Закон Дальтона.
- •21. Сопротивление при свободном движении тел в газах и жидкостях
- •22. Осаждение частиц под действием сил тяжести и инерции. Примеры применения.
- •Основные понятия о науке газодинамике
Основные понятия о науке газодинамике
Молекулярной физикой называется наука, изучающая физические свойства и аграгатные состояния тел в зависимости от их молекулярного строения, их взаимодействия и характера теплового движения этих частиц. Термодинамический метод оперируется с макроскопической характеристикой основываясь на не нескольких экспериментальных законах (началах) термодинамики.
Одно из основных понятий – термодинамическая система. Представляет собой совокупность тел, находящихся во взаимодействии как между собой так и с ОС.
Термодинамическая система (ТС) называется гомогенной, если внутри нее нет поверхности раздела, отделяющих друг от друга микроскопические частицы системы, различающихся по своим свойствам и составам (ниче не понятно из леккции.. из интернета: однородная система по составу и физическому строению, внутри которой нет поверхностей раздела (лед, вода, газы). Если ТС не удовлетворяет этим условиям, она называется гетерогенной.
Система называется физически однородной, если ее состав и физические свойства одинаковые для всех макросопических частиц системы, равных по объему (пример: газ)
Состояние термодинамической системы определяется совокупностью ее термодинамических параметров (параметров состояния : давление, температура, плотность, молекулярный объем).
В термодинамике различают внешние и внутренние параметры системы.
Пример внешнего параметра для газа: его объем, зависящий от положения стенок сосуда. Внутренние параметры: давление, температура.
Термодинамических процессов (ТП) называется всякое изменение состояния термодинамической системы.
Равновесным (квазистатическим) называется термодинамический процесс, при котором система проходит непрерывный ряд равновесных состояний.
….. или с циклом называется ТП, в результате совершения которого система возвращается в исходное состояние (масса систем не изменяется).
дополнительно из инета. Я думаю не будет лишним
Изобарный процесс – термодинамический процесс, происходящий в системе при постоянном давлении и постоянной массе идеального газа.
Изотермический процесс – термодинамический процесс, происходящий в физической системе при постоянной температуре.
Изохорный процесс – термодинамический процесс, который происходит при постоянном объеме.
Адиабатический (адиабатный) процесс – термодинамический процесс в макроскопической системе, при котором система не обменивается тепловой энергией с окружающим пространством.
Политропный процесс – термодинамический процесс, во время которого удельная теплоемкость газа остается неизменной.
Релаксацией называется процесс возвращения системы в состояние термодинамического равновесия, которая была выведена из этого состояния.
Функция состояния системы полностью определяется значениями параметров начального и конечного состояния.
Основные законы идеальных газов.
Идеальным газом называется газ, в котором отсутствуют силы межмолекулярного взаимодействия.
Для идеальных газов справедливы следующие законы:
Закон Бойля-Мариотта
P
P

P
V=const;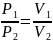



T2
T1<T2
V
T1
V
V

P
V1
V2
P1<P2
V1<V2

T
T
Закон Гей-Люссака
 ;
V/T=const
;
V/T=const
Д
P1
P2
ля данной массы газа отношение объема газа к его температуре постоянно, т.е. давление не меняется.
V

P1<P2
T
P
T1
T2
T1<T2
V
P
T
V1
V1
V1<V2
Изобары в координатах.
Закон Шарля
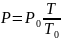 ;
;
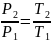
P0 при Т=273 К
Р

V
T3
T2
V
/Т=const

H2


1
O2
H
P
T1
P
25. Закон Авогадро
При одинаковых давлениях и одинаковых температурах в равных объемах различных идеальных газов содержится одинаковое число молекул или, что тоже самое, при одинаковых давлениях и одинаковых температурах грамм молекулы различных идеальных газов занимают одинаковые объемы.
t0=0°C; P0=101325 Па=760 мм рт.ст.
При t0=0°C грамм молекул занимает объем Vм=22,4 л.
Уравнение состояния идеального газа:
PVм=RT
Где P,Vм,T – давление, молярный объем, абсолютная температура
R – универсальная газовая постоянная. R=8.31 Дж/моль*°С. Численно равна работе, совершаемой 1 молекулой идеального газа при изобарном процессе при на нагревании на 1°С.
Для произвольной массы газа:

µ - молярная масса.
Уравнение состояния принимает вид:
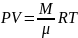 ;
;
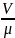 - удельная скорость
- удельная скорость
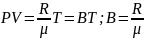 -
удельная газовая постоянная.
-
удельная газовая постоянная.
