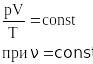- •Билет №1
- •Вопрос 1: Показатель политропы в изотермическом, изобарном, изохорном, адиабатном и политропных процессах.
- •Показатель политропы:
- •Вопрос 2: Законы гидрогазодинамики. Физические свойства жидкостей (газов).
- •Билет №2
- •Вопрос 1: Дифференциальное уравнение равновесия Эйлера (вывод). Основное уравнение гидростатики. Дифференциальные уравнения равновесия Эйлера
- •После преобразования находим:
- •Таким образом, условия равновесия элементарного параллелепипеда выражаются системой уравнений:
- •Основное уравнение гидростатики
- •Вопрос 2: Уравнения теплоемкостей в изотермическом, изобарном, изохорном, адиабатном и политропных процессах.
- •43.Уравнения изменений энтальпии в изотермическом, изобарном, изохорном, адиабатном и политропных процессах.
- •3.Основные характеристики движения жидкости. Гидравлический радиус и эквивалентный диаметр.
- •4.Дифференциальное уравнение для установившегося и неустановившегося потока.
- •42.Уравнения изменений внутренней энергии в изотермическом, изобарном, изохорном, адиабатном и политропных процессах.
- •5.Режимы движения жидкостей и расход жидкости при ламинарном движении потока.
- •41.Уравнения количества теплоты, сообщаемое в адиабатном и политропном процессах.
- •6.Дифференциальное уравнение неразрывности потока. Практическое приложение.
- •Вопрос 2
- •Работа при адиабатическом процессе
- •Расчёт теплоты и работы политропных процессов сжатия газов
- •Вопрос 7
- •7. Дифференциальное уравнение движения идеальной жидкости (уравнение эйлера).
- •Вопрос 2
- •9.Вывод уравнения Бернулли. Практическое применение.
- •9.Вывод уравнения Бернулли. Практическое применение.
- •Вопрос 2
- •10.Теория подобия – метод научного обобщения экспериментов.
- •Вопрос 2
- •11. Условия и теория подобия.
- •Вопрос 2
- •36.Простейшие термодинамические процессы идеальных газов.
- •4Адиабатный процесс
- •5. Политропный процесс
- •Вопрос 13
- •12. Первая теорема подобия. Преобразование дифференциального уравнения в критериальное. Подобие начальных и граничных условий
- •Вопрос 2
- •35.Параметр состояния термодинамической системы – энтропия. Вывод.
- •13. Вторая теорема подобия. Пример использования.
- •Вопрос 2
- •34. Второй закон термодинамики. Основные постулаты, вытекающие изз второго закона термодинамики.
- •14. Третья теорема подобия. Раскрыть ее сущность.
- •Вопрос 2
- •33.Уравнение Майера.
- •Вопрос 16
- •15. Преобразование дифференциального уравнения Навье-Стокса в критериальное. Гидравлическое подобие
- •Для установившегося потока
- •Вопрос 2
- •32.Первый закон термодинамики. Раскрыть сущность.
- •16. Модифицированные и производные критерии подобия
- •Вопрос 2
- •30.Работа и теплота
- •28. Внутренняя энергия системы. Внутренняя энергия идеального газа.
- •29. Энтальпия идеального газа.
- •19. Гидравлическое сопротивление при движении жидкостей (газов) в трубах и каналах.
- •26. Смеси идеальных газов. Массовая и молярная концентрация. Парциальное давление. Закон Дальтона.
- •21. Сопротивление при свободном движении тел в газах и жидкостях
- •22. Осаждение частиц под действием сил тяжести и инерции. Примеры применения.
- •Основные понятия о науке газодинамике
26. Смеси идеальных газов. Массовая и молярная концентрация. Парциальное давление. Закон Дальтона.
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Массовая концентрация (весовая концентрация, массовая(весовая) доля): Массовой концентрацией i-го газа, входящего в состав смеси, называется отношение его массы mi к массе m всей смеси: |
||
|
||
где N - общее число разнородных газов, образующих смесь. |
Мольная
(молярная) доля вещества
— концентрация,
выраженная отношением числа молей
вещества к общему числу молей всех
веществ, имеющихся в растворе.
![]() где
где
![]() —
мольная
доля вещества B в растворе
—
мольная
доля вещества B в растворе
![]() —
количество
вещества
B, содержащееся в растворе (измеряется
в молях)
—
количество
вещества
B, содержащееся в растворе (измеряется
в молях)
![]() —
сумма количества
вещества
всех компонентов раствора (измеряется
в молях)
—
сумма количества
вещества
всех компонентов раствора (измеряется
в молях)
Парциальное давление: |
||
Парциальное давление i-го газа в смеси называется давление, под которым находился бы этот газ, если бы из смеси были бы удалены все остальные газы, а объем и температура сохранились прежними: |
||
|
||
Закон Дальтона: |
||
Давление смеси идеальных газов равна сумме их парциальных давлений: |
||
|
27. Параметры состояния смеси идеальных газов.
В термодинамике идеального газа макроскопическими параметрами являются: p, V, T, m-параметры. Мы
знаем, что
|
|
Произведение
постоянных величин есть величина
постоянная, следовательно:
- универсальная газовая постоянная (универсальная, т.к. для всех газов одинаковая). |
|
Таким образом, имеем:
|
|
Другие формы записи уравнения состояния идеального газа. |
|
Если
=1
моль, то, обозначив объем одного моля
Vм,
получим:
Для нормальных условий получим:
|
|
2.
Запись уравнения через плотность:
|
|
3. Уравнение Клапейрона. Часто
необходимо исследовать ситуацию,
когда меняется состояние газа при
его неизменном количестве (m=const) и в
отсутствие химических реакций
(M=const). Это означает, что количество
вещества =const.
Тогда:
|
|
Эта
запись означает, что для
данной массы данного газа
справедливо равенство:
|
|
Для
постоянной массы идеального газа
отношение произведения давления
на объем к абсолютной температуре в
данном состоянии есть величина
постоянная:
|
|
20 билет


 .
.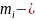 масса
i-го
компонента газа.
масса
i-го
компонента газа.
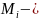 молярная
масса i-го
компонента газа .R-универсальная
газовая постоянная. T-температура
смеси. V-объем
смеси.
молярная
масса i-го
компонента газа .R-универсальная
газовая постоянная. T-температура
смеси. V-объем
смеси. или
p=p1+p2+…+pn
или
p=p1+p2+…+pn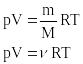 -
уравнение состояния (уравнение
Менделеева – Клапейрона).
-
уравнение состояния (уравнение
Менделеева – Клапейрона).