
- •1. Основные понятия технической термодинамики
- •2. Параметры состояния рабочего тела, единицы измерения.
- •3. Внутренняя энергия и энтальпия.
- •4. Работа изменения объема рабочего тела.
- •5. Первый закон термодинамики.
- •6. Уравнение состояния идеальных газов
- •7. Основные законы идеальных газов.
- •8. Смеси идеальных газов
- •9. Теплоёмкость идеальных газов
- •Теплоемкости с и ср
- •10. Основные процессы изменения состояния идеальных газов.
- •Адиабатный процесс
- •11. Термодинамическая обратимость процессов
- •12. Оценка эффективности циклов.
- •13. Основные формулировки второго закона термодинамики
- •14. Цикл Карно
- •15.Энтропия и ее изменение энтропии в необратимых процессах
- •16. Физический смысл энтропии.
- •17. Аналитическое выражение второго закона термодинамики
- •18.Водяной пар. Основные понятия
- •19. Парообразование в – диаграмме
- •20.Влажный пар и его параметры
- •22.Влажный воздух. Основные определения
- •24.Термодинамический анализ работы компрессора, многоступенчатое сжатие в компрессорах.
- •25.Термодинамический цикл двс, цикл Отто.
- •26.Термодинамический цикл двс, цикл Дизеля.
- •27.Цикл воздушно холодильной установки.
- •28.Цикл парокомпрессионной холодильной установки.
- •29.Цикл теплового насоса.
- •30.Основные способы передачи тепловой энергии.
- •31.Основные положения теплопроводности. Температурное поле и градиент.
- •32.Тепловой поток. Плотность. Закон Фурье.
- •33.Дифиринциальное уравнение теплопроводности.
- •34.Условее однозначности для процессов теплопроводности.
- •35.Стационарная теплопроводность однослойной и многослойной плоской стенки при граничных условиях 1-го рода.
- •36. Стационарная теплопроводность однослойной и многослойной плоской стенки при граничных условиях 3-его рода.
- •37.Стационарная теплопроводность однослойной и многослойной трубы 1-ого рода.
- •39.Пути интенсификации теплопередачи.
- •41.Дифферинциальные уравнения конвективного теплообмена: уравнения теплоотдачи, энергии, движения, неразрывности.
- •43.Условия подобия физических процессов.
- •44.Теплоотдача плоской поверхностью.
- •46.Теплоотдача при движении жидкости в трубах.
- •47.Теплоотдача при поперечном омывании.
- •48.Теплоотдача при свободном движении жидкости.
- •49.Общее представление о процессе кипения. Кризисы кипения.
- •50.Теплоотдача при плёночной и капельной конденсации.
- •51. Тепловое излучение. Основные понятия и определения
- •52. Основные законы теплового излучения.
- •53. Теплообмен излучения между параллельными пластинами и при наличии экрана
- •54.Теплообмен излучением между телами произвольно расположенными в пространстве. Угловые коэффициенты и их свойства
- •55. Классификация теплообменников
- •56. Основные положения теплоотсчёта рекуперативных аппаратов
16. Физический смысл энтропии.
Рисунок 5.20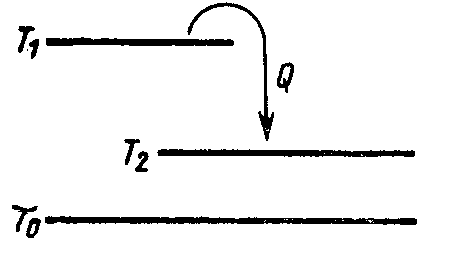
В результате
процесса изменения энтропии первого
тела составит
![]() (знак минус нужен потому, что от первого
тела отводится теплота, и, следовательно,
его энтропия уменьшается, а под Q
имеется ввиду абсолютная величина
передаваемого тепла). Равным образом
изменение энтропии второго тела составит
(знак минус нужен потому, что от первого
тела отводится теплота, и, следовательно,
его энтропия уменьшается, а под Q
имеется ввиду абсолютная величина
передаваемого тепла). Равным образом
изменение энтропии второго тела составит
![]() ,
т.е. энтропия второго тела увеличивается.
Следовательно, суммарное изменение
энтропии системы, состоящей из двух
рассматриваемых тел, будет равно
,
т.е. энтропия второго тела увеличивается.
Следовательно, суммарное изменение
энтропии системы, состоящей из двух
рассматриваемых тел, будет равно
![]() .
(1)
.
(1)
энтропия системы увеличилась.
Определим теперь изменение работоспособности рассматриваемой системы. Максимальное количество работы за счет теплоты Q может быть получено при осуществлении в заданном температурном интервале цикла Карно. При этом в интервале температур от Т1 до Т0 термический к.п.д. цикла составит
![]() ,
,
следовательно, максимальное количество работы, которое можно получить с помощью теплоты Q, будет равно
![]() .
.
По тем же соображениям максимальное количество работы, которое можно получить от теплоты Q после необратимого перехода его второму телу, составит
![]() .
.
В результате получается, что рассматриваемый необратимый процесс сопровождается уменьшением работоспособности системы на величину
![]()
или
![]() .
.
Сравнивая полученное выражение с формулой (1), получаем выражение
![]() ,
(2)
,
(2)
известное под названием уравнения Гуи – Стодолы.
Это уравнение вскрывает физический смысл энтропии. Оказывается, что необратимые процессы перехода теплоты с более высокого на более низкий температурный уровень сопровождаются потерей работоспособности, т.е. деградацией энергии той системы, в которой они происходят, а соответствующее возрастание энтропии пропорционально этой потере работоспособности.
Таким образом, энтропию можно рассматривать как параметр состояния замкнутой системы, увеличение которого является количественной мерой потери работоспособности системы, имеющей место при протекании в ней необратимых процессов.
17. Аналитическое выражение второго закона термодинамики
Если изолированная система находится в неравновесном состоянии, то в ней всегда происходят самопроизвольные необратимые процессы, приближающие ее к состоянию равновесия. Энтропия всей системы увеличивается, а энергия ее, не изменяясь количественно, деградирует качественно, т.е. работоспособность системы по мере протекания в ней необратимых процессов уменьшается.
В конечном итоге система приходит в состояние равновесия, самопроизвольные необратимые процессы в ней прекращаются, а энтропия перестает увеличиваться, т.е. достигает своего максимума. Это означает, что условия равновесия системы могут быть выражены аналитически условиями максимума ее энтропии, т.е. соотношениями
![]() .
.
В связи с этим второй закон термодинамики может быть сформулирован так: энтропия неизолированной равновесной системы стремится к максимуму, достигая его, когда самопроизвольные процессы в ней прекращаются и система приходит в состояние равновесия.
Аналитическое выражение второго закона:
![]() ,
,
Откуда:
![]() ,
,
а поскольку по первому закону термодинамики
![]() ,
,
любой термодинамический процесс должен удовлетворять соотношению
![]() ,
,
которое является, таким образом, объединенным аналитическим выражением первого и второго закона термодинамики. Знак равенства относится к обратимым процессам, а знак неравенства – к необратимым.
