- •Б 1. Классификация э/х методов анализа: принципы, лежащие в основе различных способов классификации.
- •Б 2. Потенциометрия. Потенциометрическое титрование, преимущества потенциометрической индикации ктт.
- •Б 3. Индикаторные электроды и их выбор для реакции нейтрализации, о-в, осаждения и комлексообразования.
- •Б 4. Методы определения кт потенциометрического титрования. Дифференциальное титрование. Метод Грана.
- •Б 7. Изменение буферности в ходе нейтрализации слабой кислоты сильным основанием, кривая титрования и ее расчет.
- •Б 10. Нейтрализация смесей кислот. Возможность и точность раздельного определения кислот в водной среде.
- •Б 13. Факторы, определяющие выбор растворителя для титрования индивидуальных слабых протолитов и дифференциального анализа смесей протолитов.
- •1. Твердые мембраны
- •3. Особые электроды.
- •Б 20. Газочувствительные и ферментные электроды.
- •(Потенциометрические биосенсоры) ферментные электроды.
- •21.Весовой электроанализ (электрогравиметрИя) при контролируемом потенциале. Внутренний электролиз.
- •Электрогравиметрический анализ
- •Б 23. Кулонометрическое титрование с внутренней генерацией титранта; методы индификации конечной точки титрования; преимущества метода.
- •Б 26. Уравнение Ильковича; диффузионный ток и его зависимость от концентрации деполяризатора.
- •Б 35. Амперометрическое титрование с двумя заполяризованными электродами.
- •Б 36. Емкостный ток и чувствительность постояннотоковой полярографии.
- •Б 37. Вольтамперометрия с быстрой разверткой (хроновольтамперометрия).
- •Прямая полярография с импульсами прямоугольной формы.
- •Б39.Дифференциальная импульсная полярография.
- •Б 41.Хронопотенциометрия.
- •Б 42. Инверсионная вольтамперометрия.
1. Твердые мембраны
Гомогенные мембраны: монокристаллическая, из сплава солей, спресованная из порошков солей, стеклянная.
Гетерогенные мембраны: электродноактивное вещество введено в инертную матрицу.
2. Жидкие мембраны. В таких электродах неводная фаза мебраны отделяется от водной диафрагмой.
Электроды, обладающие катионными функциями (Ca2+, Ba2+), содержат в несмешивающемся с водой органическом растворителе мембраноактивные частицы - крупные анионы (например, алкилфосфорной кислоты или тетра-n-хлорфенилборатный анион).
Электроды, обладающие анионными функциями (NO3-, Br-, Cl- ClO4- и др.), содержат в органическом растворителе мембраноактивные частицы - крупные катионы (например, катионы солей четвертичных аммониевых оснований, комплексных солей переходных металлов и др.).
Электроды с мембраной на основе нейтральных лигандов (антибиотики, циклические и ациклические макромолекулы). Примером этого типа электродов является K+ - электрод на основе валиномицина.
3. Особые электроды.
Газочувствительные электроды, в которых используется газопроницаемая мембрана или воздушный зазор, выполняющий роль мембраны, а также соответствующий индикаторный электрод.
Ферментные электроды, в которых ион-селективный электрод (например, стеклянный) имеет покрытие содержащее фермент. Этот фермент (например, уреаза) катализирует реакцию анализируемого органического соединения (мочевины), достигающего поверхности электрода. Ион-селективный электрод реагирует на продукт реакции (ион аммония) и по изменению его потенциала можно судить о концентрации исходного органического вещества.
Ионселективные полевые транзисторы.
Б 15. Мембранный потенциал и причины его возникновения. Потенциал Доннана: внутренний диффузионный потенциал мембраны, потенциал ассиметрии. Роль ионообмена в процессе установления мембранного потенциала, константа ионообмена. Уравнение Никольского.
Важное свойство электрохимических мембран заключается в том, что они обеспечивают возникновение скачка потенциала между двумя растворами, который называется мембранным потенциалом. Возникновение мембранного потенциала не связано с окислительно-восстановительными процессами на границе раздела фаз, а обусловлено только переносом ионов через эту границу.

Потенциал Доннана описывается выражением, аналогичным уравнению Нернста:
 ,
,
где aiмб и aiр-р - активности ионов в фазе мембраны и раствора; Сiмб и Сiр-р - концентрации ионов в фазе мембраны и раствора; γiмб и γiр-р - соответствующие коэффициенты активности ионов. Например, возникающий на границе р потенциал φр связан с активностями иона К+ в контактирующих фазах уравнением
 .
.
Из уравнения (1) следует, что доннановские потенциалы зависят от активности ионов в фазе мембраны и раствора, однако эти межфазные потенциалы нельзя измерить. Экспериментально можно зарегистрировать только так называемый мембранный потенциал, погрузив в разделяемые мембраной растворы два одинаковых электрода и измерив разность потенциалов между ними. Т.е. составляют элемент с мембраной, разделяющей растворы 1 и 2
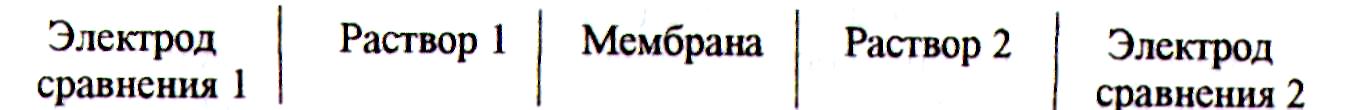
Емем = Е1 −Е2 + ЕD . (2)
Измеряют мембранные потенциалы с помощью электродов сравнения, которые помещают в растворы по обе стороны мембраны. Величины мембранных потенциалов зависят от природы мембраны, концентрации ионов, входящих в растворы 1 и 2, и от применяемых электродов сравнения. В аналитической практике электроды сравнения, стандартный раствор (один из растворов, разделяемых мембраной с постоянной концентрацией определяемого иона) и сама мембрана в серии измерений остаются одними и теми же, меняется только активность ионов в исследуемом растворе. Поэтому изменение измеряемого мембранного потенциала связано только с изменением доннановского потенциала на границе мембрана − исследуемый раствор, величина которого в свою очередь обусловлена активностью определяемых ионов.
Важно отметить, что возникновение мембранного потенциала не связано с окислительно-восстановительными процессами на границе раздела фаз, а обусловлено только переносом ионов через эту границу.
Возникновение потенциала асимметрии (применимо к стеклянному электроду) возможно при химических воздействиях на поверхность электрода (протравливание щелочами или плавиковой кислотой), механических повреждениях (стачивание, шлифование), адсорбции жиров, белков и других поверхностно-активных веществ. К наиболее важным причинам возникновения потенциала асимметрии относится изменение сорбционной способности стекла по отношению к воде при термической обработке в процессе изготовления электрода. Некоторый вклад вносит дегидратация набухшего поверхностного слоя (высушивание или выдерживание в дегидратирующем растворе). Возникновению потенциала асимметрии способствует неодинаковое напряжение на двух сторонах стеклянной мембраны. Если пустоты кремнийкислородной решетки на одной ее поверхности отличаются по форме от пустот на другой поверхности, то нарушается равновесие переноса ионов между стеклом и раствором и возникает потенциал асимметрии. В общем, любое воздействие, способное изменить состав или ионообменные свойства мембраны, влияет на потенциал асимметрии стеклянного электрода и может привести к ошибкам в измерениях рН. Мешающее действие потенциала асимметрии компенсируют при настройке рН-метров по стандартным буферным растворам, имеющим постоянную и точно известную концентрацию ионов водорода.
Ионоселективные электроды с твердыми мембранами.
Для нахождения функции отклика мембранного электрода, рассмотрим поведение твердой катионообменной мембраны, которая разделяет растворы, содержащие катионы А+ и В+ в разных концентрациях. В объеме мембраны имеется определенное число мест, способных связывать указанные ионы. Последние проникают в мембрану и занимают эти места, играя роль противоионов. Их заряд компенсируют фиксированные ионы мембраны. При этом равновесия ионного обмена между раствором и мембраной
A+р-р = А+мб, В+р-р = В+мб
можно описать соотношениями
![]() ,
(3)
,
(3)
![]() .
(4)
.
(4)
Отношение КА/КВ=Кобм
является константой обмена реакции![]()
В+р-р + А+мб = В+мб + А+р-р
Константа обмена ионов, которая определяет способность ионов В+ вытеснять из мембраны ионы А+
 .
(5)
.
(5)
При условии, что протекающий через мембрану электрический ток близок к пулю, а сумма активностей ионов А+ и В+ в мембране постоянна (а=аАмб+аВмб), можно записать:
 (6)
(6)
Преобразуя данное уравнение, получим

Записав выражение относительно aAр-р / aAмб, получим соотношение:
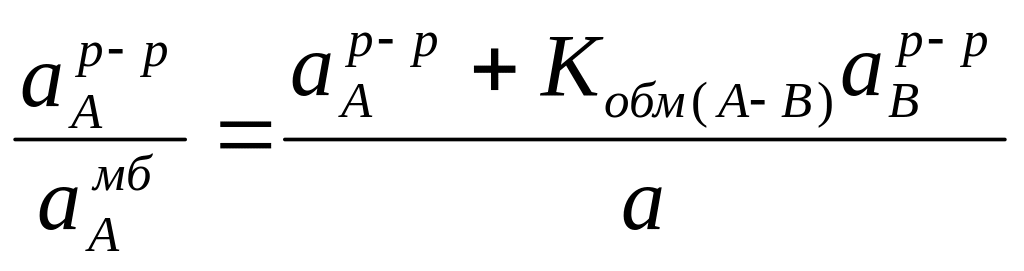 (7)
(7)
Тогда для потенциала мембранного электрода, учитывая (1), имеем выражение:
![]() (8)
(8)
где постоянная для данного электрода величина RT/F∙lna входит в значение потенциала Е°.
Однако оно не учитывает диффузионный потенциал, возникающий из-за различий в активностях потенциалопределяющих ионов в поверхностных слоях мембраны, прилегающих к внутреннему и внешнему раствору. Его величина зависит от чисел переноса t ионов в мембране; например, для иона А.
![]() (9)
(9)
где uA и uB – подвижности ионов А+ и В+ в мембране, аА и аB – соответствующие активности ионов в мембране.
Селективность электрода по отношению к иону А+ будет тем больше, чем селективней поглощается он мембраной и чем более подвижен внутри нее. В общем случае влияние мешающих ионов на потенциал мембранного электрода можно выразить с помощью уравнения Никольского:
![]() (13)
(13)
где знак «+» для катионов, а «–» – для анионов; nA и nB – заряды определяемых и мешающих ионов; aА и аB – соответствующие активности ионов в растворе; Ка/в - коэффициент селективности.
Б 16. Коэффициент селективности и методы его определения.
![]() (10)
(10)
Величина (иB/иА)Кобм(А-В) в этом выражении называется коэффициентом (константой) селективности (КA/B) электрода по отношению к ионам А+ и является основным параметром, характеризующим селективность мембранного электрода. Селективность электрода зависит также от соотношения активностей определяемых и мешающих ионов (аА/аB), Чем меньше КA/B, тем более селективен электрод по отношению к определяемому иону.
Коэффициент селективности можно определить экспериментально, измеряя потенциал электрода в растворах с постоянной активностью мешающего иона аВ и изменяющейся активностью определяемого иона аА (метод смешанных растворов). Значение КA/B рассчитывают из соотношения
![]() ,
(11)
,
(11)
где nA и nB – заряды ионов; ах - активность иона А+ в точке, в которой наблюдается заметное отклонение потенциала электрода от нернстовской функции.
По методу отдельных растворов измеряют потенциал электрода в растворе определяемого иона в отсутствие мешающего иона (Eа), а затем в растворе мешающего иона в отсутствие определяемого иона (EB), причем активности ионов в этих растворах должны быть одинаковыми. Если соответствующие значения потенциалов для обоих ионов описываются уравнением Нернста, то lg КA/B можно рассчитать из зависимости:
![]() .
(12)
.
(12)
Этот метод следует применять только тогда, когда нельзя или нецелесообразно использовать метод смешанных растворов.
Из выражения видно, что селективность электрода по отношению к иону А+ будет тем больше, чем селективней поглощается он мембраной и чем более подвижен внутри нее. В общем случае влияние мешающих ионов на потенциал мембранного электрода можно выразить с помощью уравнения Никольского:
(13)
где знак «+» для катионов, а «–» – для анионов; nA и nB – заряды определяемых и мешающих ионов; aА и аB – соответствующие активности ионов в растворе; Ка/в - коэффициент селективности.
Идеальный ионоселективный электрод должен обладать специфическим откликом на определяемый ион, причем влияние посторонних ионов должно быть пренебрежимо малым. Однако за исключением сульфидсеребряного электрода, селективного к сульфид-ионам и ионам серебра, ни один из известных в настоящее время ионоселективных электродов не обладает идеальной специфичностью. Подавляющее большинство ИСЭ имеют лишь относительную селективность, т.е. селективность к тому или иному иону относительно других ионов.
Встречаются также электроды с неидеальной электродной функцией, зависимость потенциала которых от lg КA/B линейная, но угловой коэффициент ниже нернстовского значения.
Б 17. Устройство ИСЭ. Электроды с кристаллическими мембранами (фторидлантановый электрод, электрод на основе сульфида серебра), гетерогенные мембраны.
Мембраны в ИСЭ чаще всего представляют собой моно- или поликристаллы трудно растворимых в воде солей. В этих мембранах обычно один из двух составляющих соль ионов способен под действием электрического поля перемещаться в кристаллической решетке по ее дефектам. Примерами могут служить мембраны из солей галогенидов серебра, которые обладают ионной проводимостью, осуществляемой ионами серебра. Поведение этих мембран, в простейших случаях, идентично поведению соответствующих электродов второго рода (хлорсеребряного и каломельного). Тонкая пластинка из монокристалла, например, хлорида серебра, может быть мембраной электрода, обратимой по отношению к иону Сl-, который закреплен в кристаллической решетке. В то же время такой электрод обладает и катионной Ag+ - функцией за счет постоянства произведения растворимости ПPAgCl.
Кристаллические мембраны отличаются очень высокой селективностью, превышающей селективность жидкостных электродов (с ионообменными веществами) на несколько порядков. Это связано с тем, что селективность у твердых кристаллических мембранных электродов достигается за счет вакансионного механизма переноса заряда, при котором вакансии заполняются только определенным подвижным ионом (Ag+), так как форма, размер, распределение заряда вакансии соответствуют только определенному подвижному иону.
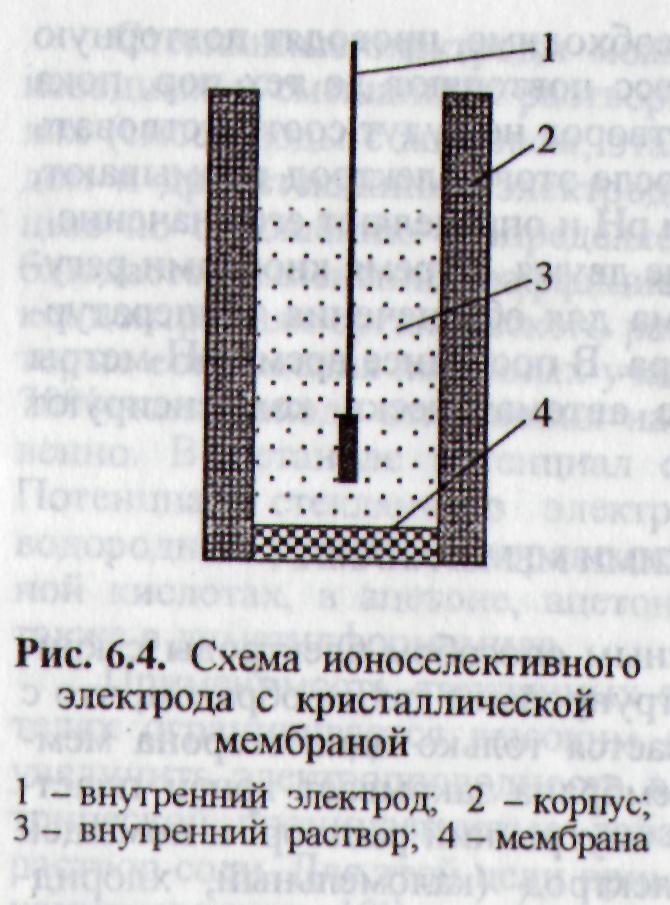
Конструкция электродов с кристаллическими мембранами показана на рис.2.Как правило, мембрана закрывает конец пластмассовой трубки, в которую залит внутренний раствор и помещен подходящий вспомогательный электрод (каломельный, хлорсеребряный). Внутренний раствор и внутренний электрод сравнения в ходе всех измерений остаются неизменными. Выражение для э.д.с. элемента, который составлен из интересующего нас раствора, погруженного в него ионоселективного электрода и внешнего электрода сравнения, включает слагаемое, зависящее от активности определяемого иона, и константу:
|
|
|
Рис.2. Схема ионселективного электрода с кристаллической мембраной 1 − внутренний электрод; 2 − корпус; 3 − внутренний раствор; 4 − мембрана |
|
|
![]() (14)
(14)
В нее входят скачки потенциала на границах раздела фаз, кроме границы мембрана/исследуемый раствор. Для каждого мембранного электрода величину константы определяют путем его градуировки по стандартным растворам.
К электродам с твердой мембраной относятся: лантанфторидный электрод, сульфидсеребряные электроды, галогенсеребряные электроды, электроды на основе сульфидов (халькогенидов) некоторых двухзарядных ионов металлов, стеклянные электроды.
Наиболее совершенным и высокоселективным электродом для определения F- ионов является монокристаллический лантанфторидный электрод. У этого электрода F- функция сохраняется до концентрации ионов F- ~ 10-5 – 10 -7 М, т.е. значительно меньшей, чем рассчитанная из литературных данных о растворимости фторида лантана. Это свойственно и другим электродам на основе моно- и поликристаллов. Электродный потенциал LaF3 электрода подчиняется уравнению Нернста в интервале концентраций 10°-10-6 М
![]() (15)
(15)
Селективность LаF3−электрода в присутствии многих других анионов может быть охарактеризована возможностью определения активности ионов F- при более чем 1000-кратных избытках галоген-ионов, NO3-, PO43-, НСО3- и других анионов. Существенно мешают определению aF- -только катионы, дающие комплексы с фторидами (Al3+, Fe3+, Ce4+, Li+, Th4+) и анионы ОН-. Мешающие катионы обычно маскируют добавлением цитрата натрия. При высоких значениях рН на поверхности электрода может образоваться слой La(OH)3, растворимость которого соизмерима с растворимостью LaF3. В результате освобождается дополнительное количество ионов фтора, что приводит к уменьшению электродного потенциала. Поэтому рН растворов поддерживают постоянным с помощью буферных растворов в диапазоне 5,0 - 5,5.
Потенциал в концентрированных растворах устанавливается менее чем за 0,5 с, а при низких концентрациях - до 3 мин. Стабильность потенциала F- электрода достаточна для длительной работы без периодических калибровок (изменение потенциала примерно ±2 мВ в неделю).
Фторидный электрод можно использовать и для прямого определения концентрации ионов лантана в растворах, не содержащих фторид-ионов. Если анализируемый раствор находится в равновесии с мембраной из LaF3, то концентрация ионов фтора вблизи поверхности электрода определяется произведением растворимости
ПPLaF3=аLaF3+aF-3
(16)
![]() . (17)
. (17)
Хотя прямое определение лантана с помощью фторидного электрода в аналитической практике используется довольно редко, тем не менее, тот факт, что кристаллический мембранный электрод можно применять для определения ионов, не способных перемещаться в решетке мембраны, имеет важное значение.
Сульфидсеребряные электроды - этот вид электродов является универсальным. Он получил широкое распространение. С одной стороны Ag2S является основой одного из первых гомогенных кристаллических электродов с высокой избирательностью по отношению к ионам Ag+ и S2-, с другой стороны - Ag2S оказался превосходной инертной матрицей для кристаллических галогенидов серебра и многих сульфидов двухзарядных металлов.
Сульфид серебра обладает ионной проводимостью; способность к миграции имеет только ион серебра. В качестве мембраны можно использовать монокристаллы Ag2S или спрессованный поликристаллический сульфид серебра. Чрезвычайно малая растворимость последнего и хорошая устойчивость по отношению к окислителям и восстановителям, а также простота приготовления поликристаллических мембран сделали сульфид серебра идеальным материалом для создания ионоселективных электродов. Сульфидсеребряный электрод применяют для определения как ионов серебра, так и сульфид-ионов, поскольку эти ионы связаны между собой произведением растворимости Ag2S. Так как мембрана обладает плотной и непористой поверхностью, то реакция электрода на изменение активности сульфидных ионов в растворе очень быстрая.
Сульфидсеребряный электрод в растворах AgNO3 обладает полной Ag+ функцией в интервале концентраций 10°-10-7 М Ag+. Нижний концентрационный предел обусловлен нестабильностью растворов при концентрации ниже 10-7 М Ag+. S2- функция экспериментально выполняется в интервале от 10-2 до 10-7 М в сильнощелочных сульфидных растворах. На потенциал рассматриваемого электрода влияют Hg2+ и CN- ионы. Влияние ионов CN- обусловлено реакцией:
6CN- + Ag2S => S2- + 2Ag(CN)32-.
В обычной конструкции ионоселективного электрода с твердой мембранной внутренняя поверхность мембраны контактирует со стандартным раствором электролита, в который погружен вспомогательный электрод, создающий обратимый переход от ионной проводимости в электролите к электронной проводимости в металлическом проводнике. В последнее время внутренний контакт создают с помощью твердых веществ (Ag, графит) - такие электроды называются твердофазными. Однако с точки зрения воспроизводимости и стабильности показаний они уступают электродам с внутренним электродом сравнения.
Галогенсеребряные и некоторые другие электроды на основе соединений серебра. Для определения концентрации галоген-ионов используют электроды на основе солей серебра. Электроды с твердыми гомогенными мембранами или монокристаллами, принципиально не отличаются от так называемых гетерогенных, мембраны которых содержат такие же труднорастворимые соли, внедренные в пластическую матрицу. Проводимость в AgX - мембранах осуществляется ионами Ag+ по дырочному механизму Френкеля. Мембранная фаза имеет постоянный состав, и диффузионный потенциал внутри мембраны равен нулю. Потенциал галоген серебряных электродов подчиняется уравнению Нернста. указанные недостатки галогенидов серебра устраняются при изготовлении мембран из сульфида серебра, в котором диспергированы тонко измельченные соответствующие галогениды. Поскольку последние имеют более высокую растворимость, чем сульфиды, то сульфид серебра можно рассматривать как химически инертную матрицу с включенными в нее частицами активного вещества.
Для изготовления подобных мембран можно использовать и другие соли серебра. Основное требование, предъявляемое к ним, сводится к тому, чтобы их растворимость была существенно выше растворимости сульфида серебра, но оставалась достаточно низкой, чтобы равновесная концентрация соли серебра не превышала активности аниона в исследуемом растворе.
Градуировочная кривая мембранных электродов, приготовленных из смеси сульфида серебра и тех или иных серебряных солей, идентична по форме кривым для электродов с мембранами из чистых солей серебра. Нижняя граница определяемых концентраций зависит от произведения растворимости соответствующих галогенидов серебра. Потенциалы электродов зависят также от присутствия тех анионов, которые дают с серебром менее растворимые соединения, чем определяемый ион. В этом случае на поверхности мембраны образуется осадок, что приводит к искажению результатов определений. Число мешающих ионов уменьшается в ряду: Сl-, Вr-, I-, S2-. Указанные электроды не могут применяться для анализа растворов, содержащих сильные восстановители, так как на поверхности мембраны образуется слой металлического серебра. Недопустимо и присутствие ртути.
Потенциометрическое определение с галогенсеребряным электродом осложняется присутствием в исследуемом растворе сульфида, тиосульфата и цианата или восстановителей.
Кроме галогенсеребряных электродов используют и ионоселективные CN- и SCN- - электроды. Определению цианид-ионов с помощью цианид-селективного электрода не мешают Cu2+, Fe3+, MnO4-, а также хлорид- и бромид-ионы. В анализируемом растворе не должны содержаться ртуть, сульфид-ионы и сильные восстановители. Для предотвращения снижения концентрации цианид-ионов из-за образования HCN, величина рН должна быть выше 10.
Для определения тиоцианат-ионов применяют тиоцианат-селективный электрод, мембрану которого изготавливают из смеси тиоцианата и сульфида серебра. Данный электрод чувствителен к тиоцианат-ионам в диапазоне концентраций 5∙10-6 - 1,0 моль/л в интервале рН от 2 до 10. Анализируемый раствор не должен содержать сильных восстановителей и анионов, образующих с серебром малорастворимые соли, а также Hg2+. Во всех указанных случаях электрод выходит из строя из-за отравления мембраны.
Электроды на основе сульфидов (халъкогенидов) некоторых двузарядных ионов металлов. Мембраны для этого вида электродов получают из смесей сульфида серебра и сульфида (халькогенида) соответствующего металла. Наибольшее значение для практики имеют: медный, свинцовый и кадмиевый электроды.
Поскольку такие мембраны содержат достаточное количество Ag2S, чтобы обеспечить движение ионов серебра в мембране, то они имеют серебряную функцию. Чувствительность электродов к указанным ионам основана на равновесных процессах
М2+ + S2- = MS и 2Ag+ + S2- = Ag2S,
![]() (21)
(21)
в растворах, содержащих ионы М2+ и не содержащих Ag , электрод становится чувствительным к ионам этих металлов. Чтобы сульфид металла был пригоден для изготовления мембраны, он должен удовлетворять определенным требованиям, чтобы его произведение растворимости на несколько порядков превышало ПР сульфида серебра. В то же время величина ПРмэ должна быть достаточно малой, чтобы равновесная концентрация М2+ в растворе была ниже ожидаемой концентрации исследуемого иона в пробе. Необходимо также, чтобы электрод имел приемлемое время установления потенциала.
Для электродов с мембраной из смеси сульфидов серебра и другого металла определению последнего мешают катионы, которые образуют с сульфид-ионами менее растворимые осадки, чем определяемые ионы. Концентрация ионов железа должна составлять десятую часть от концентрации ионов меди и не превышать концентрацию ионов свинца. Это условие легко выполнить, поддерживая рН в растворе выше 4,0. Определению кадмия мешают серебро, ртуть, медь, железо и свинец.
Электроды на основе сульфида серебра и сульфидов двухзарядных ионов металлов применимы в широком диапазоне концентраций определяемых ионов – от 10-1 до 10-7 моль/л. Верхняя граница этого диапазона находится в области насыщенных растворов, а нижний предел зависит от рН, что связано с увеличением растворимости сульфидов металлов в кислых растворах из-за образования HS и H2S. Чтобы избежать осаждения гидроксидов, необходимо строго контролировать рН.
 Наряду
с кристаллическими мембранами в ИСЭ
используются также гетерогенные
мембраны (мембраны Пунгора), в
которых твердый
материал с ионной проводимостью в виде
тонкодисперсного
порошка помещен в инертную матрицу.
Благодаря этому удается
получить мембраны из соединений, которые
не образуют кристаллы. В качестве
активных веществ в таких мембранах
применяют самые разнообразные материалы
(труднорастворимые соли металлов,
оксиды, карбиды, бориды, силициды,
хелатные соединения, ионообменные
смолы), а в качестве связующего материала
- парафин, коллодий, поливинилхлорид,
полистирол, полиэтилен, силиконовый
каучук и др.
Считается, что они менее чувствительны
к окисляющим и
восстанавливающим агентам, чем электроды
с кристаллическими мембранами. По
механизму действия мембраны Пунгора
не отличаются от аналогичных мембран
из спрессованных порошковых дисков.
Наряду
с кристаллическими мембранами в ИСЭ
используются также гетерогенные
мембраны (мембраны Пунгора), в
которых твердый
материал с ионной проводимостью в виде
тонкодисперсного
порошка помещен в инертную матрицу.
Благодаря этому удается
получить мембраны из соединений, которые
не образуют кристаллы. В качестве
активных веществ в таких мембранах
применяют самые разнообразные материалы
(труднорастворимые соли металлов,
оксиды, карбиды, бориды, силициды,
хелатные соединения, ионообменные
смолы), а в качестве связующего материала
- парафин, коллодий, поливинилхлорид,
полистирол, полиэтилен, силиконовый
каучук и др.
Считается, что они менее чувствительны
к окисляющим и
восстанавливающим агентам, чем электроды
с кристаллическими мембранами. По
механизму действия мембраны Пунгора
не отличаются от аналогичных мембран
из спрессованных порошковых дисков.
Свойства гетерогенных мембран существенно зависят от свойств связующего материала, который определяет их химическую стойкость, механическую прочность и смачиваемость. В последнее время в качестве связующего материала широко применяют силиконовый каучук. Он имеет идеальные гидрофобные свойства, а эластичность, сопротивление растрескиванию и относительно малое набухание силиконового каучука в водных растворах делают его наиболее ценным связующим материалом.
Выпускаются также электроды, мембрана которых изготовлена из проводящего материала, состоящего из графита и политетрафторэтилена, пропитанного сульфидом соответствующего металла. Недостатком таких электродов является необходимость их специальной подготовки перед применением в отличие от электродов с готовыми мембранами.
Б 18. pH-метрия. электроды, используемые для определения pH (газовый водородный, металлоксидный, хингидронный, СТЕКЛЯННЫЙ).
Газовые электроды – полуэлементы, состоящие из металла, контактирующий одновременно с соответствующим газом и ионами этого газа. Конструирование газового электрода невозможно без участия проводника с электронной проводимостью. Требования к металлам в газовом электроде: 1) должны ускорять медленно устанавливающееся электродное равновесие (схоже с катализатором); 2)потенциал металла в газовом электроде не должен зависеть от активности других ионов раствора, в частности, от активности собственных ионов металла. 3) должны быть инертными по отношению к другим возможным реакциям. 4) должны обладать максимально развитой поверхностью, на которой могла бы протекать обратимая реакция ионизации газа. ( платинированная платина, то есть платина, покрытая элекролитически платиновой чернью). Газовый водородный электрод: Н+Н2Рt.
E=0,059lg a(Н+)- 0,059/2 lg p(H2), при р=1 атм E=-2,303RT/F pH
ГВЭ можно использовать как индикатор при определении pH раствора в растворах кислот и щелочей любой концентрации. При постоянном значении pH, можно использовать как электрод сравнения в любых растворах. Металлоксидные электроды 2 рода. Состоят из металла, покрытого слоем его труднорастворимого соединения (оксид) и погруженного в раствор, содержащий тот же анион, что и труднорастворимое соединение электродного металла. Ртутнооксидный электрод: OH-HgOHg
HgO+H2O+ 2e=Hg + 2OH-, E=Eo-0,059lg a(OH-)
Можно использовать в нейтральных и щелочных растворах.
Сурьмяный электрод: OH-|Sb2O3|Sb
Sb2O3+3H2O+6e=2Sb+6OH- , E=E0-0,059lga(OH-)
не используют в качестве электрода сравнения, т. к. у него неустойчивый состав поверхности, применяют как индикаторный электрод при приближенном определении pH в умеренно кислых и нйтральных растворах.
Хингидронный электрод обратим по отношению к системе хинон-гидрохинон. E=Eo+RT/2F ln (aх/ ахг) + RT/F ln a(H+), в раствор, pH которого нужно измерить вводят эквимолярную смесь хинон-гидрохинон. При 25 оС E=0,6992+0,059pH
Хингидронный электрод легко приготовить, удобен в работе, температурная зависимость его хорошо изучена, но можно применять только в кислых нейтральных растворах, нельзя применять в присутствии сильных окислителей и восстановителей.
Широкое распространение средств измерений рН для различных целей обусловлено наличием удобных и разнообразных стеклянных электродов. По принципу действия стеклянный электрод относится к мембранным электродам типа Ag, AgCl │HC1 (0,1 моль/л) │ стекло │ исследуемый раствор.
Его изготавливают в виде стеклянного шарика, внутри которого вмонтирован вспомогательный электрод. В качестве последнего применяют хлоридсеребряный или каломельный электроды в растворе соляной кислоты с постоянным значением рН или в хлоридном буферном растворе.
Большой вклад в развитие теории стеклянных электродов внесли работы Никольского. В настоящее время принято считать, что на поверхности стекла при длительном контакте мембраны с раствором молекулы воды проникают в нее на глубину 10 - 1000 А, образуя гидратированный поверхностный слой, в котором протекают реакции ионного обмена между катионами щелочных металлов, входящими в состав силикатов, и ионами водорода. Основные структурные характеристики стекла в гидратированном слое не меняются, но подвижность катионов значительно увеличивается по сравнению с подвижностью в плотной внутренней части стеклянной мембраны. При этом транспорт катионов в гидратированном слое регулируется вакансионным механизмом, согласно которому вакансиями являются катионы в межузловых положениях трехмерного скелета, построенного из кремнийкислородных цепочек.
При контакте с раствором они могут обмениваться на другие катионы, главным образом на ионы водорода:
Н+р-р + М+ст = Н+ст + М+р-р
Константа обмена этого процесса (Кобм) зависит от сорта стекла, температуры, состава раствора и определяется выражением
 .
(22)
.
(22)
В простейшем случае электродный процесс сводится к обмену ионами водорода между раствором и стеклом и отвечает перемещению единичного заряда:
 .
(23)
.
(23)
Член Е° включает в себя потенциал вспомогательного электрода, потенциал электрода сравнения и потенциалы жидкостных соединений, имеющихся в ячейке.
потенциал стеклянного электрода в общем случае определяется активностью ионов водорода и щелочного металла в растворе. Если
aH+>>KобмаМ+,
что имеет место в случае кислых растворов, а также вследствие малой величины Кобм для нейтральных и слабощелочных сред, вплоть до рН 10-12.
![]() (25)
(25)
электродный потенциал зависит только от активности ионов водорода, и поэтому стеклянный электрод используется как для непосредственного определения рН, так и для фиксирования точки эквивалентности при кислотно-основном титровании. Во втором случае, когда
aH+<<KобмаМ+,
т.е. в достаточно щелочной области
![]() (26)
(26)
где в величину Е° входит слагаемое, содержащее константу обмена. В этом случае потенциал стеклянного электрода зависит от активности ионов щелочного металла, т.е. электрод приобретает металлическую функцию и его потенциал не зависит от рН. Тогда его можно использовать для определения ионов щелочных металлов.
Из приведенных примеров видно, что водородная функция стеклянного электрода нарушается в сильнощелочной и в сильнокислой области. Для большинства электродов в кислых растворах ошибка в измерении рН становится заметной только при рН < 2 и достигает достаточно большой величины при рН, близких к нулю. Кислотная ошибка приводит к завышению результатов определения рН по сравнению с истинными.
В щелочных средах при рН > 9 значения потенциалов ниже рассчитанных по уравнению Нернста. При дальнейшем увеличении рН ошибка возрастает. Величину щелочной ошибки можно существенно снизить, если использовать стекла другого состава. Чем меньше радиус катиона щелочного металла в стекле, тем меньше конкурирующих катионов (помимо ионов водорода), способных его замещать, и тем выше должна быть их концентрация в растворе, чтобы они могли внедриться в стекло. В настоящее время разработаны литиевые стекла, щелочная ошибка которых в десятки раз меньше, чем у обычных электродов. Электроды из таких стекол можно использовать даже в растворах КОН или NaOH с концентрацией 0,1 моль/л.
Для измерения потенциала стеклянного электрода его включают в цепь с электродом сравнения и помещают в исследуемый раствор. Потенциал каждой из сторон стеклянной мембраны обусловлен соответствующими реакциями ионного обмена. На одной из них (внутренней) он остается постоянным, а на другой (внешней) зависит от состава раствора. Таким образом, потенциал стеклянного электрода представляет собой разность потенциалов между двумя поверхностями мембраны. Если бы они были идентичными, то для одного и того же раствора внутри электрода и с его внешней стороны потенциал должен был бы равняться нулю. Однако на практике для стеклянного электрода наблюдается некоторая разность потенциалов, называемая потенциалом асимметрии, которая входит в величину его гипотетического стандартного потенциала.
Возникновение потенциала асимметрии возможно при химических воздействиях на поверхность электрода (протравливание щелочами или плавиковой кислотой), механических повреждениях (стачивание, шлифование), адсорбции жиров, белков и других поверхностно-активных веществ. К наиболее важным причинам возникновения потенциала асимметрии относится изменение сорбционной способности стекла по отношению к воде при термической обработке в процессе изготовления электрода. Некоторый вклад вносит дегидратация набухшего поверхностного слоя (высушивание или выдерживание в дегидратирующем растворе). Возникновению потенциала асимметрии способствует неодинаковое напряжение на двух сторонах стеклянной мембраны. Мешающее действие потенциала асимметрии компенсируют при настройке рН-метров по стандартным буферным растворам, имеющим постоянную и точно известную концентрацию ионов водорода.
стеклянный электрод имеет целый ряд преимуществ. Он пригоден для определения рН в области от 0 до 12. Электрод не чувствителен к окислителям и восстановителям, не отравляется, может работать в средах, содержащих катионы различных металлов. Равновесие между раствором и электродом устанавливается достаточно быстро. Кроме того, стеклянный электрод отличается высокой селективностью, поскольку радиус гидратированного протона существенно отличается от радиуса всех других ионов. Для фазового перехода протону необходима относительно малая энергия активации и он может переходить через энергетический барьер по туннельному механизму.
Стекла, применяемые для изготовления электродов, должны иметь следующие свойства: невысокое сопротивление, малый потенциал асимметрии, небольшую щелочную ошибку. Они не должны также заметно растворяться, иначе рН приэлектродного слоя будет отличаться от рН в глубине раствора. Чаще других для изготовления стеклянных электродов используют легкоплавкое натриевое стекло или литиевое стекло. При введении в состав стекла оксидов алюминия и бора можно изготовить электроды, которые дают отклик не на рН, а на изменение концентрации (активности) катионов натрия, лития, аммония, серебра и других ионов.
Применяются стеклянные мембраны, чувствительные к ионам Li+. Коэффициенты селективности KLi/Na и KLi/K таких мембран приблизительно равны 0,3 и 0,001 соответственно.Чтобы перевести электрод из одной формы в другую, его обычно вымачивают длительное время в растворе, содержащем соответствующий ион металла, время от времени заменяя раствор.
Разработаны также электроды на основе халькогенидных стекол, легированных Fe (≈2%), которые имеют нернстовский отклик к ионам Fe (III) и Сu (II). Еще один электрод из халькогенидного стекла состава Cu6AS4S9 чувствителен к ионам Сu (II), что позволяет использовать его для определения меди при концентрации до 1 мкг/л. Предложены и другие электроды такого типа, селективные к Cu2+, Pb2+, Ag+.
Стеклянные электроды можно использовать для измерений в неводных и смешанных растворителях. В смешанных растворителях стеклянные электроды обычно сохраняют свою функцию по отношению к определяемым ионам, хотя при этом и наблюдается изменение коэффициентов селективности.
Применимость стеклянных электродов в неводных растворителях ограничивается высоким сопротивлением раствора. Чтобы увеличить электропроводность в растворителях с низкой диэлектрической проницаемостью добавляют фоновый электролит или раствор соли.
в неводных средах стеклянные электроды даже одного и того же образца могут проявлять разные свойства в зависимости от условий предварительной обработки. В большинстве случаев электрод перед употреблением оставляют «набухать» на 12-48 час в растворителе, в котором предполагается его использовать. Трудности возрастают, если в процессе работы необходимо заменить один растворитель другим. Шкала рН, отнесенная к водному стандарту, в неводных средах не может быть использована.Учитывая, что стеклянные электроды имеют очень высокое сопротивление, от 1 до 500 МОм, для измерения электродных потенциалов применяют электронные вольтметры с входным сопротивлением порядка 1011 - 1012 Ом. Погрешность измерений в настоящее время практически не зависит от рН-метра, а определяется самим стеклянным электродом и стандартными растворами, используемыми для калибровки.
В последнее время рН-метры снабжают термисторами, которые автоматически компенсируют влияние изменения температуры.
Б 19.Ионоселективные электроды с жидкими мембранами и подвижными носителями.
В электродах с жидкостной мембраной пористая перегородка, пропитанная неводной фазой, разделяет две водные фазы – исследуемый раствор и внутренний раствор электрода. При этом неводная фаза содержит гидрофобные ионы (активные центры ионообменника), присутствие которых определяет ионоселективную функцию электрода, и противоположно заряженные определяемые ионы (противоионы). Поведение такой мембраны определяется коэффициентом распределения соли ионообменника с определяемым ионом между водным раствором и несмешивающимся с водой растворителем, образованием ионных пар в фазе мембраны и степенью проницаемости мембраны по отношению к посторонним ионам.
Если пористая перегородка пропитана органическим растворителем с растворенными в нем катионами достаточно больших
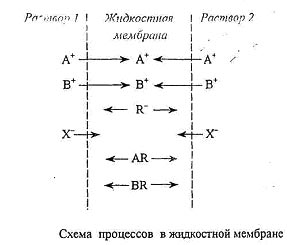
размеров (четвертичные аммониевые соли, комплексы переходных металлов и др.), то такая мембрана реагирует на изменение активности анионов. И наоборот, если пропитывающий пористую перегородку раствор содержит анионные комплексообразующие агенты или анионы большого размера, то мембрана чувствительна к изменению активности катионов. При этом жидкий ионообменник не должен растворяться в исследуемом растворе и в растворе сравнения.
Жидкостные ионообменные мембраны можно изготовить и на основе растворов нейтральных молекул. Наиболее известным примером указанных электродов является электрод на основе валиномицина, коэффициент селективности которого по отношению к ионам калия почти на два порядка превышает аналогичный коэффициент для лучших стеклянных электродов.
Теория возникновения потенциала в случае жидкостных мембран основана на учете распределения вещества между двумя несмешивающимися жидкостями.
Если в мембране содержится достаточное количество ионизирующегося вещества, то катионы А+ и В+ переходят через границу мембрана/раствор, а крупные по размеру гидрофобные анионы остаются в органической фазе. При этом анионы практически не проникают из раствора в мембрану. На поверхности мембраны возникает потенциал, который для хорошо диссоциирующих солей АR и БR описывается выражением, формально не отличающимся от выражения для твердых мембран:
![]() (27)
(27)
где кА и кB – коэффициенты распределения ионов А+ и В+ между водной фазой и органическим растворителем.
селективность жидкостных мембран зависит от коэффициентов распределения и подвижности ионов А+ и В+. В случае полной диссоциации молекул ионита подвижность ионов определяется только природой растворителя и не зависит от природы аниона.
При использовании растворителей с низкой диэлектрической проницаемостью (ε < 10), таких как алифатические и ароматические углеводороды и некоторые их производные, наблюдается сильная ассоциация катионов А+ и В+ с анионами. В результате образуются нейтральные пары. Электродный потенциал указанных систем зависит от подвижности ионов и является сложной функцией от природы растворителя и растворенного вещества.
В общем случае параметр селективности для жидкостных мембран определяется соотношением:
![]() (28)
(28)
в котором вклад величины Кобм можно оценить следующим образом:
![]() (29)
(29)
где kar и kbr – константы ассоциации ионов А+ и В+ с R.
Для различных систем мембранный потенциал определяется первым и вторым членом выражения. Например, в случае, когда анион RT более подвижен, чем противоионы А+ и В+, мембранный потенциал определяется преимущественно вторым членом. При этом селективность, характеризуемая константой ионообменного равновесия, зависит от свойств растворителя, образующего мембрану, и от химической природы органофильных ионов.
В жидкостных мембранах с сильной ассоциацией молекул ионита, ведущей к образованию мицелл, более вероятен вакансионный механизм переноса, при котором создается своеобразная эстафетная цепь, т.е. происходит перескок иона от одной частицы к другой. Селективность электродов с такими мембранами зависит в основном от природы ионита, а не растворителя.
В случае нейтральных переносчиков (S), типичным примером которых являются макроциклические соединения, селективность жидкостных мембран определяется равновесными параметрами и зависит от отношения кB/кА. Механизм переноса также отличается от ионообменного, поскольку в нем не участвуют заряженные ионообменные центры. Вместо этого образуются заряженные комплексные ионы (KS+) нейтральных молекул с катионами, которые и выступают переносчиками последних:
К+ + S = KS+.
Для катионов приблизительно одинакового размера с одинаковым зарядом отношение кB/кА не зависит от природы растворителя, поскольку комплексы практически не отличается друг от друга по устойчивости. По этой причине селективность таких мембран зависит только от химических свойств нейтральных переносчиков, которые отражаются на величинах констант образования соответствующих комплексов. Кроме того, селективность во многом зависит от специфичности взаимодействия катионов со связывающими их нейтральными молекулами.
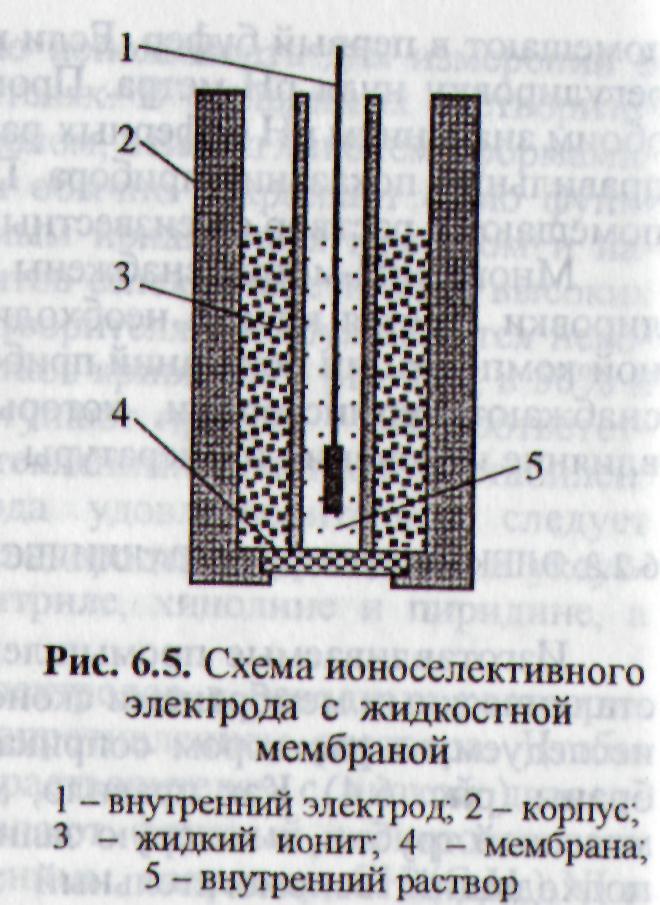
В электродах на основе мембран с подвижными носителями слой жидкого ионообменника, состоящего из не смешивающегося с водой органического растворителя и растворенного в нем ионита, удерживается между анализируемым раствором и водным раствором постоянного состава, в который погружен внутренний электрод, с помощью пористого гидрофобного пластмассового диска. Последний препятствует вытеканию органической жидкости из резервуара, расположенного между двумя концентрическими трубками (рис. 5). Внутреннюю трубку заполняют стандартным раствором определяемого иона и насыщают AgCl, чтобы при погружении в него серебряной проволоки образовался Ag/AgCl-электрод. Данный электрод обладает всеми преимуществами электродов с тонкими мембранами, и в то же время способен выдерживать давление более одной атмосферы без разрушения мембраны или вытеснения из нее органической жидкости.
Рис. 5. Схема ионоселективного электрода с жидкой мембраной 1 − внутренний электрод; 2 − корпус; 3 − жидкий ионит; 4 − мембрана; 5 − внутренний раствор |
|
Жидкая фаза мембраны должна быть нерастворимой в воде и иметь низкое давление паров. Растворитель, даже если он почти не смешивается с водой и имеет низкую летучесть, должен также обладать высокой вязкостью для предотвращения его диспергирования в анализируемом растворе, иначе мембрана не будет иметь достаточную долговечность. Указанным требованиям отвечают многие органические растворители, обладающие сравнительно большой молекулярной массой и низкой диэлектрической проницаемостью.
В качестве ионитов обычно применяют органические соли, которые в полярных растворителях существуют в виде нейтральных, практически недиссоциированных молекул, имеющих кислотные, щелочные или хелатообразующие функциональные группы. Такие соли должны иметь высокую молекулярную массу и хорошую растворимость в растворителях с низкой диэлектрической проницаемостью. Коэффициент распределения ионита между органической фазой и водным раствором должен быть таким, чтобы его концентрация в органической фазе значительно превышала соответствующую величину для водных растворов. Кроме того, ионит должен образовывать с определяемыми ионами более прочные комплексы, чем с любыми потенциально мешающими ионами, присутствующими в анализируемом растворе. Помимо селективности активная группа ионита должна обладать способностью вступать с определяемыми ионами в быстрое подвижное ионообменное равновесие. Как правило, эти условия выполняются, если молекулы ионита содержат длинные углеводородные цепочки с большим числом углеродных атомов.
Первым электродом с жидкостной мембраной был кальций-селективный электрод. В выпускаемых в настоящее время электродах для определения кальция в качестве ионофоров применяют эфиры фосфорной кислоты с двумя алифатическими радикалами, содержащими от 8 до 16 углеродных атомов, или нейтральные переносчики. В случае эфиров фосфорной кислоты на поверхности мембраны устанавливается равновесие
[(RO)2POO]2Ca = 2(RO)2POО- + Са2+.
Выбор фосфорных соединений связан с тем, что фосфат- и полифосфат-ионы образуют с ионами Са+ устойчивые комплексные соединения. Если ионит растворить в менее полярном растворителе, то электрод становится чувствительным по отношению ко всем двухзарядным ионам. Такие мембраны применяют при изготовлении электродов для определения суммарного содержания кальция и магния в растворе, т.е. для определения жесткости воды.
Кальций-селективные электроды реагируют на активность ионов кальция в диапазоне от 10-1 до 10-5 моль/л. При меньшем содержании кальция в анализируемом растворе потенциал электрода не зависит от активности ионов кальция в водной фазе вследствие растворимости кальциевых солей фосфорных эфиров в воде. Определению Са2+ мешают ионы стронция (KCa./Sr = 0,014), магния и бария, для которых коэффициенты селективности имеют несколько меньшую величину.
Высокой селективностью по отношению к ионам тяжелых металлов обладают иониты с активными группами, содержащими серу. Однако использование таких электродов ограничено из-за склонности серосодержащих соединений к окислению и взаимодействию с ионами водорода.
К электродам с анионной функцией относятся мембраны, которые в качестве ионитов содержат комплексы положительно заряженных переходных металлов с нейтральными органическими лигандами. Комплексные соли типа ML3(NO3)2, где L - лиганд, функционируют как анионообменники. На их основе разработаны электроды, селективные к ионам С1O4-, NO3-, BF4-, Сl-.
![]() (30)
(30)
В качестве активных компонентов мембран для определения нитрат-ионов используются также четвертичные аммониевые и фосфониевые соли. Коэффициенты селективности по отношению к ионам Сl-, NO2-, SO42- не превышают 10-2. Ионообменники на основе солей тетраалкиламмония находят применение для изготовления хлоридных электродов. В качестве органического катиона в них используется диметилдистеариламмоний. Электроды можно применять для измерения активности ионов хлора в присутствии сульфид-ионов, которые оказывают значительное влияние на показания твердых хлоридных электродов.
Разработан ряд ИСЭ для определения ионных поверхностно-активных веществ (ПАВ). Мембраны таких электродов состоят из ионов соответствующих ПАВ и подходящего ионообменника. В форме анионных комплексов можно определять катионы ряда тяжелых металлов, например AuCl4-, Ag(CN)2- и др.
Для ионоселективных электродов наиболее подходят те соединения, которые при образовании комплексов способны заместить гидратную оболочку определяемого иона и достаточно растворимы в фазе мембраны. К нейтральным переносчикам относят и соединения с открытой цепью - поданды. Хотя по комплексообразующей способности они уступают циклическим аналогам, относительная простота синтеза и доступность подандов явились причиной их распространения в ионометрии.
При выборе мембраноактивных комплексов учитывают следующие требования:
молекула должна иметь стабильную конформацию с пространственной полостью из полярных групп, необходимых для связывания катиона;
неполярные группы должны образовывать вокруг иона гидрофобную оболочку;
координационные центры должны быть распределены в лиганде таким образом, чтобы при комплексообразовании образовывались пятичленные хелатные циклы;
для катионов щелочных и щелочноземельных металлов предпочтительными являются соединения, содержащие атомы кислорода.
Гидрофобные углеводородные радикалы образуют внешнюю оболочку и обеспечивают растворимость комплексов в органической фазе мембраны.
Раствор валиномицина в дифениловом эфире является основой мембраны калий-селективного электрода. При определении калия в присутствии натрия такая мембрана характеризуется коэффициентом селективности < 10-4. Электрод позволяет определять калий в диапазоне концентраций от 10-1 до 10-5 моль/л. Единственным ионом, оказывающим влияние на показания калиевого электрода, является ион аммония.
Выпускаемые в настоящее время электроды на основе мембран с подвижными носителями снабжены модульными насадками, которые навинчиваются на корпус электрода. Модули содержат отдельно органическую и водную фазы в пористых пластмассовых резервуарах вместе с внутренними хлоридсеребряными электродами сравнения и пористой мембраной и не требуют дополнительной подготовки к работе.
Основным недостатком таких электродов является истечение раствора ионообменника в исследуемый раствор, что заставляет постоянно подпитывать мембрану с ее краев. Другой источник проблем связан с трудностями в заполнении всех пор мембраны раствором ионообменника.
От указанных недостатков свободны электроды на основе пластифицированных полимерных мембран. Они аналогичны электродам на основе мембран с подвижными носителями, за исключением того, что жидкий ионообменник находится в гомогенной полимерной пленке (матрице); во многих случаях один и тот же ионообменник можно использовать в электродах обоих типов. Для получения достаточно прочной и эластичной пленки растворитель ионообменника должен быть одновременно пластификатором полимера. Выпускаются также миниатюрные ИСЭ для клинических анализов
Хотя электроды на основе пластифицированных полимерных мембран имеют меньший срок службы, чем электроды на основе мембран с подвижными носителями, они более удобны в работе. Лучше всего такие электроды работают в нейтральных или слабокислых растворах; ограничение связано с ионообменником, а не с материалом матрицы. Во избежание загрязнения или растворения активной фазы анализируемые растворы не должны содержать органических соединений.
В настоящее время выпускаются нитрат-, тетрафторборат-, перхлорат-селективные электроды с пластифицированными мембранами, которые позволяют измерять концентрацию соответствующих ионов в диапазоне от 1 до 10-5 моль/л при температурах от 0 до 40 °С. Разработаны также электроды для определения Са2+, Na+, K+. Необходимым условием отклика мембраны является равновесие реакции определяемого иона с комплексообразующим реагентом или с ионообменником.
Для определения ионных ПАВ применяют твердоконтактные ИСЭ с графитовым или серебряным токоотводом. В качестве второго полуэлемента применяют хлоридсеребряный электрод.