
- •Б 1. Классификация э/х методов анализа: принципы, лежащие в основе различных способов классификации.
- •Б 2. Потенциометрия. Потенциометрическое титрование, преимущества потенциометрической индикации ктт.
- •Б 3. Индикаторные электроды и их выбор для реакции нейтрализации, о-в, осаждения и комлексообразования.
- •Б 4. Методы определения кт потенциометрического титрования. Дифференциальное титрование. Метод Грана.
- •Б 7. Изменение буферности в ходе нейтрализации слабой кислоты сильным основанием, кривая титрования и ее расчет.
- •Б 10. Нейтрализация смесей кислот. Возможность и точность раздельного определения кислот в водной среде.
- •Б 13. Факторы, определяющие выбор растворителя для титрования индивидуальных слабых протолитов и дифференциального анализа смесей протолитов.
- •1. Твердые мембраны
- •3. Особые электроды.
- •Б 20. Газочувствительные и ферментные электроды.
- •(Потенциометрические биосенсоры) ферментные электроды.
- •21.Весовой электроанализ (электрогравиметрИя) при контролируемом потенциале. Внутренний электролиз.
- •Электрогравиметрический анализ
- •Б 23. Кулонометрическое титрование с внутренней генерацией титранта; методы индификации конечной точки титрования; преимущества метода.
- •Б 26. Уравнение Ильковича; диффузионный ток и его зависимость от концентрации деполяризатора.
- •Б 35. Амперометрическое титрование с двумя заполяризованными электродами.
- •Б 36. Емкостный ток и чувствительность постояннотоковой полярографии.
- •Б 37. Вольтамперометрия с быстрой разверткой (хроновольтамперометрия).
- •Прямая полярография с импульсами прямоугольной формы.
- •Б39.Дифференциальная импульсная полярография.
- •Б 41.Хронопотенциометрия.
- •Б 42. Инверсионная вольтамперометрия.
Б 41.Хронопотенциометрия.
Хронопотенциометрией называется одноимпульсный метод с импульсами тока прямоугольной формы.

Рий 152. Принципиаль- Рнс. 153. Форма хронопотенцио-
ная схема гальваностати- граммы
ческого осциллографиче-ского полярографа
Короткий импульс тока подается на ртутный капельный электрод непосредственно перед отрывом капли, когда ее поверхность и плотность тока можно считать постоянными. Вначале потенциал электрода резко изменяется (рис. 153), что объясняется заряжением двойного слоя. Затем изменение потенциала замедляется вследствие расхода тока на электрохимическую реакцию. После израсходования всего деполяризатора в приэлектродном слое потенциал начинает быстро сдвигаться в сторону более высоких значений. Время, необходимое для полного расхода деполяризатора из приэлектродного пространства, называется переходным временем и определяется по уравнению

которое зависит от коэффициента диффузии, концентрации деполяризатора и плотности тока I.
Для обратимой электрохимической реакции получено уравнение хронопотенциометрической кривой:

где φ1/2 — полярографический потенциал полуволны. Из (IV.70) видно, что когда t = τ/4, то φ = φ1/2.
Для аналитических целей хронопотенциометрия используется сравнительно редко, чаще она применяется для исследования кинетики электродных процессов.
Б 42. Инверсионная вольтамперометрия.
Электрохимическое накопление вещества из разбавленного раствора в большинстве случаев происходит при постоянном потенциале, величина которого обеспечивает достаточно большую скорость электродной реакции. Для ускорения электролиза раствор при этом перемешивают. В результате электролиза происходит концентрирование определяемого вещества с образованием амальгамы или пленки малорастворимого соединения на поверхности ртутного или твердого микроэлектрода. После стадии успокоения выделенное вещество электрохимически растворяют, регистрируя зависимость токa растворения от потенциала, который снижается при этом линейно со временем. Вообще инверсионный процесс, т. е. информативную стадию электрорастворения, можно исследовать не только методами вольтамперометрии, но и другими электрохимическими методами. Поскольку в фазе микроэлектрода или на границе раздела электрод-раствор определяемое вещество находится в значительно большей концентрации, чем первоначальная концентрация в растворе то становится ясной причина понижения предела обнаружения на несколько порядков. Регистрируемая вольтамперограмма имеет вид пика, положение которого на оси потенциалов характеризует природу вещества, а высота или плошадь пропорциональна его концентрации в растворе при некоторых условиях электронакопления. На рисунке схематически проиллюстрирован принцип инверсионной вольтамперометрии. Поскольку в данном случае на оси абсцисс отражается не только изменение потенциала, но и время растворения. Правая и левая ветви анодного пика не равнозначны. Правая ветвь соответствует потенциалам, предшествующим достижению максимального диффузионного тока, и ее крутизна определяется кинетикой процесса окисления металла из амальгамы. В случае обратимых процессов эта ветвь ниспадает круто. Левая ветвь анодного пика проявляется при потенциалах, соответствующих предельному диффузионному току.

Рис. 7.1. Принцип инверсионной вольтамперометрии:
1 - накопление при Econ = const; масштаб тока на несколько порядков больше, чем при регистрации; 2- растворение.
Она отражает изменение предельного тока анодного растворения амальгамы во времени, но не в связи с изменением потенциала. Ход этой ветви анодного пика остается таким же, если при достижении тока в пике прекратить изменение потенциала и регистрировать кривую зависимости сила тока-время при постоянном потенциале (в данном случае при Ер). Соответственно катодная инверсионная вольтамперометрия имеет дело с растворением пленок малорастворимых соединений с ртутью.
Высота пика растворения iр обычно зависит от таких факторов, как количество вещества, сконцентрированного на электроде, которое является функцией его содержания в растворе, потенциал накопления, продолжительность накопления, интенсивность перемешивания или скорость вращения электрода, если электрод вращающийся, размер рабочего электрода, состав раствора и его температура. Условия регистрации инверсионного процесса также определяют величину iр, т. е. такие факторы, как скорость изменения потенциала, размер электрода, скорость отвода продуктов растворения и т.д.
площадь, ограниченная анодным пиком и осью абсцисс, равна количеству электричества, пошедшего на окисление металла из амальгамы. Это свойство инверсионной кривой, особенно при растворении пленок вещества на поверхности электрода, используют при определении концентрации. Для концентрирования веществ на рабочем электроде используют различные электрохимические или химические реакции, которые в зависимости от природы определяемого вещества и материала электрода можно сгруппировать следующим образом.
1. Образование амальгамы. По величине анодного тока растворения амальгамы металла, образованной в предэлектролизе на ртутном микроэлектроде раствора соответствующего иона, определяют содержание последнего.
2. Образование пленки металла на образующей амальгаму поверхности инертного электрода, которая затем анодно растворяется.
3. Образование малорастворимых химических соединении на поверхности электрода. Такие соединения могут возникать в ходе анодной реакции материала электрода с определяемыми нонами.
4. Образование адсорбционных пленок с участием пав. Эти вещества в адсорбированном состоянии реагируют на поверхности электрода с определяемым ионом, образуя комплексное соединение. В других случаях этот комплекс образуется в растворе и затем адсорбируется на поверхности электрода. В обоих случаях растворение адсорбционной пленки происходит при ее восстановлении или окислении. Хотя количество адсорбированного на электроде вещества зависит от потенциала электрода, однако концентрирование определяемого иона в виде комплекса с поверхностно-активным веществом может происходить и в отсутствие тока, т.е. при разомкнутой цепи.
Выбор рабочего электрода в инверсионных методах имеет большое значение. В принципе здесь используют те же типы электродов, что и в методе вольтамперометрии с линейным изменением потенциала, хотя требования к воспроизводимости поверхности выше.
Ш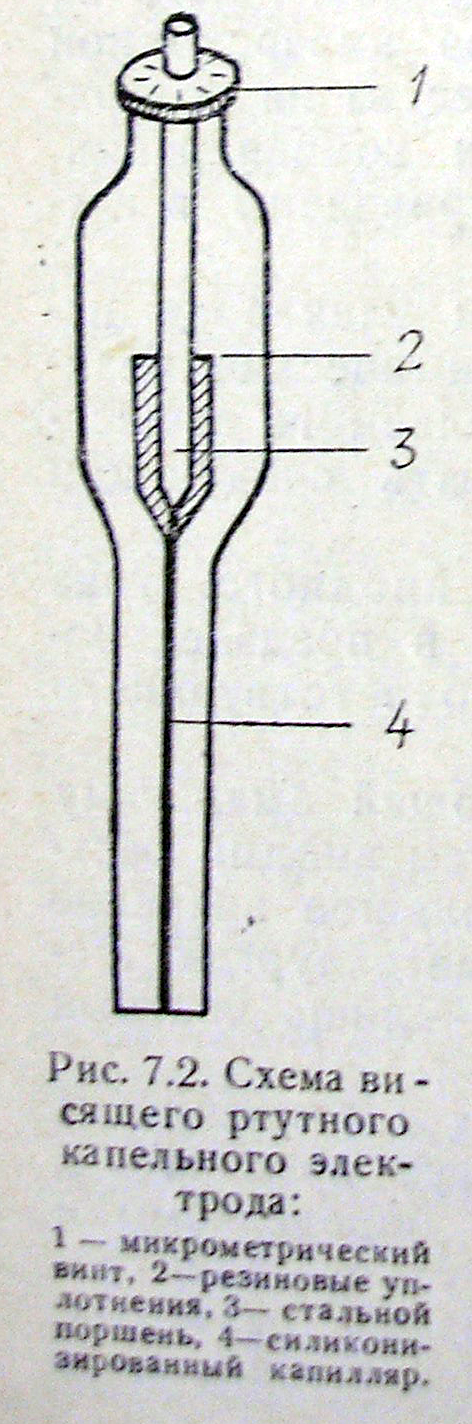 ирокое
распространение получили стационарные
ртутные капельные электроды разнообразной
конструкции. Успех в развитии инверсионной
вольтамперометрии на первых этапах
связан именно со стационарным ртутным
капельным электродом. У этих электродов
ртутная капля „подвешена" на ртутном
столбике в капилляре с внутренним
диаметром 0,15—0,5 мм. Капилляр с резервуаром,
из которого ртуть выдавливается поршнем,
ход которого регулируется с помощью
микрометрического винта. Кроме
этого типа электродов, используют
стационарные ртутные
электроды с инертной подложкой.
ирокое
распространение получили стационарные
ртутные капельные электроды разнообразной
конструкции. Успех в развитии инверсионной
вольтамперометрии на первых этапах
связан именно со стационарным ртутным
капельным электродом. У этих электродов
ртутная капля „подвешена" на ртутном
столбике в капилляре с внутренним
диаметром 0,15—0,5 мм. Капилляр с резервуаром,
из которого ртуть выдавливается поршнем,
ход которого регулируется с помощью
микрометрического винта. Кроме
этого типа электродов, используют
стационарные ртутные
электроды с инертной подложкой.
Если уменьшать объем ртути на электроде без уменьшения его поверхности, то за одно и то же время предэлектролиза образуется амальгама более высокой концентрации, а отсюда и понижается предел обнаружения (на 1—2 порядка). Этот эффект применяют при накоплении с помощью пленочных ртутных электродов.
В практике инверсионной вольтамперометрии получили распространение твердые электроды из углеродистых материалов. Наиболее часто используются электроды из спектральных углей, пропитанных в вакууме различными нмпрегнаторами. В качестве последних применяют эпоксидную смолу, парафин, смесь парафина с полиэтиленом. Преимущество инверсионных методов анализа — высокая чувствительность, намного превышающая чувствительность любого другого электрохимического метода, поэтому они используются для определения следовых и ультраследовых количеств веществ. Пределы обнаружения инверсионными методами сравнимы с пределами обнаружения беспламенных атомно-абсорбционных методов тех элементов, которые в принципе определяются и теми и другими методами, однако число элементов, которые можно определить методами инверсионной вольтамперометрии, меньше. Анодная инверсионная вольтамперометрия на практике использовалась для определения ионов: Ag, Au, Bi, Cd, Cu, Hg, In, Pb, Rh, Sn, Tl и Zn. Инверсионные методы применяются для анализа элементов; анализ соединений требует разработки особых условий и приемов анализа.
ИНВЕРСИОННАЯ ВОЛЬТАМПЕРОМЕТРИЯ АМАЛЬГАМ.
Предварительное накопление металла в объем ртутного микроэлектрода в инверсионной вольтамперометрии обычно проводят при потенциале предельного тока восстановления исследуемого иона. Если объем раствора, подвергаемого электролизу, велик по сравнению с объемом рабочего электрода, а время предэлектролиза мало, то предельный ток электролиза можно считать постоянным и заметного уменьшения концентрации иона металла в растворе происходить не будет. По закону Фарадея можно оценить количество металла перешедшего в амальгаму
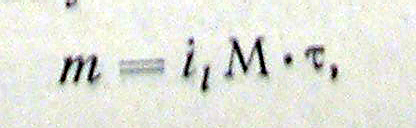
где il- предельный ток иона металла, t- время предэлектролиза, М- молекулярная (атомная) масса.
Для приближенной оценки количества металла в амальгаме используют формулу, также вытекающую из закона Фарадея

При малых обьемах раствора и достаточно большом времени электролиза металл полностью переходит из раствора в амальгаму. Эффективность предэлектролиза оценивают по величине предельного тока.
Экспериментально можно найти интервал концентраций ртути, для которого высота пика определяемого металла остается постоянной.
О птимальным
количеством ртути на поверхности
электрода можно считать такое, которое
в стадии ионизации металла из амальгамы
полностью удаляется вместе с ним. Такие
условия формирования ртутно-графитового
электрода позволяют получить электрод
с обновляющейся от измерения к измерению
ртутной поверхностью. Поскольку
количество ртути на поверхности электрода
в этом случае невелико и сравнимо с
количеством выделенных на электроде
металлов, то ее ионизация происходит в
достаточно узком интервале потенциалов.
Типичные кривые ионизации амальгамы
металлов с поверхности графитового
электрода приведены на рисунке. пики
ионизации металлов из амальгамы,
находящейся в виде пленки, имеют небольшую
ширину без диффузионных шлейфов, что
обеспечивает более высокую разрешающую
способность инверсионной вольтамперометрии,
повышает надежность измерения высот
пиков ионизации, увеличивает возможность
определения большего числа компонентов
при оптимальном подборе количества
ртути в пленке.
птимальным
количеством ртути на поверхности
электрода можно считать такое, которое
в стадии ионизации металла из амальгамы
полностью удаляется вместе с ним. Такие
условия формирования ртутно-графитового
электрода позволяют получить электрод
с обновляющейся от измерения к измерению
ртутной поверхностью. Поскольку
количество ртути на поверхности электрода
в этом случае невелико и сравнимо с
количеством выделенных на электроде
металлов, то ее ионизация происходит в
достаточно узком интервале потенциалов.
Типичные кривые ионизации амальгамы
металлов с поверхности графитового
электрода приведены на рисунке. пики
ионизации металлов из амальгамы,
находящейся в виде пленки, имеют небольшую
ширину без диффузионных шлейфов, что
обеспечивает более высокую разрешающую
способность инверсионной вольтамперометрии,
повышает надежность измерения высот
пиков ионизации, увеличивает возможность
определения большего числа компонентов
при оптимальном подборе количества
ртути в пленке.
ИНВЕРСИОННАЯ ВОЛЬТАМПЕРОМЕТРИЯ МЕТАЛЛОВ НА ТВЕРДЫХ ЭЛЕКТРОДАХ.
Если металл не образует амальгаму или его растворимость в ртути невелика, то для накопления используют один из твердых рабочих электродов. Образование осадка на поверхности твердого электрода при накоплении происходит в результате кристаллизации. Процессы электрокристаллизации, особенно при использовании твердых электродов, имеют большое значение в инверсионной вольтамперометрии.
Процесс электроосаждения металла на электроде подобен осаждению и кристаллизации вещества из объема раствора. При осаждении и кристаллизации направление процесса определяется пересыщением раствора, а для электрокристаллизации движущей силой является перенапряжение. В общем случае при электрокристаллизации вещество может осаждаться на электроде из того материала или на электроде из какого-либо индифферентного материала. Для инверсионной вольтамперометрии наиболее интересным является электронакопление на инертном электроде
Для инверсионной вольтамперометрии важное значение имеют электрохимические свойства осадков, полученных на электродах из очень разбавленных растворов. Эти осадки являются достаточно тонкими и рыхлыми. На опыте однако было установлено, что рост пленок при электроосаждении может происходить при относительно небольших величинах перенапряжения, меньших, чем те, которые требуются для роста по механизму поверхностного зародышеобразования. Поэтому было предложено другое объяснение таких пленок — предположение о спиральном росте кристаллов осадка на поверхности электрода. Важное значение имеет не только количество осадка, но его распределение на поверхности электрода.
При электрохимическом растворении осадков на твердых электродах во многих случаях наблюдаются два или даже три пика и растворения осажденного вещества. Одновременно с главным, или основным, пиком регистрируются еще один или два пика при более положительных потенциалах. Эти сопутствующие пики обусловлены различным энергетическим состоянием атомов металла осадка на поверхности электрода. Прежде всего, при электроосаждении сначала образуется монослой осадка; второй слой не возникает до тех пор, пока не произойдет заполнение поверхности первым слоем атомов. Появление не одного, а нескольких сопутствующих пиков для одного и того же металла объясняется тем, что энергия связи первого монослоя не одинакова по всей поверхности электрода, т. е. зависит от гетерогенной поверхности электрода.
Для объяснения сложной формы анодных кривых, наблюдаемых при растворении металлических осадков с поверхности графитовых электродов, в инверсионной вольтамперометрии были введены понятия о двух состояниях осадков на поверхности электрода (адсорбционное и кристаллизационное, или первое и второе энергетические состояния), появляющихся в результате реакции.
![]()
В инверсионной вольтамперометрии большое, значение имеет подготовка поверхности электрода к электронакоплению. На ширину анодных пиков растворения металлических осадков оказывает влияние кинетика процесса ионизации: его обратимость, наличие химических стадий ит.д.
В случае, когда в растворе присутствуют различные ионы металла, способные одновременно разряжаться на электроде, могут появиться осложнения, обусловленные взаимным влиянием металлов в процессе анодного растворения.
ИНВЕРСИОННАЯ ВОЛЬТАМПЕРОМЕТРИЯ МАЛОРАСТВОРИМЫХ
ХИМИЧЕСКИХ СОЕДИНЕНИЙ
Осадки этого типа при накоплении на поверхности электрода образуются в результате двух процессов. В первом случае они возникают при окислении или восстановлении определяемых ионов переменной валентности, за которыми следует химическая реакция образования с каким-либо компонентом раствора малорастворимого соединения. Последнее затем электрохимически восстанавливают или окисляют и измеряют протекающий при этом ток или количество электричества, эквивалентное количеству осадка.
Во втором случае осадки образуются при взаимодействии определяемых компонентов раствора с ионами материала электрода. Если поляризовать, например, ртутный или серебряный электроды анодно, то при соответствующих потенциалах будет происходить электрохимическое растворение материала электродов. Генерированные таким путем ионы при взаимодействии с компонентами раствора участвуют в формировании осадка на рабочем электроде, который в обратном цикле растворяется и дает соответствующий аналитический сигнал.
Эффективность электронакопления и величина нижнего предела обнаружения зависят от растворимости образующихся на электроде соединений. Установлено, что при одних и тех же условиях накопления скорость накопления осадка мало растворимого соединения тем выше, чем ниже его пр. Зависимость тока электрохимического растворения осадка от концентрации исследуемого вещества не всегда линейна. Однако экспериментально можно найти интервал концентраций, в котором эта зависимость линейна.
С помощью этого метода определяют хлориды, бромиды, иодиды, сульфиды на ртутном и серебряном электродах, а также хроматы, вольфраматы, молибдаты, ванадаты и оксалаты и различные органические соединения с подвижным атомом водорода на ртутном электроде. Важным является правильная установка потенциала, при котором начинается образование осадка малорастворимого соединения на поверхности электрода и его максимальное осаждение.
ИНВЕРСИОННАЯ ВОЛЬТАМИЕРОМЕТРИЯ С УГОЛЬНЫМ ПАСТОВЫМ ЭЛЕКТРОДОМ
Угольный пастовый электрод на основе графитового порошка и вязкого гидрофобного органического растворителя находит применение не только как индикаторный в методах вольтамперометрии, но и как рабочий электрод в инверсионных методах. Определяемое электроактивное вещество в данном случае находится в объеме пасты. При поляризации электрода электрохимическое растворение генерирует ток, пропорциональный количеству деполяризатора в объеме пасты. В одних случаях исследуемое вещество вносят в объем пасты до помещения ее в полость электрода, а в других электроактивное вещество концентрируется на поверхности пастового электрода в результате хемосорбции при выдерживании электрода в растворе или при контакте с газовой фазой. При этом появляется возможность идентификации отдельных фазовых компонентов, определения степени окисления металла в соединении, находящемся в пасте, определения концентрации органических веществ и компонентов газовой смеси.
Собственно электрохимический процесс локализуется на границе раздела электрод-раствор. Поскольку его поверхность гидрофобна проникновение электролита в глубину электрода практически не происходит. Электрорастворение прекращается практически после истощения поверхностного слоя деполяризатора.
С помощью пастового электрода проводят окисление или восстановление твердого вещества, сопровождающееся образованием растворимых продуктов диффундирующих в объем раствора.
