- •Б 1. Классификация э/х методов анализа: принципы, лежащие в основе различных способов классификации.
- •Б 2. Потенциометрия. Потенциометрическое титрование, преимущества потенциометрической индикации ктт.
- •Б 3. Индикаторные электроды и их выбор для реакции нейтрализации, о-в, осаждения и комлексообразования.
- •Б 4. Методы определения кт потенциометрического титрования. Дифференциальное титрование. Метод Грана.
- •Б 7. Изменение буферности в ходе нейтрализации слабой кислоты сильным основанием, кривая титрования и ее расчет.
- •Б 10. Нейтрализация смесей кислот. Возможность и точность раздельного определения кислот в водной среде.
- •Б 13. Факторы, определяющие выбор растворителя для титрования индивидуальных слабых протолитов и дифференциального анализа смесей протолитов.
- •1. Твердые мембраны
- •3. Особые электроды.
- •Б 20. Газочувствительные и ферментные электроды.
- •(Потенциометрические биосенсоры) ферментные электроды.
- •21.Весовой электроанализ (электрогравиметрИя) при контролируемом потенциале. Внутренний электролиз.
- •Электрогравиметрический анализ
- •Б 23. Кулонометрическое титрование с внутренней генерацией титранта; методы индификации конечной точки титрования; преимущества метода.
- •Б 26. Уравнение Ильковича; диффузионный ток и его зависимость от концентрации деполяризатора.
- •Б 35. Амперометрическое титрование с двумя заполяризованными электродами.
- •Б 36. Емкостный ток и чувствительность постояннотоковой полярографии.
- •Б 37. Вольтамперометрия с быстрой разверткой (хроновольтамперометрия).
- •Прямая полярография с импульсами прямоугольной формы.
- •Б39.Дифференциальная импульсная полярография.
- •Б 41.Хронопотенциометрия.
- •Б 42. Инверсионная вольтамперометрия.
Б 4. Методы определения кт потенциометрического титрования. Дифференциальное титрование. Метод Грана.
Классический метод
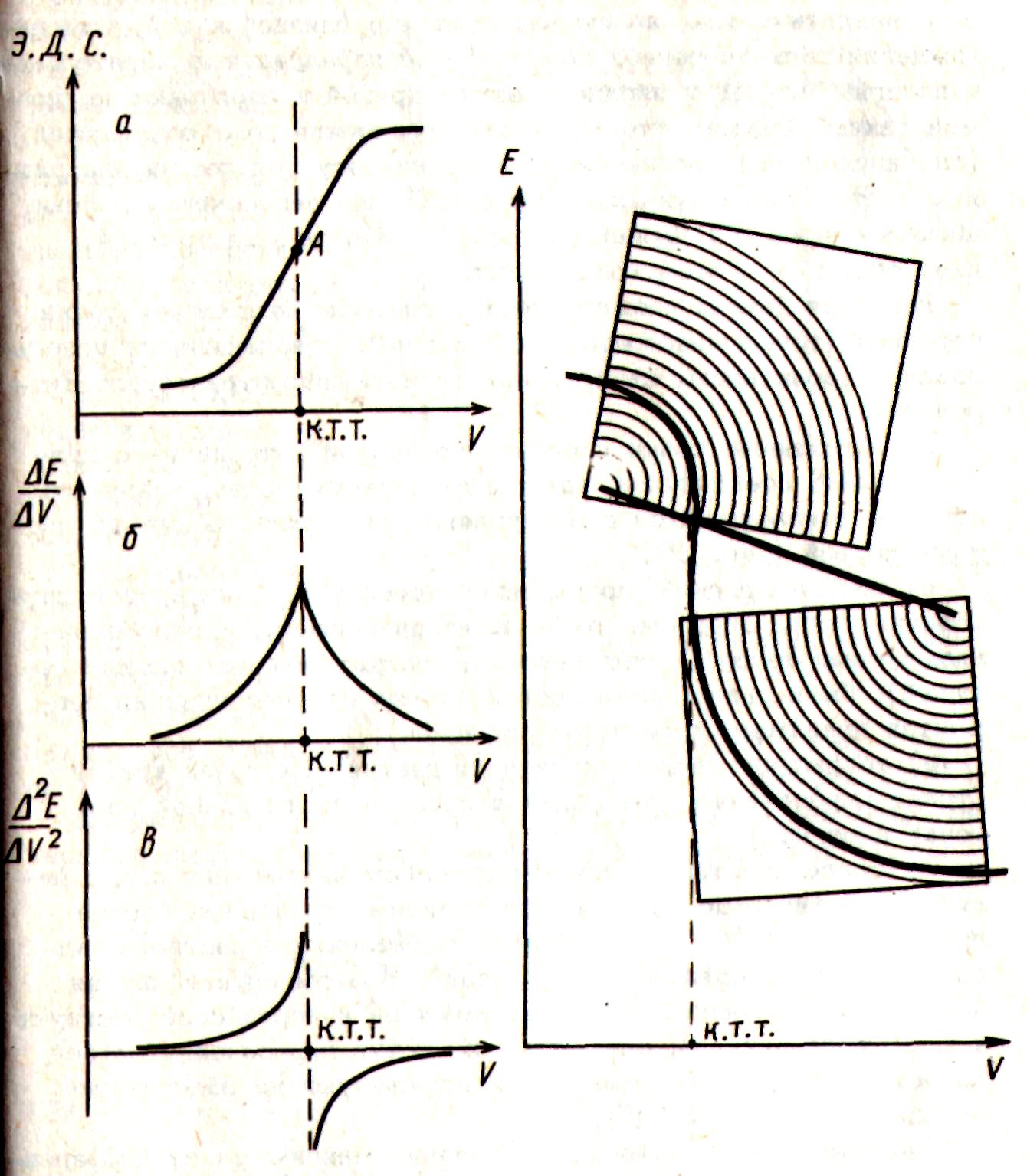
Потенциометрический метод обнаружения к.т.т. заключается в регистрации изменения э.д.с. гальванического элемента, состоящего из исследуемого полуэлемента с индикаторным электродом и полуэлемента сравнения, обычно насыщенного каломельного (нас.к.э.) или хлор-серебрянного электрода (х.с.э.), потенциал которых постоянен. Независимо от техники измерения э.д.с. (компенсационным методом, современным рН-метром или цифровым вольтметром), наиболее распространенным приемом определения к.т.т. является графический способ. Он заключается в построении интегральной кривой титрования (рис. 1а) в координатах э.д.с. гальванического элемента (или потенциал индикаторного электрода) - объем прибавленного раствора титранта V.
Точка перегиба на кривой титрования E=f(V) принимается обычно за к.т.т., которая может совпадать или не совпадать с точкой эквивалентности (т.э.), но должна быть достаточно близкой к ней и обеспечивать необходимую точность анализа.
|
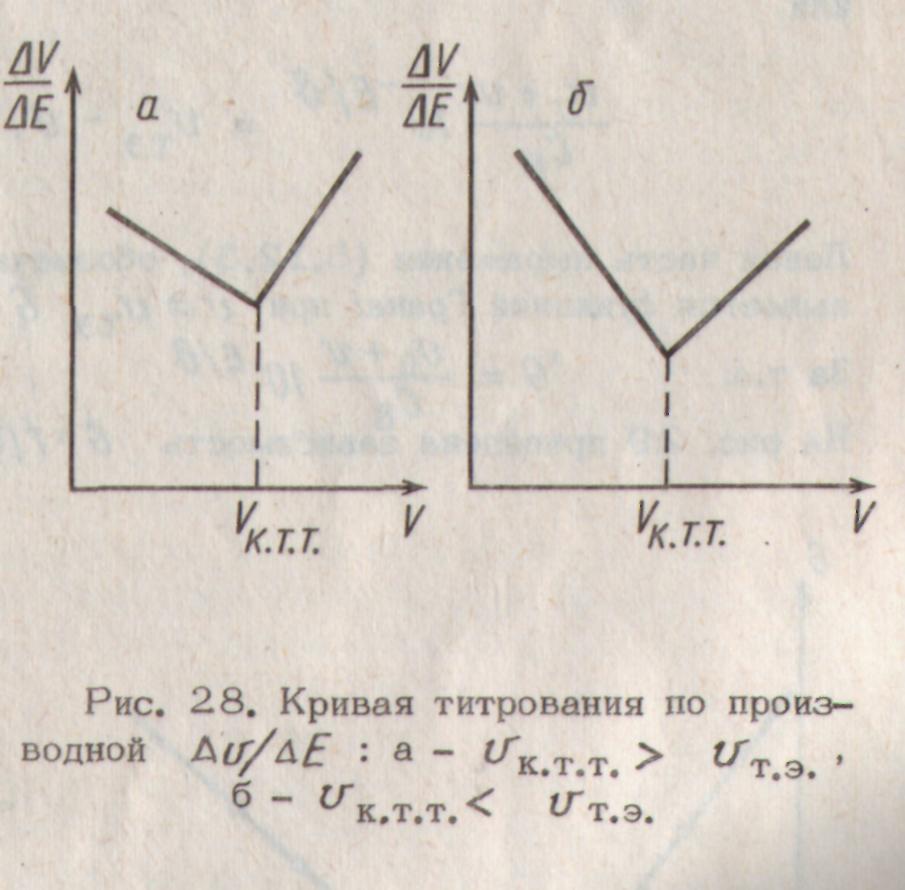
Рис.1. Формы кривых потенцио-метрического титрования: а – интегральная, б – дифференциальная, в- по второй производной Рис. 2. Метод концентрических дуг Рис. 3. Кривая титрования по производной ΔV/ΔE: a −Vк.т.т.>Vт.э.; б − Vк.т.т.<Vт.э.;
|
Рис. 1. Рис. 2. |
|
Более точным способом нахождения к.т.т. является графическое изображение зависимости первой (dE/dV) или второй (d2E/dV2) производной от объема прибавленного титранта. Точка максимального наклона интегральной кривой титрования отвечает точке максимума на кривой dE/dV=f(V) (рис. 1б) и точке, в которой кривая d2E/dV2=f(V) пересекает ось абсцисс (рис. 1в).
Интегральная и дифференциальные кривые титрования могут быть получены вручную или автоматически. В последнем случае используют автоматическую бюретку, ленточно -диаграмный самописец, блок электронного дифференцирования. Расчетный графический метод Грана основан на линеаризации кривых титрования. Кривая титрова- ния трасформируется в две линейные ветви, точка пересечения которых в идеальном случае совпадает с т.э
Б 5. Титрование до потенциала точки эквивалентности. «Некомпенсационный» метод потенциометрического титрования, титрование с биметаллической парой электродов.
Для осуществления такого титрования необходимо либо рассчитать Ет.э., пользуясь приведенными выше уравнениями для различных типов реакций, либо определить этот потенциал экспериментально. Измерение потенциала Ет.э. проводят в стехиометрическом стандартном растворе, состав которого идентичен составу исследуемого раствора в точке эквивалентности, или в предварительно оттитрованном растворе. Зная Ет.э. индикаторного электрода и Еэ.с., находят э.д.с. электродной системы, и титруют испытуемый раствор до достижения этого значения э.д.с.
При использовании компенсационной схемы на потенциометре перед началом титрования устанавливают значение э.д.с., равное э.д.с. электродной системы в момент эквивалентности, и ведут титрование до отсутствия тока в цепи гальванометра. Поэтому такое титрование известно также под названием “титрование до нуля”. Оно может быть выполнено и в нескольких других вариантах, не требующих применения компенсационной схемы.
|
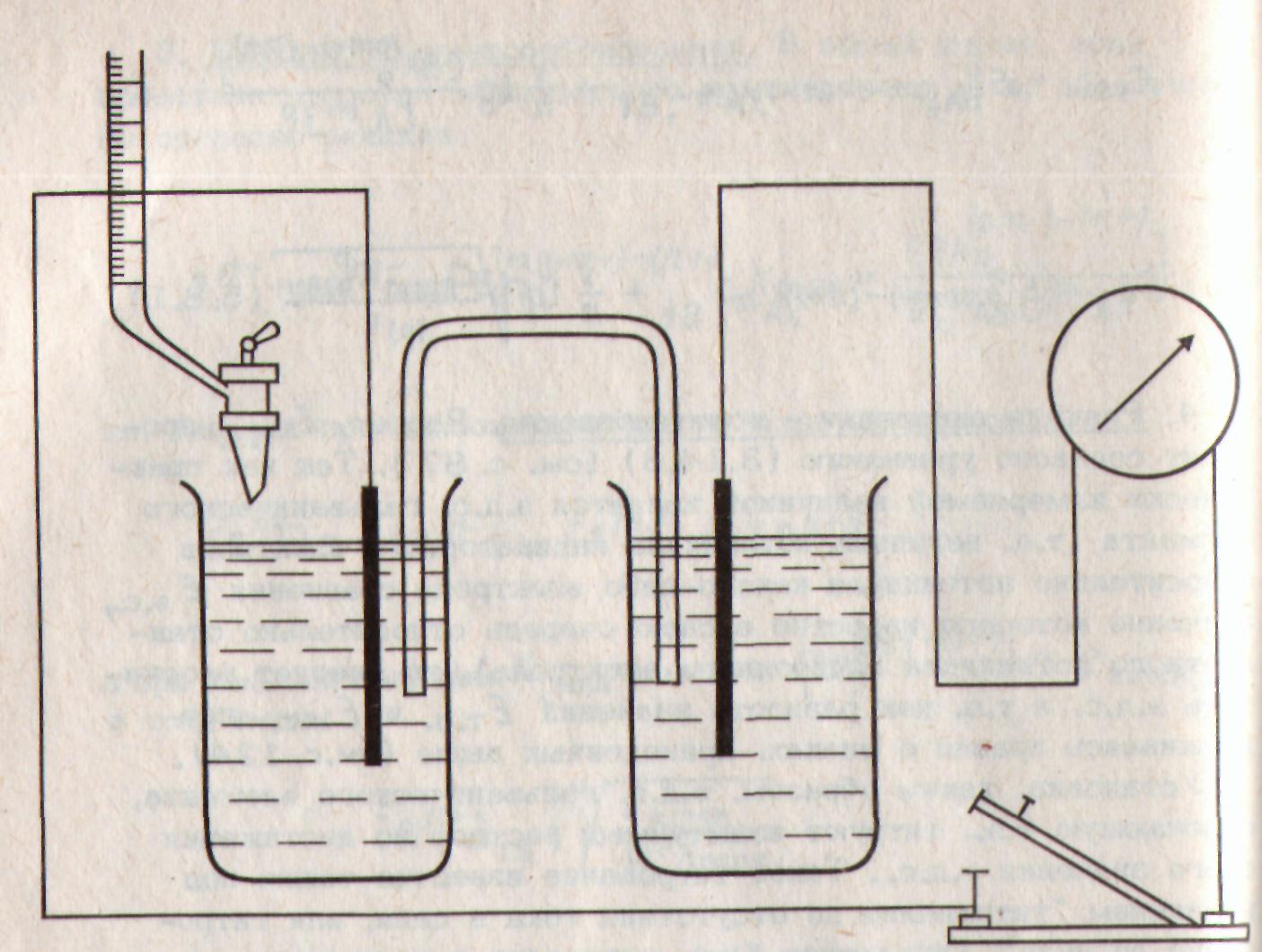
Титрование по методу Пинкгофа, Тредвела и Мюллера. Они применили л два одинаковых индикаторных электрода, один из которых погружен в испытуемый раствор, а другой в раствор, не отличающийся по составу от титруемого в к.т.т. или просто предварительно оттитрованную пробу. Электроды замкнуты через гальванометр (рис. 2). Титрование в этом некомпен-сационном методе ведут до отсутствия |
Рис. 4. Схема установки для титрования до потенциала т.э. |
тока или “броска” стрелки гальванометра Недостатком этого метода является |
существенная поляризация электродов в недотитрованных или перетитрованных растворах, что может привести к серьезным ошибкам.
Автоматизация титрования до заданного потенциала заключается в автоматическом отключении бюретки при достижении потенциала точки эквивалентности. При этом необходимо предотвратить возможность перехода за конечную точку. Поэтому в начале титрования титрант обычно подается с большой скоростью, затем после достижения заранее заданного потенциала скорость подачи титранта снижается и поддерживается постоянной вплоть до достижения конечной точки. В данном случае становятся важными как расположение электродов, так и перемешивание раствора, потому что изменение концентрации вблизи индикаторного электрода должно происходить точно так же, как и в основной массе раствора. Для проведения титрования описанным способом необходимо использовать электронную схему, которая сравнивает фактический потенциал электрода с заранее заданным и отключает бюретку в тот момент когда эти потенциалы сравняются.
Существенные преимущества имеет автоматизированный способ титрования до точки максимального наклона, т.к. в этом случае не обязательно знать точное значение потенциала электрода в конечной точке и не столь жестки требования к расположению индикаторного электрода. В этом методе отключение бюретки производится в тот момент, когда скорость изменения потенциала dE/dV достигает максимального значения.
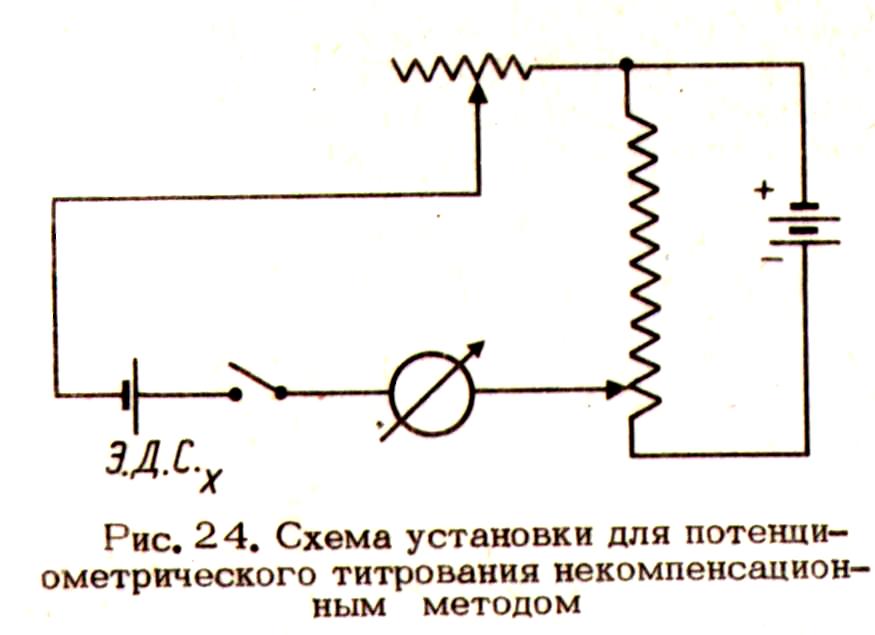
“Некомпенсационный” метод титрования Он основан на регистрации в процессе титрования силы тока в замкнутой цепи, приведенной на рис. 5.
|
Э.д.с. испытуемого гальванического элемента до начала титрования компенсируют равным налагаемым извне напряжением, при этом ток в цепи отсутствует. В ходе титрования вследствие изменения э.д.с. гальванического элемента в цепи возникает ток который измеряют миллиамперметром. Так как максимальное |
Рис. 5. Схема установки для потенциометрического титрования не- компенсационным методом |
изменение э.д.с. происходит в т.э., то в этот момент наблюдается максимальное возрастание тока. |
После т.э. ток в цепи меняется в меньшей степени, так как э.д.с. мало меняется при добавлении порций титранта. К.т.т. можно найти по зависимости I от V или I/V от V.
Титрование с биметаллической парой электродов. Метод основан на измерении разности потенциалов, которая возникает между двумя электродами из разных материалов, погруженными непосредственно в титруемый раствор. В этих случаях используется то обстоятельство, что при достижении в процессе титрования исчезающее малой концентрации (10-5 М) одной из сопряженных форм обратимой ред-окс пары или же в растворе необратимой ред-окс системы (т.е. при образовании смешанных предельных потенциалов) поведение подобных электродов различно.
В качестве таких электродов успешно могут быть использованы в ред-окс реакциях платина - углерод, платина - вольфрам, платина - родий, платина - палладий и др.
Если титруемое и титрующее вещества являются компонентами обратимых ред-окс систем, то изменение потенциала каждого электрода до т.э. одинаково, поэтому разность потенциалов Е между ними практически равна нулю. Как только концентрация титруемого вещества изменится настолько, что возникает смешанный потенциал, величина которого существенно зависит от материала электрода, между электродами создается большая разность потенциалов, указывающая на достижение конечной точки. После точки эквивалентности с появлением другой обратимой ред-окс системы, к которой принадлежит титрант, потенциалы электродов снова становятся практически равными. Ход титрования изображается дифференциальной кривой.
В том случае, когда титруемое вещество является компонентом обратимой ред-окс системы, а титрующее - необратимой, до к.т.т. картина аналогична описанной выше. Однако, после резкого скачка потенциала Е остается значительной.
Б 6. Кислотно-основное титрование. Нейтрализация сильной кислоты сильным основанием, изменение буферности системы, кривая титрования.
Кривые потенциометрического кислотно-основного титрования E = f(y) (где y - концентрация добавленного титранта) являются отображением изменения в ходе титрования рН раствора. Поэтому в качестве индикаторного электрода может быть выбран любой из рН-чувствительных электродов, потенциал которого зависит от концентрации ионов водорода. Чаще всего используют стеклянный электрод.
Для упрощения теоретического расчета кривых титрования обычно оперируют концентрациями, а не активностями ионов, т.е. допускают, что растворы разбавлены и коэффициенты активности можно принять равными 1, а pH= −lg[H+]. В этом случае уравнение потенциала индикаторного электрода можно записать в виде:
![]() (1)
(1)
Для всех водородных электродов эти уравнения будут отличаться только величиной Eo, поэтому полученные с помощью разных электродов кривые потенциометрического титрования будут идти симбатно.
Кроме того, при расчетах обычно пренебрегают разбавлением раствора в ходе титрования. При этих допущениях экспериментальные кривые не совпадают с теоретически рассчитанными. Однако возникающая при этом небольшая погрешность не имеет существенного значения при определении рН ктт.
Форма кривой и положение точки эквивалентности зависят от силы кислоты или основания. Для любой точки потенциометрической кривой потенциал электрода можно рассчитать по формулам для вычисления рН растворов соответствующих кислот и оснований. В случае кислот (оснований), которые полностью диссоциируют в растворе, необходимые данные можно получить сравнительно просто. Например, при титровании сильной кислоты сильным основанием, которое протекает согласно схеме
HA + BOH BA + H2O, (2)
кривую титрования pH=f(y) легко получить на основании принципа электронейтральности растворов, который для представленной схемы реакции имеет вид:
[H+] + [B+] = [A-] + [OH-]. (3)
Учитывая выражение ионного произведения воды Kw=[H+][OH-] и численное равенство концентрации введенного основания концентрации катионов металла при титровании кислоты, запишем
y = [B+] = [A-] − [H+] + Kw / [H+] . (4)
В ходе титрования сильной кислоты сильным основанием концентрация анионов будет оставаться постоянной (если пренебречь разбавлением раствора) и равной исходной концентрации кислоты Co. Решив квадратное уравнение
y = Co − [H+] + Kw / [H+] , (5)
получим выражение для расчета концентрации ионов водорода в ходе титрования
![]()
 .
(6)
.
(6)
По найденным значениям [H+] можно рассчитать величины pH и потенциал индикаторного электрода E при заданных значениях y, т.е. рассчитать кривую титрования. Для момента эквивалентности, когда y=C0
![]() ,
а pHy=Co = 7. (7)
,
а pHy=Co = 7. (7)
Чтобы оценить форму кривой нейтрализации и выбрать на ней характерную точку, отвечающую ктт, необходимо для уравнения (5) найти выражения первой производной dpH/dy (так называемая “податливость” системы), второй производной d2pH/dy2 и условия их равенства нулю.
На практике чаще пользуются величиной обратной “податливости”, которую называют “буферной емкостью” (или для краткости “буферностью”).
Р = dy/dpH = d[B+]/dpH . (8)
Дифференцировать уравнение (5) по pH для нахождения буферности нельзя. Учитывая, что
dpH = d(-lg[H+]) = -0,43(dln[H+]) = - d[H+] / 2,3[H+]. (9)
выражение для “буферности” можно получить, умножая уравнение (5) на −2,3[H+] и дифференцируя по [H+]:
![]() .
(10)
.
(10)
Из последнего соотношения следует, что буферность растворов сильных протолитов ни при каких значениях pH не может равняться нулю, поэтому кривая нейтрализации не имеет экстремума.
Чтобы выяснить имеет ли кривая титрования точку перегиба, необходимо выяснить, как ведет себя буферность с изменением pH, т.е. найти выражение производной dP/dpH. Дифференцируя уравнение (10) с учетом (9), получим
![]() .
(11)
.
(11)
Эта производная равна нулю, если (1- Kw/[H+]2)=0 или [H+]=(Kw)1/2=10-7 моль/л. При этом условии кривая P = f(pH) проходит через экстремум – минимум. Кривая титрования pH=f(y) проходит через точку перегиба, координаты которой отвечают условиям эквивалентности.
Задавая различные значения [H+] или pH растворов, содержащих только сильные электролиты, можно по уравнению (10) рассчитать значения буферности и построить диаграмму буферности P=f(pH).
|
|
Рис. Диаграмма буферности водных растворов сильных протолитов. |
Рис. Кривые титрования сильной кислоты различной концентрации сильным основанием |
Как видно, при добавлении щелочи к раствору сильной кислоты буферность сначала уменьшается, достигая минимального значения 4,6.10-7 при pH=7, затем снова возрастает, причем в широком интервале pH от 2,4 до 11,6 буферность имеет весьма низкое значение (менее 0,01). Согласно диаграмме буферности, кривая титрования pH=f(y) S-образной формы с быстрым изменением рН (скачком рН) в области 2,4 - 11,6 единиц и точкой перегиба с координатами pH=7 и y=C0. При уменьшении исходной концентрации анализируемой кислоты скачок становится более размытым, поэтому минимальные определяемые концентрации порядка 10-4 моль/л.
Нейтрализации смесей сильных кислот, полностью диссоциирующих в водной среде, отвечает та же диаграмма буферности и та же форма кривой титрования с одним скачком рН, регистрируя который можно определить лишь суммарное содержание кислот в растворе.