- •9. Загальні показники якості об’єктів довкілля
- •9.1. Застосування хімічних методів в аналізі об’єктів довкілля
- •9.2. Загальні якісні характеристики ґрунту
- •9.3. Загальні кількісні характеристики ґрунту
- •9.4. Загальні кількісні характеристики, спільні для ґрунтів та вод
- •9.5. Загальні кількісні характеристики якості вод
- •9.6. Загальні кількісні характеристики газів та повітря
- •9.7. Загальні кількісні характеристики рослинного зразка
- •Контрольні запитання
- •10. Огляд фізико-хімічних методів аналізу, які застосовують в контролі об’єктів довкілля
- •10.1. Оптичні методів в аналізі об’єктів довкілля
- •10.1.1. Застосування спектрофотометричного аналізу
- •10.1.2. Застосування методів полуменевої фотометрії та індуктивно-зв’язаної плазми в аналізі
- •10.2. Електрохімічні методи в аналізі об’єктів довкілля
- •10.2.1. Застосування кондуктометричного методу аналізу
- •10.2.2. Застосування кулонометричного методу аналізу
- •10.2.3. Застосування вольтамперометричних методів аналізу
- •10.2.4. Застосування потенціометричного методу аналізу
- •10.3. Застосування кінетичних методів в аналізі об’єктів довкілля
- •Контрольні запитання
- •11. Методи концентрування і розділення в аналізі об’єктів довкілля
- •11.1. Застосування фізичних методів розділення та концентрування
- •11.2. Застосування відгонки летких речовин
- •11.3. Застосування сорбції (твердофазової екстракції)
- •11.4. Застосування екстракції
- •11.5. Застосування осадження та співосадження
- •11.6. Застосування електровиділення металів та електрофорезу
- •Контрольні запитання
- •12. Застосування хроматографічних методів в аналізі об’єктів довкілля
- •12.1. Застосування методів рідинної хроматографії
- •12.2. Застосування методів тонкошарової та паперової хроматографії
- •12.3. Застосування методів газової хроматографії
- •Контрольні запитання
12. Застосування хроматографічних методів в аналізі об’єктів довкілля
Хроматографія – це метод розділення і аналізу суміші речовин, який ґрунтується на різному розподілі їх між двома незмішуваними фазами, рухомою і нерухомою (стаціонарною). Поряд із розділенням речовин цей метод застосовують для концентрування.
Речовини у суміші мігрують через стаціонарну фазу (сорбент), найчастіше поміщену в колонку, під впливом рухомої фази (елюента) і по-різному утримуються нерухомою фазою. Метод ґрунтується на різниці швидкостей міграції компонентів через нерухому фазу. З колонки речовини видаляються у послідовності, протилежній до здатності утримуватися. У виділеній з колонки рідкій фазі (елюаті) визначають вміст окремих компонентів хімічними та фізико-хімічними методами, леткі речовини аналізують методами газової хроматографії. Пристрій, з допомогою якого визначають концентрацію інгредієнта в елюаті, називають детектором. Різні види хроматографії наведені в табл. 12.1.
Таблиця 12.1. Головні види хроматографії
Вид хроматографії |
Фази |
Спосіб фіксації стаціонарної фази |
|
рухома |
стаціонарна |
||
Газо-рідинна |
Газ |
Рідина |
Рідина, сорбована на порис-тій твердій фазі у колонці |
Газо-твердофазова |
Газ |
Твердий сорбент |
Сорбент у колонці |
Адсорбційна |
Рідина |
Твердий сорбент |
Сорбент у колонці |
Розподільна |
Рідина |
Рідина |
Рідина, сорбована пористою твердою фазою у колонці |
Паперова |
Рідина |
Рідина |
Рідина затримується порами хроматографічного паперу |
Тонкошарова |
Рідина |
Рідина або твердий сорбент |
Тверда фаза або рідина, сорбована твердою фазою, нанесена на пластинку |
Гель-хроматографія |
Рідина |
Рідина |
Рідина затримується в порах гелю |
Іонообмінна |
Рідина |
Твердий іонообмінник |
Іонообмінна смола або цеоліт |
Хроматографічним методом вдається відокремити та ідентифікувати компоненти складної суміші, які іншими методами не можна розділити.
Під час хроматографічного розділення між рухомою та стаціонарною фазами встановлюється рівновага, яка при сталій температурі описується коефіцієнтом розподілу, який у випадку малих концентрацій є величиною постійною:
 ,
,
де С(А)ст. загальна концентрація речовини А в сорбенті;
С(А)р. концентрація розчиненої речовини в елюенті.
Швидкість проходження елюента через колонку характеризують проміжком між введенням речовини в колонку і появою хроматографічного піку (d). Проміжок d визначається або часом проходження елюентом колонки (часом утримування t) або об’ємом елюату, в якому ще виявлено інгредієнт (утримуваним об’ємом V) (рис.12.1). Константу розподілу можна виразити через параметри утримування:
 ,
де
,
де
 ,
,
або
 ,
для якої
,
для якої
 ,
,
де Vo – обєм розчинника; Vр. і Vст. – обєми рухомої та стаціонарної фаз; to – час проходження розчинника через колонку, tр. і tст. – час проходження через колонку рухомої і стаціонарної фаз
|
Рис.12.1. Ідеальний вигляд хроматографічного максимуму: W величина основи піку, d час появи елюатного піку на виході з колонки |
Важливим для виявлення певної речовини є індекс утримування (рис.12.2):
 або
або
 ,
,
де R індекс утримування або коефіцієнт сповільнення;
tо час проходження розчинника через колонку;
tХ час проходження через колонку максимума елюентного піку речовини Х.
|
Рис.12.2. Хроматограма суміші речовин X і Y; to – час появи піку розчинника, tХ, tY – час появи елюатних піків речовин X і Y |
Чим меншою є величина індекса утримування R, тим довше затримується розчинений інгредієнт на стаціонарній фазі, а чим більша різниця між індексами двох інгредієнтів, тим легше інгредієнти можна розділити і тим вища селективність колонки.
Ефективність хроматографічної колонки тим більша, чим довша колонка (L). Користуючись поняттями, які не мають фізичного змісту: числом теоретичних тарілок (N) та висотою теоретичної тарілки (Н), визначають ефективність розділення в колонці:
![]() .
.
Кількість теоретичних тарілок у хроматографічній колонці пов’язана з величиною основи піку (W) і часом появи елюентного піку на виході із колонки (d) (рис.12.1) залежністю:
![]() .
.
Крім того, ефективність колонки зі збільшенням швидкості руху рухомої фази зменшується.
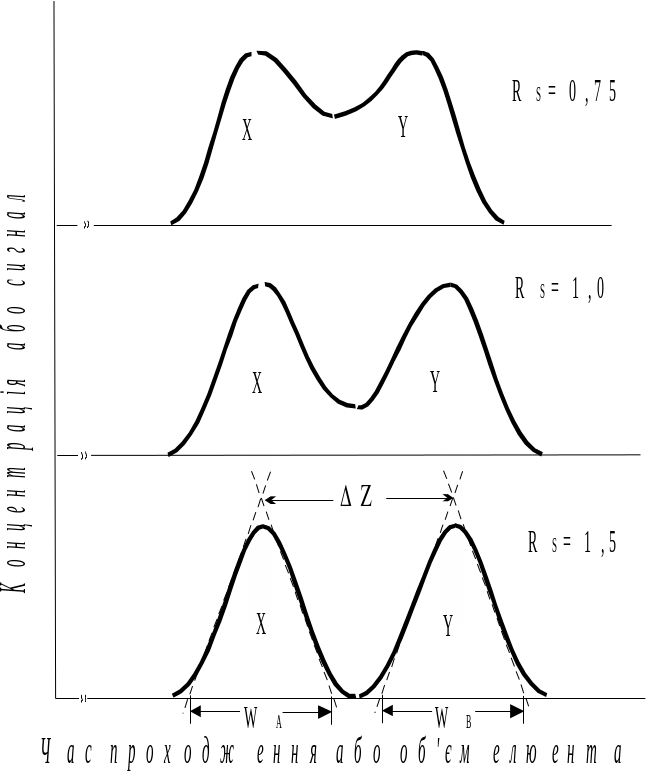
Селективність хроматографічного розділення обумовлена природою як рухомої фази, так і нерухомої. Кількісною характеристикою можливості розділення речовин X і Y є величина роздільної здатності колонки RS:
![]() ,
,
де RS роздільна здатність колонки; віддаль між максимумами на хроматограмі; W ширина основи максимуму.
Якщо роздільна здатність RS=1,0, то перекривання максимумів становить 2%, а при RS=1,5 перекривання всього 0,3% (рис.12.3).
Роздільна здатність колонки тим більша, чим довша колонка і чим більше відрізняються константи розподілу.
|
Рис.12.3. Роздільна здатність колонки при різному розташуванні хроматографічних максимумів (WA WB) |
Ідеальна форма елюентного піку нагадує криву нормального розподілу Гауса (рис.12.1). Реально на хроматограмах спостерігається розмивання піків. Це спричинене неоднорідним заповненням колонки стаціонарною фазою, зростанням швидкості руху рухомої фази, температурою системи, в’язкістю розчину.
Для розділення та концентрування речовин у рідкому середовищі використовують адсорбційну, розподільчу та іонообмінну хроматографію. Адсорбційна хроматографія передбачає розділення та концентрування речовин завдяки процесу сорбції на твердому сорбенті, розподільча – завдяки різному розподілу речовин між двома рідкими фазами у колонці. При іонообмінній хроматографії відділяються іонізовані речовини від решти рідини. Різновидом є паперова та тонкошарова хроматографія.
Для розділення речовин у газовій фазі застосовують методи газо-адсорбційної та газорідинної хроматографії. Цими методами найчастіше розділяють леткі органічні речовини, серед яких багато токсичних.