
- •9. Загальні показники якості об’єктів довкілля
- •9.1. Застосування хімічних методів в аналізі об’єктів довкілля
- •9.2. Загальні якісні характеристики ґрунту
- •9.3. Загальні кількісні характеристики ґрунту
- •9.4. Загальні кількісні характеристики, спільні для ґрунтів та вод
- •9.5. Загальні кількісні характеристики якості вод
- •9.6. Загальні кількісні характеристики газів та повітря
- •9.7. Загальні кількісні характеристики рослинного зразка
- •Контрольні запитання
- •10. Огляд фізико-хімічних методів аналізу, які застосовують в контролі об’єктів довкілля
- •10.1. Оптичні методів в аналізі об’єктів довкілля
- •10.1.1. Застосування спектрофотометричного аналізу
- •10.1.2. Застосування методів полуменевої фотометрії та індуктивно-зв’язаної плазми в аналізі
- •10.2. Електрохімічні методи в аналізі об’єктів довкілля
- •10.2.1. Застосування кондуктометричного методу аналізу
- •10.2.2. Застосування кулонометричного методу аналізу
- •10.2.3. Застосування вольтамперометричних методів аналізу
- •10.2.4. Застосування потенціометричного методу аналізу
- •10.3. Застосування кінетичних методів в аналізі об’єктів довкілля
- •Контрольні запитання
- •11. Методи концентрування і розділення в аналізі об’єктів довкілля
- •11.1. Застосування фізичних методів розділення та концентрування
- •11.2. Застосування відгонки летких речовин
- •11.3. Застосування сорбції (твердофазової екстракції)
- •11.4. Застосування екстракції
- •11.5. Застосування осадження та співосадження
- •11.6. Застосування електровиділення металів та електрофорезу
- •Контрольні запитання
- •12. Застосування хроматографічних методів в аналізі об’єктів довкілля
- •12.1. Застосування методів рідинної хроматографії
- •12.2. Застосування методів тонкошарової та паперової хроматографії
- •12.3. Застосування методів газової хроматографії
- •Контрольні запитання
11.5. Застосування осадження та співосадження
Розчинені речовини осаджують фізичними (нагрівання, охолодження) та хімічними методами, переводячи речовину у важкорозчинну.
Осадження неорганічними реагентами. Створюють такі концентраційні умови, за яких в осад випадає одна речовина, а всі решта залишаються у розчині. Інший спосіб – осадження всіх речовин, а залишається лише визначувана і ті, які не заважають визначенню.
Найчастіше реагентами є розчини гідрооксидів лужних металів, карбон дисульфід, амоній гідрогенфосфат. Якщо ці групові реагенти застосовувати послідовно, то можна кількісно розділити іони з розчину. Контролюючи рН розчину, можна розділити гідроксиди важких металів. Різна розчинність сульфідів важких металів дозволяє провести повне розділення всіх катіонів металів.
Осадження органічними реагентами можна представити схемою:
M2+ + 2HR MR + 2H+.
Утворюються внутрішньокомплексні сполуки малополярні, а отже, малорозчинні у воді. осади розчиняються дією кислоти, що дає можливість, регулюючи рН розчину, осаджувати той чи інший іон або групу іонів. Ці реагенти у водному розчині мають більшу селективність, осади достатньо чисті, майже всі вони мають кристалічну структуру і стехіометричний склад, добре фільтруються.
Найчастіше вживаними реагентами є:
купферон, який утворює сполуки з катіонами, менш розчинні за гідроксиди. Ним осаджуються у слабокислдому середовищі Ti(IV), Sn(IV), Sb(III), Fe3+; у близькому до нейтрального – Cu2+, Mo(VI), Bi(III).
Ще менш розчинні комплекси утворює неокупферон:
8-оксихінолін, яким при рН 4 осаджується Fe3+; при рН 4-5 – Al3+; в середовищах від слабокислого до слаболужного осаджуються комплекси з Bi(III), Cd2+, Co2+, Cu2+, Ni2+, Pb2+, Ca2+, Mg2+.
Диметилгліоксим утворює в аміачному середовищі важкорозчинний комплекс з Ni2+;
-бензоїлоксим утворює осад з сполуками Mo(VI), а також з Cu2+:

-бензоїлдіоксимом осаджують Ni2+.
Як осаджувач використовують антранілову кислоту, якою можна відділити Cd2+, Co2+, Cu2+, Hg2+, Mn2+, Ni2+, Pb2+, Zn2+:

Багатоатомні феноли, такі як пірогалол, пірокатехін осаджують сполуки Ti, Mo, Ві, Sb.
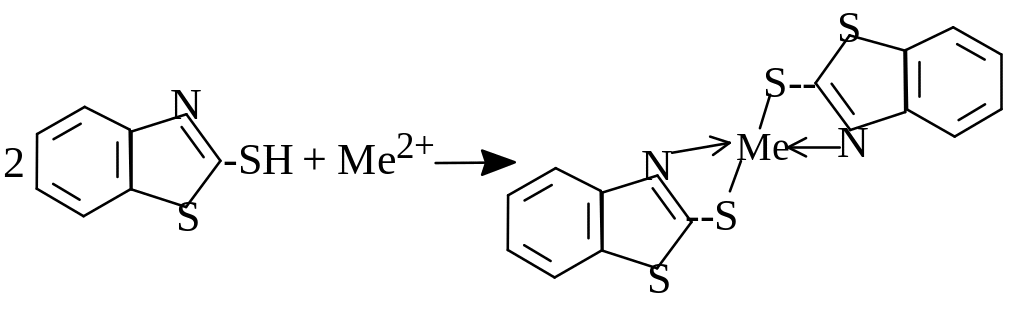
Меркаптобензтіазолом можна осадити Bi3+, Ag+, Cd2+, Cu2+, Pb2+.
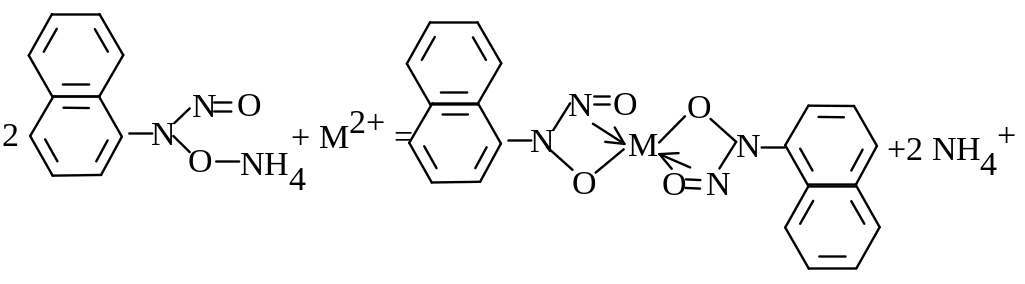
Велика група іонів осаджується дією -нітрозо--нафтолу, причому Fe3+ у формі MR3, а Co2+, Cu2+ у формі MR2:

Деякі інгредієнти в аніонній формі, наприклад, ClO4-, MnO4-, CdCl42-, SnCl62- можна осадити добре розчинним у воді хлоридом тетрафеніларсонію (C6H5)4AsCl:
(C6H5)4As+ + An- (C6H5)4AsAn.
Співосадження (осадження з колектором) використовують для концентрування мікроелементів при їх вмісті у рідкій пробі 10-6 г/л, при цьому коефіцієнт концентрування сягає 1000, а ступінь вилучення – 90%. Перевагою співосадження супроти екстракції є можливість концентрування з дуже великих об’ємів розчинів.
Як колектори використовують осади неорганічних речовин – гідроксидів, фосфатів, карбонатів, та органічних речовин, солетворних, які утворюють з осаджуваним іоном важкорозчинні сполуки, несолевих індиферентних, які захоплюють неполярні комплексні сполуки з органічними лігандами.
Неорганічні колектори – важкорозчинні сполуки, які здатні легко захоплювати мікроелементи з розчину. Колекторами часто є речовини, які утворюють аморфні пластуваті осади з великою поверхнею, на них легко адсорбуються мікроелементи. Це можуть бути кристалічні осади з дефектами кристалів. Є колектори високоселективні та малоселективні. Для підвищення селективності застосовують маскування деяких іонів. Вимогами до колекторів є: легкість відділення осаду від розчину; колектор не повинен заважати в наступних стадіях розділення та виявлення мікроелементів.
Механізми співосадження з різними колекторами різні. У момент осадження колектор має недосконалу кристалічну структуру або є аморфною речовиною. Важливо, щоб колектор кристалізувався повільно. У випадку кристалічного осаду утворюються тверді розчини колектора з іонами мікроелемента або відбувається оклюзія домішок у кристали; утворюються хімічні сполуки з осадом. У випадку аморфного осаду мікроелемент чи його сполука адсорбуються на поверхні осаду, хоча такий процес може відбуватися і на поверхні кристалічного осаду. На процес захоплення мікроелементів осадом колектора накладається старіння осаду, під час якого адсорбовані іони можуть або утворити з осадом сполуку чи твердий розчин, або, навпаки, десорбуватися з осаду. Від хімічної природи мікроелемента та колектора залежить, який механізм зв’язування речовини з ним. Домінуючим є процес іонного обміну.
Якщо осаджувач з мікроелементом утворює важкорозчинну сполуку, а колектор має дефектні кристали, то час контакту, температура, відмінності у величинах констант розчинності обох осадів суттєвого значення не мають. Утворена важкорозчинна сполука мікрокомпонента захоплюється осадом колектора, ефективність сягає 90-95%.
Якщо мікрокомпонент утворює з осаджувачем менш розчинну сполуку, ніж макрокомпонент, то мікрокомпонент легко переходить в осад з утворенням малорозчинної сполуки або заміщаючи іони металу в осаді макрокомпонента. Чим більша константа рівноваги цього процесу, тим меншу кількість макрокомпонента треба перевести в осад для осадження мікрокомпонента. Приклади застосування колекторів показані в табл.11.2.
Коли суміш складна і неможливо підібрати специфічний колектор, співосадження з різними колекторами, застосовують суміш колекторів. Осади після співосадження відділяють центрифугуванням, фільтруванням, промивають, висушують, а потім, після розчинення, аналізують. Щоб мікроелементи не осаджувались на стінках посуду, співосадження слід вести відразу після відбору проби, а саму пробу зберігати в поліетиленовому посуді.
Таблиця 11.2. Приклади співосадження мікроелементів з неорганічними та органічними колекторами
Колектор |
Мікроелементи |
Fе(ОН)3 |
As, Cd, Co, Cr, Cu, Ni, Pb, Se, Be, U, V, Mo, Th, Ga, Ті, Pu, P3M, Zn, Ru, Sr, Cs |
Fе(ОН)3+Ті(ОН)4 |
Zn |
А1(ОН)3 |
V |
Mg(OH)2 |
As, Cr, Pb, Sb, Cu, Ni, Zn, Co |
MnO(ОН)2 |
Fe, Mn, Sb, Bi (легкогідролізовані) |
Lа(ОН)3 |
Zr, Nb |
А1PО4, CaF2 |
Cd |
Са3(РО4)2 |
Zn, Co, U, Np, Cu, Pb, Zn, As |
А1PО4, CaC2O4 |
U |
SrCO3 |
Mo, Sb |
Змішаний: гідроксиди, карбонати, фосфати Са, Mg, Fe |
Ba, Be, As, Pb, Si, W, Co, Ni, V, Nb, Mo, Cd, Cu, Zn |
2-меркаптобензімідазол |
Se |
І-нітрозо-2-нафтол |
Au |
-бензоїлоксим |
U |
8-гідроксихінолін |
Mo, Ni |
8-гідроксихінолін+ тіонамід |
Cu, Fe, Mn, Al, Be, Bi, Cd, Co, Cr, Cu, Fe, Ga |
Діетилдитіокарбамат Na |
Cr, Cu, Eu, Fe, Hg, Mn, Ni, Zn, Cd, Cr, Cu, Fe, Mn, Pb, Sb, Ті |
Діетилдитіокарбамат діетиламонію |
Cd, Cr, Cu, Нg Ni, Pb |
Піролідиндитіокарбамат амонію |
As, Cd, Co, Cu, Fe, Ni, Pb, Zn |
Можливе як вибіркове, так і групове концентрування речовин.
Вибіркове співосадження іонів проходить на певних колекторах:
Cd2+ – на AlPO4 або CaF2;
Zr(IV), Nb(V) – на La(OH)3;
Sb(III),V), Bi(III) (легкогідролізовані) – на MnO(OH)2;
іони легковідновлюваних металів – на Hg, Tl.
Групове співосадження іонів проходить на гідроксидах та фосфатах кальцію, магнію, феруму. Серед колекторів найбільш ефективний Fе(ОН)3; велика група катіонів співосаджується на Ca3(PO4)2 – Zn2+, Co2+, U(VI), Np, Cu2+, Pb2+, As(III,V); особливо ефективні змішані колектори.
Розділення різних форм елементів можливе, коли в різних ступенях окиснення вони утворюють осади з різними властивостями.
Наприклад, колоїдну форму MnO(OH)2 співосаджують на Al(OH)3, а іони Mn2+ після відділення розчину співосаджують на Mg(OH)2.
Іони Cr3+, які здатні утворювати аморфний осад Cr(ОН)3, співосаджують на Fe(OH)3, а іони CrO42- та Cr2O72- – на осаді BaSO4, оскільки вони утворюють кристалічний осад BaCrO4.
Застосування органічних колекторів. Органічні колектори є більш селективними. Однак осади не відділяються центрифугуванням, а лише фільтруванням; іноді для виділення мікроелемента з колектора його необхідно обзолити при високій температурі, що може призвести до втрат летких мікроелементів. Практичними є індиферентні колектори.
Індиферентні (несолетворні) колектори – це малорозчинні у воді органічні речовини, які не містять функціональних груп, здатних взаємодіяти з іонами. Їх застосовуються для вибіркового концентрування одних елементів у присутності інших.
Якщо у водний розчин влити розчин індиферентного колектора в органічному розчиннику (спирті, кетоні), то утворюється суспензія або емульсія, яка захоплює з розчину малополярну сполуку мікроелемента. Такою сполукою може бути хелатний комплекс іона важкого металу з органічним реактивом, наприклад дитизонат металу. Отже, мікроелемент зв’язують у важкорозчинну у воді комплексну сполуку, а тоді співосаджують з колектором в органічному розчиннику. На утвореній суспензії (високоплавкий колектор – антрацен, 2,4 динітроанілін, фенолфталеїн) чи емульсії, яка твердне (низькоплавкий колектор – дифеніламін, 1,2,4-динітрохлорбензол, - чи -нафтол) співосаджується комплекс мікроелемента. Найчастіше застосовують ті самі комплексоутворювачі, які застосовують і для екстракційного відділення та концентрування, описані вище. Умови співосадження (рН, t) переважно співпадають з умовами одержання комплексної сполуки мікроелемента (табл. 11.1). Якщо комплекс органічного реагента з іоном є розчинним, то для співосадження додають важкий органічний іон, а лише тоді колектор в органічному розчиннику. Так, наприклад, для співосадження з водного розчину комплексу Co2+ з нітрозо-R-сіллю додають (C6H5)4As+, а лише потім дифеніламін у CCl4.
Спочатку створюють умови, за яких мікроелемент зв’язується у комплекс, додають комплексоутворювач. Після цього у розчин доливають невеликими порціями колектор в іншому органічному розчиннику, причому таку кількість, щоб концентрація органічного розчинника не перевищувала 2-5% у розчині. Після утворення осаду його відфільтровують та промивають. При такому способі співосадження можна сконцентрувати іони з дуже розведених розчинів, коли іншим способом їх сконцентрувати не вдається. Ефективність співосадження тим вища, чим менш розчинний колектор у водно-спиртовому чи водно-ацетоновому розчині. Одержані осади не здатні адсорбувати на своїй поверхні сторонні іони з розчину.
Колектори мають різні фізичні властивості, залежно від цього різною є процедура видалення речовини з колектора.
Основні групи колекторів показані в табл. 11.3.
Таблиця 11.3. Поширені індиферентні співосаджувачі
Тип співосаджувача |
Співосаджувач |
Легкоплавкі |
Салол, м-нітротолуол, тимол, -нафтол, -нафтол, дифеніламін, дифеніл, метиловий ефір, м-динітробензол, 1,2,4-динітрохлорбензол, фенантрен, 4-бром-2-нітротолуол |
Тугоплавкі |
Ацетофенон, м-нітроанілін, стільбен, антрацен, 2,4-динітроанілін, 4,4-дибромфеніл, 1,4-дифеніл-бутадієн-1,3, тимолфталеїн, фенолфталеїн |
Леткі |
Камфора, нафталін, п-дихлорбензол, п-нітротолуол |
Безбарвні |
-нафтол, м-нітроанілін, 2,4-динітроанілін, дифеніламін |
Легколеткий колектор, наприклад камфора, видаляють нагріванням осаду на водяній бані, а залишок містить комплекси мікроелементів.
Безбарвний колектор, наприклад 2,4-динітроанілін, розчиняють у відповідному розчиннику. Одержаний розчин можна аналізувати методом атомної абсорбції. Якщо комплекс з мікроелементом є забарвлений, то визначення завершують фотометрично.
Високоплавкий та легкоплавкий колектор, якщо він забарвлений, обзолюють термічно разом з комплексоутворювачем, прожарюючи осад при 450-550С. Якщо ж визначуваний мікроелемент при нагріванні інтенсивно випаровується, то обзолення проводять дією суміші концентрованих кислот.
Ефективність співосадження залежить від природи осаджуваної речовини і колектора (табл.11.4, 11.5), збільшується зі збільшенням маси колектора.
Для концентрування мікрокількостей іонів важких металів застосовують комплексоутворення з дитизоном, оксихіноліном, діетилдитіокарбаматом, меркаптохіноліном та ін. на різних колекторах.
Таблиця 11.4. Вплив хімічної природи реагентів та співосад-жувачів на повноту виділення іона (на прикладі комплексів Со2+)
Реагент |
Співосаджувач |
Ступінь вилучення, % |
-нітрозо--нафтолат Со |
-нафтол нафталін дифеніламін 2,4-динітроанілін фенолфталеїн |
86 87 96 99 89 |
8-оксихінолінат Со |
-нафтол нафталін дифеніламін 2,4-динітроанілін фенолфталеїн |
64 40 85 60 99 |
Більш ефективними для концентрування є евтектичні суміші двох колекторів, які мають нижчу температуру плавлення (табл.11.5).
Таблиця 11.5. Ефективність дії евтектичної суміші колекторів на співосадження (на прикладі 8-оксихінолінату Со)
Співосаджувач |
tплав., С |
Співосадження Со-оксихінолінату, % |
-нафтол |
96 |
87 |
-нафтол |
123 |
64 |
-нафтол+-нафтол |
73 |
97 |
Вибіркового співосадження можна досягти регулюванням кислотності середовища, а заважаючі іони доводиться маскувати. У розчинах, одержаних з природних об’єктів, маскують іони Ca2+, Mg2+, Fe3+, Al3+, Mn2+ додаванням тартратної або цитратної кислот, гідроксиламіну, ЕДТА. Вибіркове співосадження дитизонатів на 2,4-динітроаніліні проводять при різних рН: Cu2+ – при pH 0,5-1,0; Ni2+, Pb2+,Cd2+ – при pH 6,0; Co2+, Zn2+ – при рН 6,5-8.
Послідовне співосадження. Концентрування важких металів з розчинів природних об’єктів часто проводять співосадженням їхніх дитизонатів на 2,4-динітроаніліні в ацетоні. Межі рН існування дитизонатів катіонів при їх концентруванні екстракцією та співосадженням на 2,4-динітроаніліні не дуже відрізняються (табл.11.1). Використовуючи різну стійкість комплексів при різних значеннях рН, можна здійснити послідовне концентрування окремих важких металів.
Групове співосадження часто проводять із застосуванням дитизону, 8-оксихіноліну.
Дитизонати металів співосаджують на 2,4-динітроаніліні в декілька етапів: спочатку при рН 2,5 – дитизонати Sn2+, Cd2+, Cu2+,
при рН 6-7 – дитизонати Zn2+, Ni2+, Co2+, Pb2+, Cd2+.
Оксихінолінати Cu2+, Fe3+ Sn(IV), Mo(VI), W(VI), Ti(IV) співосаджуються при рН 3,5-4,5 на 2,4-динітроаніліні. Одержаний осад обзолюють.
Для групового співосадження важких металів використовують інші комплексоутворювачі, наприклад діетилдитіокарбамат Na при рН 6-7, та різні колектори.
Для збільшення числа іонів, які слід співосадити, комбінують різні комплексоутворювачі, наприклад, використовують суміш дитизону і -бензоїлоксиму. При цьому додатково співосаджуються Mo(VI), W(VI), V(V), Cr(VI).
Співосадження окремих іонів металів проводять з використанням специфічних реакцій.
Ni2+, Cu2+ з -фурилдіоксимом співосаджують на 2,4-динітроаніліні (в ацетоні) при рН 7,8-9,5. Одержаний осад хімічно обзолюють, залишок розчиняють. Перед визначенням тартратною кислотою зв’язують Fe3+, Al3+; нітрозо-R-сіллю зв’язують Co2+.
Co2+ з нітрозо-R-сіллю у присутності органічного катіона (тетрафеніламонію) співосаджують на фенолфталеїні або -нафтолі в ацетоні, після чого осад розчиняють у С2Н5ОН. Тартратною та оксалатною кислотою попередньо зв’язують Fe3+, Al3+, Cu2+, Ni2+,Cr3+.
Ag+ в ультрамалих кількостях у формі комплексу з о-фенантроліном співосаджують на фенолфталеїні чи 2,4-динітроаніліні в ацетоні при рН 4-8. Попередньо тартратною кислотою та ЕДТА зв’язують іони інших важких металів, які заважають.
Співосадження з флотацією. Співосадження можна комбінувати з флотацією. Для цього застосовують найбільш ефективні колектори. Серед неорганічних колекторів найкращі об’ємні осади – Fe(OH)3, Zr(OH)4, CdS, PbS. Якщо колектором є In(OH)3, то досягається групове концентрування навіть зв’язаних з гуміновими речовинами важких металів. Після цього осад флотують, пропускаючи у розчин через пористе дно бульбашки інертного газу (час барботування – від декількох секунд до декількох хвилин, об’єм проби – 250-3000 мл). З поверхні рідини відбирають утворений осад. Якщо осад гідрофільний, то додають поверхнево-активні іоногенні речовини з негативно зарядженою поверхнею. Таким методом вдається сконцентрувати речовини у 10-100 разів.
