
- •9. Загальні показники якості об’єктів довкілля
- •9.1. Застосування хімічних методів в аналізі об’єктів довкілля
- •9.2. Загальні якісні характеристики ґрунту
- •9.3. Загальні кількісні характеристики ґрунту
- •9.4. Загальні кількісні характеристики, спільні для ґрунтів та вод
- •9.5. Загальні кількісні характеристики якості вод
- •9.6. Загальні кількісні характеристики газів та повітря
- •9.7. Загальні кількісні характеристики рослинного зразка
- •Контрольні запитання
- •10. Огляд фізико-хімічних методів аналізу, які застосовують в контролі об’єктів довкілля
- •10.1. Оптичні методів в аналізі об’єктів довкілля
- •10.1.1. Застосування спектрофотометричного аналізу
- •10.1.2. Застосування методів полуменевої фотометрії та індуктивно-зв’язаної плазми в аналізі
- •10.2. Електрохімічні методи в аналізі об’єктів довкілля
- •10.2.1. Застосування кондуктометричного методу аналізу
- •10.2.2. Застосування кулонометричного методу аналізу
- •10.2.3. Застосування вольтамперометричних методів аналізу
- •10.2.4. Застосування потенціометричного методу аналізу
- •10.3. Застосування кінетичних методів в аналізі об’єктів довкілля
- •Контрольні запитання
- •11. Методи концентрування і розділення в аналізі об’єктів довкілля
- •11.1. Застосування фізичних методів розділення та концентрування
- •11.2. Застосування відгонки летких речовин
- •11.3. Застосування сорбції (твердофазової екстракції)
- •11.4. Застосування екстракції
- •11.5. Застосування осадження та співосадження
- •11.6. Застосування електровиділення металів та електрофорезу
- •Контрольні запитання
- •12. Застосування хроматографічних методів в аналізі об’єктів довкілля
- •12.1. Застосування методів рідинної хроматографії
- •12.2. Застосування методів тонкошарової та паперової хроматографії
- •12.3. Застосування методів газової хроматографії
- •Контрольні запитання
10.3. Застосування кінетичних методів в аналізі об’єктів довкілля
Кінетичні методи аналізу – одні з найбільш чутливих. У цих методах застосовують хімічну взаємодію за участю каталізатора. Хімічна реакція, яка відбувається, вважається індикаторною, а одна із речовин, фізико-хімічні параметри якої визначають – індикаторна. Швидкість індикаторної реакції залежить від концентрації визначуваної речовини. Нехай відбувається взаємодія:
A+BP+Q.
Механізм дії каталізатора можна представити такими схемами:
1) A+K AK, AK+B P+Q+K. |
2) A+K P+K*, K*+B Q+K, де К – каталізатор. |
Як індикаторні, використовують реакції, при яких відбувається утворення або руйнування забарвленої сполуки, для якої вимірюють оптичну густину, використовують також люмінесцентні реакції.
До індикаторної реакції ставлять низку вимог.
Швидкість індикаторної реакції повинна бути такою, щоб за 5-15 хв зробити заміри (не дуже швидка і не дуже повільна).
Концентрація індикаторної речовини повинна визначатись швидко і просто.
Концентрація визначуваної речовини протягом всього експерименту повинна залишатись постійною. Цього можна досягти, якщо визначувана речовина: є каталізатором або інгібітором; не є каталізатором, тоді її беруть у великому надлишку в порівнянні з індикаторною. Однак останні системи застосовують рідко.
Механізм дії каталізатора реакцій обох типів описується різними кінетичними рівняннями, але швидкість гомогенно-каталітичної реакції залежить від концентрації каталізатора і концентрацій усіх реагуючих речовин, швидкість індикаторної реакції підкоряється найпростішим закономірностям, якщо реакція необоротна. Вираз швидкості гомогенно-каталітичної реакції такий:
![]() ,
Ci>>Ckat
,
Ci>>Ckat
де – константа швидкості каталітичної реакції; Сkat. – концентрація каталізатора; Д(Сі) – стехіометричний добуток концентрацій взаємодіючих речовин.
У каталітичній реакції концентрації компонентів індикаторної реакції є значно вищими, ніж каталізатора, а швидкість реакції визначають за такий малий проміжок часу (), щоб концентрації всіх компонентів не змінились: – малий; Сі const, тоді iДСі = k' const.
Чутливість каталітичної реакції залежить від величини константи швидкості каталітичної реакції та експериментальної можливості визначення приросту концентрації. Регламентованими концентраціями реагуючої системи є 1-0,1 моль/л і час проходження реакції 10 хв. Якщо припустити, що 106-108, концентрацію каталізатора (x) визначають з точністю до 10-6-10-7 моль/л, добуток концентрацій реагуючих речовин Д(Сі)0,1, час проходження реакції є в межах 10 хв, тоді чутливість визначення має величину:
![]() .
.
Теоретично чутливість методу є в межах 10-12-10-16 моль/л. Реально на чутливість впливає співвідношення коефіцієнтів реакції та каталітичної реакції (k/), наявність фонових електролітів () та коливання температури. Чим це співвідношення більше, тим чутливість визначення менша.
Вплив температури на швидкість реакції є значним:
![]() .
.
Чим менша енергія активації реакції, тим меншим є вплив температури на її перебіг. Якщо енергія активації велика, то проводити реакцію та вимірювати фізичні параметри слід у термостатованих умовах.
Реальну чутливість (Cmin) обчислюють за залежністю:
![]() ,
,
і звідси чутливість визначення є в межах 10-9-10-10 моль/л (10-4-10-5 мкг/л).
Умовами виконання реакцій є: стала температура; стала іонна сила розчину, оскільки сторонні електроліти можуть як прискорити, так і уповільнити перебіг реакції.
Якщо аналізують природну воду, то її особливість полягає у значному сольовому фоні. Тому вимірювання концентрації проводять методом добавок або за градуйованим графіком.
На перебіг каталітичної реакції впливають активатори і інгібітори реакції. Активатори різко прискорюють каталітичну реакцію, підвищуючи її чутливість. Інгібітори сповільнюють каталітичну реакцію через утворення з каталізатором неактивної сполуки. У природних об’єктах сповільнення реакції може бути спричинене утворенням комплексів з іонами металів, які переважно виступають у ролі каталізаторів індикаторної реакції. Інгібіторами є також органічні речовини, на чому ґрунтується їх визначення.
Специфічність кінетичних методів аналізу в тому, що індика-торні реакції каталізуються специфічними каталізаторами. На цей процес впливає рН розчину, комплексоутворення іонів металів. Однак комплексоутворення застосовують і для маскування заважаючих іонів.
У кінетичних методах аналізу використовують декілька основних груп реакцій, приклади визначень за якими наведені в табл. 10.5.
Реакції окиснення неорганічних та органічних речовин дією Н2О2 і О2, в яких каталізаторами є іони важких металів. Цими методами найчастіше визначають іони металів.
Так в реакції окиснення алізарину дією H2O2 каталізатором є Со2+ (чутливість визначення кобальту 0,1 мкг/л), а окиснення люмінолу дією Н2О2 – Cr3+, Cr(VI) (чутливість 2,510-2 мкг/л).
За реакціями цього типу можна визначати органічні речовини, оскільки вони є інгібіторами каталітичного процесу.
Реакції окиснення речовин аніонами (ClO3-, BrO3-, JO3-, ClO4-, JO4-), каталізаторами в яких є важкі метали. Так визначають важкі метали та галогенід-іони.
Під час окиснення -нафтіламіну дією BrO3- каталізатором є Mo(VІ) (чутливість 0,2-0,6 мкг/л).
Реакції окиснення і відновлення іонами металу. Так визначають галогенід-іони і Ме як каталізатори.
Наприклад, при визначенні Hg2+ він виступає у ролі інгібітора взаємодії As(III) з Ce(IV) у присутності J-. Після окиснення арсеніту утворений арсенат вступає у взаємодію з йодидом і виділяється J2 (індикаторна реакція).
Відбувається взаємодія:
AsO2-+2Ce(IV)+2H2O![]() AsO43-+2Ce3++4H+,
AsO43-+2Ce3++4H+,
В індикаторній реакції виділяється J2:
AsO43- + 2J-+ 4H+ AsO2- + J2 + 2Н2О.
Йод з крохмалем дає продукт синього забарвлення, який визначають фотометрично. За цією ж реакцією можна визначати J-.
Заважають визначенню окисники, відновники (їх видаляють обзоленням випареного залишку води дією H2SO4 i HCl); заважає 200–500-кратний надлишок іонів Cr3+, Br-, Ni2+, Co2+, Fe2+, Zn2+, Ag+, J-.
Висока чутливість методу дозволяє визначати вміст мікроелементів у воді без концентрування. Однак кінетичним методом можна визначати концентрацію незакомплексованих іонів. Тому перед виконанням аналізу обов’язково руйнують органічні комплекси металів хімічним або термічним обзоленням.
Таблиця 10.5. Приклади визначень інгредієнтів у воді кінетичними методами
Чутливість, мкг/л |
Визначуваний елемент |
Індикаторна реакція |
Іони, які перешкоджають |
210-2 |
J- |
Ce(IV) + As(III) |
Os(VIІІ), Re(VІІ), Hg2+, Ag+, Pb2+, Fe2+ |
2,510-2 |
Cr (III,VI) |
Люмінол + Н2О2 |
Co2+, Fe2+, Sn2+ |
410-2 |
Co2+ |
Алізарин + Н2О2 |
Ni2+, Cu2+, Fe2+ |
210-2 |
Тайрон + Н2О2 |
Ti(IV), Fe2+ |
|
0,1 |
Mn2+ |
Діетиланілін + JO4- |
Fe3+ |
Cu2+ |
Ортоамінофенол+О2 |
Co2+, Mn2+, V(V), Fe3+, Cr3+ |
|
0,2-0,6 |
Cu2+,Cr3+,Co2+ |
Люмінол(CN)+H2О2 |
Важкі метали |
Mo(VI) |
-Нафтіламін+ВrO3- |
||
Cu2+ |
Люмінол + CN- |
||
Mn2+ |
Люмінол + Н2О2 |
Важкі метали, Fe3+ |
|
1,0-50,0 |
Cr3+ |
Te(IV) + Ce(IV) |
J-, JO4-, Mn2+, Fe2+ |
Hg2+ |
As(III) + Ce(IV) |
Окисники, відновники, J-, Сr3+, Ni2+, Co2+, Fe2+, Zn2+, Аg+ |
Способи визначення концентрації в кінетичних методах аналізу
Концентрація одного з учасників індикаторної реакції змінюється, а концентрація інших не змінюється або змінюється мало, Ci>>Ckat, і Д(Сі)=kconst.
З виразу швидкості реакції одержують диференційний вираз кінетичного рівняння
Сх= k Скат.,
де Сх – поточна концентрація речовини А або продукту Р, моль/л;
- час взаємодії, с.
Вимірюють зміну фізичного параметра індикаторної речовини (П(Р)), наприклад, оптичну густину протягом перебігу реакції (), постійно збільшуючи концентрацію каталізатора (Сі). За цими даними будують графічну залежність П(Р)=f().
Метод тангенсів. З графіка залежності П(Р)=f() за кутом нахилу прямих () будують градуйований графік tg=f(Ckat.). Метод не застосовують у випадку хемілюмінесцентних реакцій, оскільки залежність інтенсивності світіння від часу не є прямолінійною.
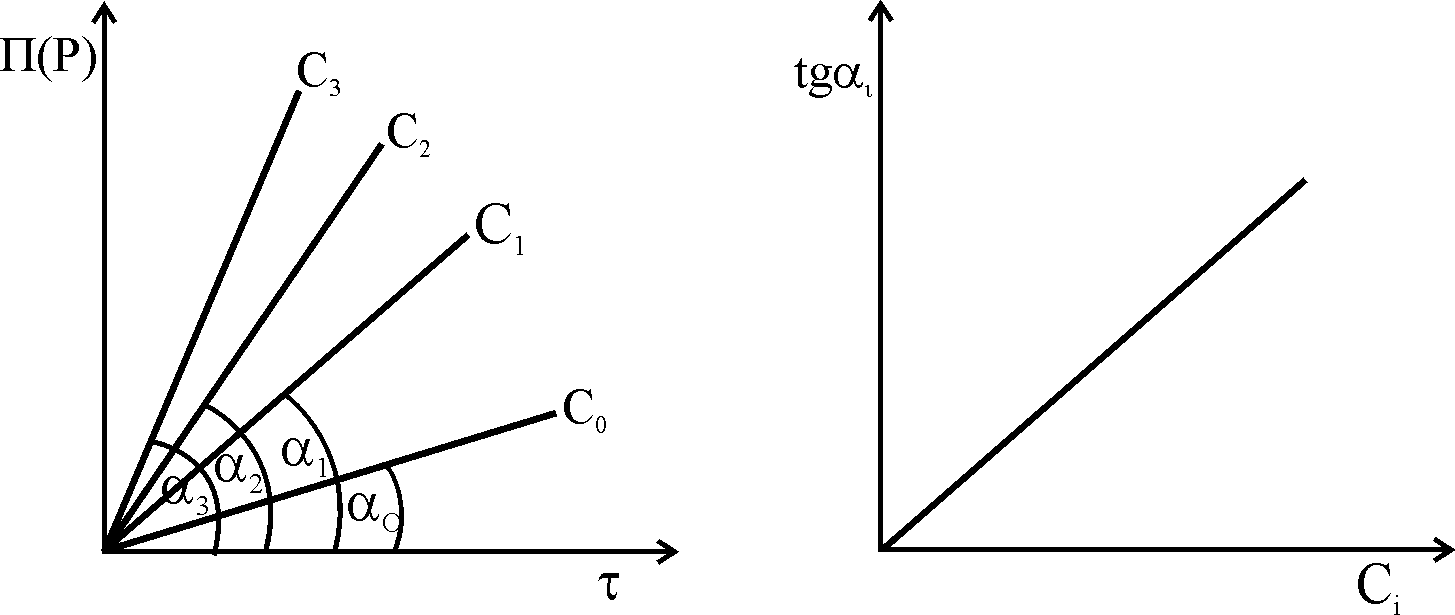
Метод фіксованого часу. Фіксують глибину протікання реакції (за індикаторною речовиною) при різних вмістах каталізатора через однаковий проміжок часу 0. Будують градуйований графік залежності П(Р)о=f(Ckat):
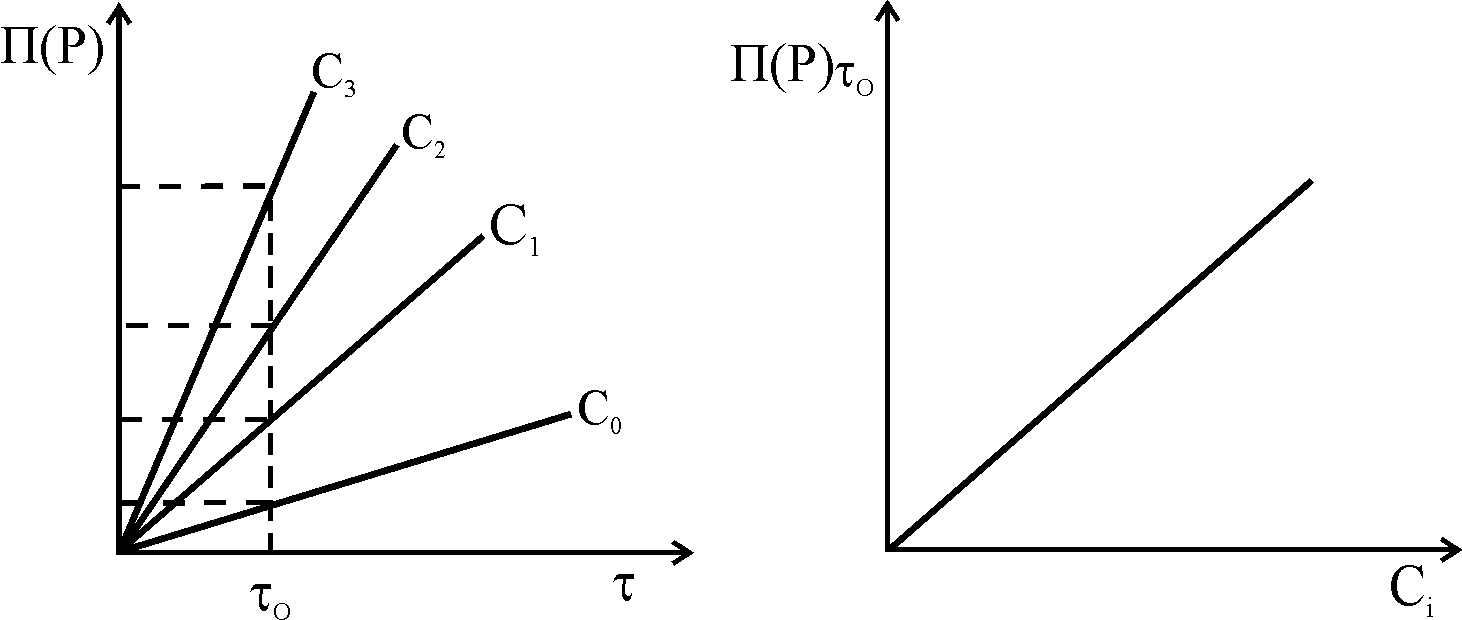
Метод фіксованої концентрації.. Із залежності П(Р)=f() визначають час, протягом якого при різних концентраціях каталізатора буде досягнута однакова глибина проходження реакції – однакова величина ефекту (за індикаторною речовиною Х). Будують графік залежності 1/ = f(Ckat.).
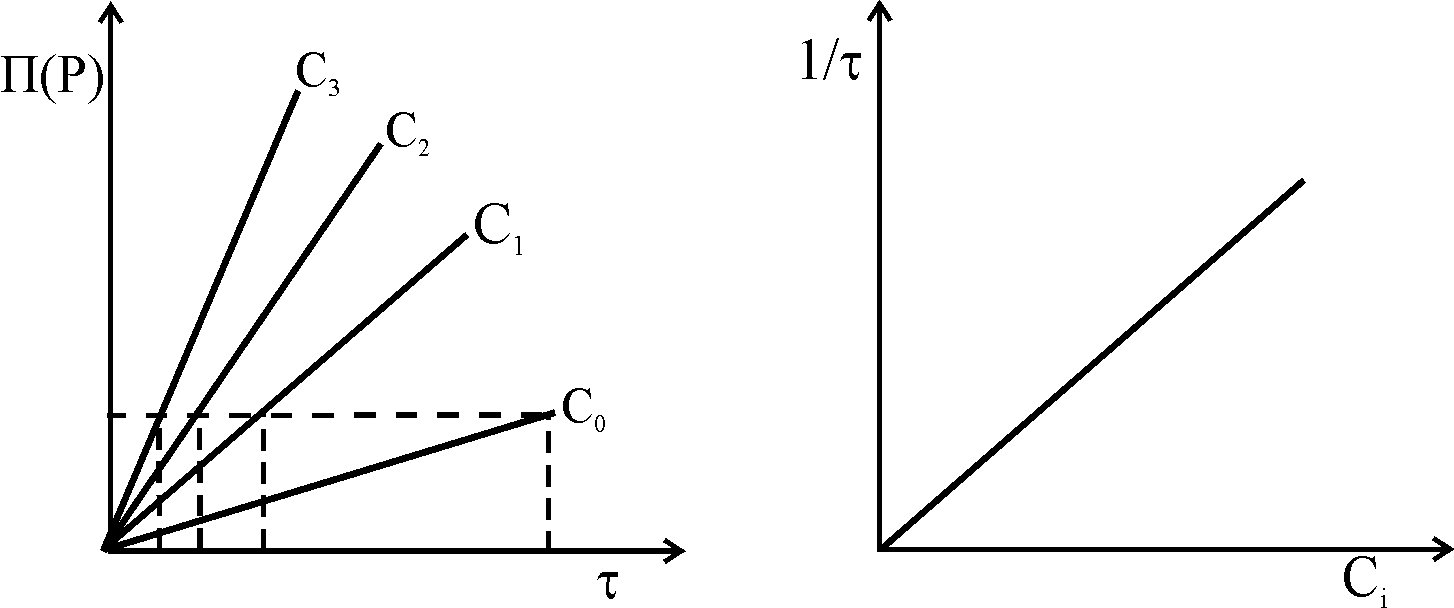
Метод добавок – швидкість індикаторної реакції фіксують у розчині взаємодіючої речовини і в розчині речовини з її добавкою.
