- •13. Короткий огляд методів аналізу токсичних та деяких інших речовин
- •13.1. Визначення токсичних неорганічних речовин у водах, ґрунтах, продуктах
- •13.2. Визначення токсичних та деяких інших органічних речовин у водах, ґрунтах, продуктах
- •13.3. Визначення токсичних речовин у повітрі
- •Контрольні запитання
- •14. Автоматизовані методи аналізу довкілля
- •14.1. Підготовка проби перед аналізом
- •14.2. Застосування електрохімічних методів в автоматизованому аналізі об’єктів довкілля
- •14.3. Застосування оптичних методів в автоматизованому аналізі об’єктів довкілля
- •14.4. Застосування методів газової хроматографії в автоматичному аналізі об’єктів довкілля
- •14.5. Застосування високоефективної рідинної хроматографії в автоматичному аналізі об’єктів довкілля
- •14.6. Приклади визначення деяких органічних речовин автоматизованими хроматографічними методами
- •Контрольні запитання
- •15. Тест-методи та автоматичний контроль об’єктів довкілля
- •15.1. Застосування тест-методів в аналізі ґрунтів та вод
- •15.2. Застосування експресних методів в аналізі забруднень повітря
- •15.3. Автоматичний контроль стану повітря
- •Контрольні запитання
13. Короткий огляд методів аналізу токсичних та деяких інших речовин
Навколишнє середовище найбільше забруднюють сполуки важких металів та деяких особливо небезпечних неметалів, величезна кількість органічних речовин, зокрема пестициди, нафтопродукти, ароматичні сполуки, хлорпохідні вуглеводнів, синтетичні поверхнево-активні речовини, феноли.
13.1. Визначення токсичних неорганічних речовин у водах, ґрунтах, продуктах
Визначення меркурію. Величина ГДК для сполук меркурію в об’єктах довкілля дуже мале, тому для аналізу необхідно застосовувати дуже чутливі методи.
У воді або у ґрунтовій витяжці спочатку руйнують комплекси органічних речовин хімічним методом, на питні води діють ультрафіолетовим випромінюванням. Оскільки сполуки меркурію можуть бути в різних ступенях окиснення та утворювати зв’язки з органічними радикалами, то для визначення загального вмісту усі форми сполук меркурію окиснюють у найвищу ступінь окиснення. У випадку питних вод з невеликою кількістю органічних речовин діють бромом, надлишок якого відновлюють гідроксиламіном. При аналізі промислових стічних вод, вод для господарського використання застосовують KMnO4 i К2S2O8.
Безполуменеве атомно-абсорбційне визначення ртуті методом холодної пари описане в розділі 10.2, а відновлення окремо неорганічних сполук меркурію та сполук з органічними радикалами у розділі 11.2.
Екстракційно-титриметрично визначення. У слабокислому розчині зв’язують всі іони металів з ЕДТА. Розчин титрують дитизоном у CCl4. Утворюється жовто-оранжевий комплекс [Hg(HDt)2], а після досягнення точки еквівалентності, коли з’являється надлишок дитизону, колір переходить у зелений. Якщо вміст Hg2+ дуже малий, то розчин підлужнюють і концентрують випаровуванням. Заважають визначенню відновники: S2-, J-, CN-, S2O32-, SCN-, Cl-. Їх видаляють випаровуванням з підкисленого H2SO4 розчину. Чутливість визначення меркурію становить 8 мг/л.
Hg2+
визначають фотометрично
з дитизоном
у формі жовто-оранжевого комплексу,
який екстрагують хлороформом у кислому
середовищі,
![]() =70×103.
В цих умовах найбільше заважають іони
Cu2+
та Ag+,
які маскують додаванням у розчин ціаніду
та ЕДТА.
=70×103.
В цих умовах найбільше заважають іони
Cu2+
та Ag+,
які маскують додаванням у розчин ціаніду
та ЕДТА.
Визначення хрому. Високочутливим (0,02 мкг/мл) є фотометричне визначення хрому (VI).
Cr2O72- окиснює діетидитіокарбазид у діетилдитіокарбазон фіолетового кольору,
 =34,6×103:
=34,6×103:
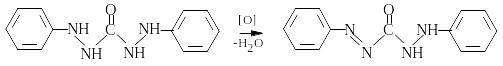
Для забезпечення повноти проходження реакції використовують півтори-, дворазовий надлишок реагента.
Солі Cr3+ окиснюють у дихромат дією (NH4)2S2O8 у розчині H2SO4 при нагріванні. Тоді визначають загальний вміст хрому і за різницею двох визначень вираховують вміст Cr(ІІІ).
Cr2O72- визначають фотометрично з п-аміноацетофеноном і цитразиновою кислотою у присутності гідроксиламіну при рН 3,5-4,5.
Спочатку відбувається окиснення гідроксиламіну:
2Cr2O72- + 3NH2OH + 13H+ 4Cr3+ + 3NO2- + 11H2O.
Утворений нітрит вступає у реакцію діазотування з п-ацетофеноном, а потім у реакцію сполучення з цитразиновою кислотою:
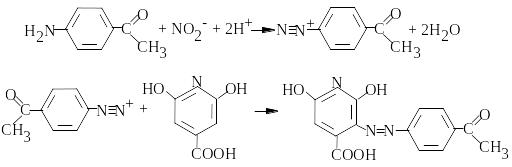
Вимірюють
оптичну густину розчину при =470
нм,
![]() =2,12104.
Заважають визначенню сполуки Fe3+,
Cu2+,
Co2+.
=2,12104.
Заважають визначенню сполуки Fe3+,
Cu2+,
Co2+.
Сr3+ можна визначати фотометрично з ЕДТА у кислому середовищі при рН 1,4-1,5. При нагріванні утворюється комплекс [CrY]- фіолетового кольору, причому інші іони визначенню не заважають. Іншими реагентами є
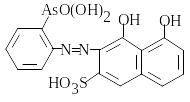
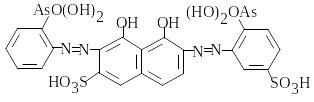
арсеназо І, |
арсеназо ІІІ, |
торон, |
|
|
|
карбоксиарсеназо C23H17AsN4O13S2, причому взаємодія відбувається при нагріванні протягом 15-30 хв. Утворюються продукти оранжево-червоного кольору. Вимірюють оптичну густину комплексів Сr3+ з арсеназо І і тороном при =540 нм, інших – при =600 нм.
Сr3+ при нагріванні 60 хв при рН 4,2 з хромазуролом S у формі H2R2-
утворює комплекс червоно-фіолетового кольору. Після охолодження додають 1М HCl до рН 3,5 і вимірюють оптичну густину при =565 нм, межі визначуваних концентрацій – 0,4-0,04 мкг/мл. Однак, через високу стійкість аквакомплексів хрому реакцію доводиться активувати нагріванням, ультрафіолетовим опромінюванням Визначенню заважають більшість важких металів, тому Cr3+ бажано попередньо екстрагувати. Заважає визначенню і 10-кратний надлишок Cr2O72-, тому для вимірюванням оптичної густини до стандартних розчинів додають біхромат.
Загальний вміст хрому визначають атомно-абсорбційно у високотемпературному полум'ї N2O+C2H2 при l=357,9 нм. Метод застосовують для аналізу стічних вод при вмісті Сг 0,5–20 мкг/мл. Якщо концентрація менша за 0,5 мкг/мл, пробу попереднього концентрують. При вмісті хрому, меншому за 0,1 мкг/мл, необхідно застосовувати електротермічну атомізацію проби. У цьому випадку область визначуваних концентрацій понижується до 5-100 мкг/л.
Визначення берилію. Цей надзвичайно токсичний елемент потрапляє у довкілля з промисловими стоками. Пробу води зберігають у поліетиленовому посуді в холодильнику не більше ніж 72 год. Пробу води консервують додаванням розчину HCl.
Ве2+ визначають фотометрично з берилоном ІІІ або алюміноном.
Берилон ІІІ (оранжево-коричневого кольору) в нейтральному та слаболужному середовищі утворює розчинний у воді комплекс малинового кольору,
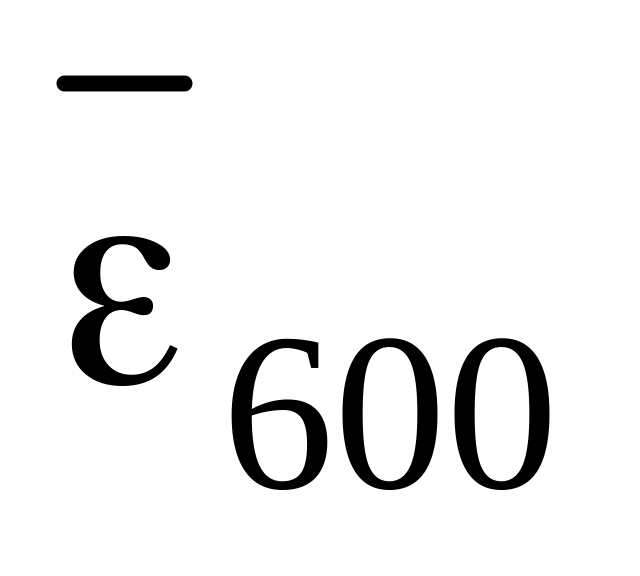 =4×103.
=4×103.
Селективність підвищується при рН 13 у присутності ЕДТА та триетаноламіну (катіони інших металів утворюють гідроксиди або зв’язуються в комплекси). Не заважають визначенню інші амфотерні метали, Ті(IV) завищує результат визначення на 6%.
Алюмінон утворює з іонами берилію лак червоного кольору, який є у формі колоїдного розчину, стабілізованого желатином,
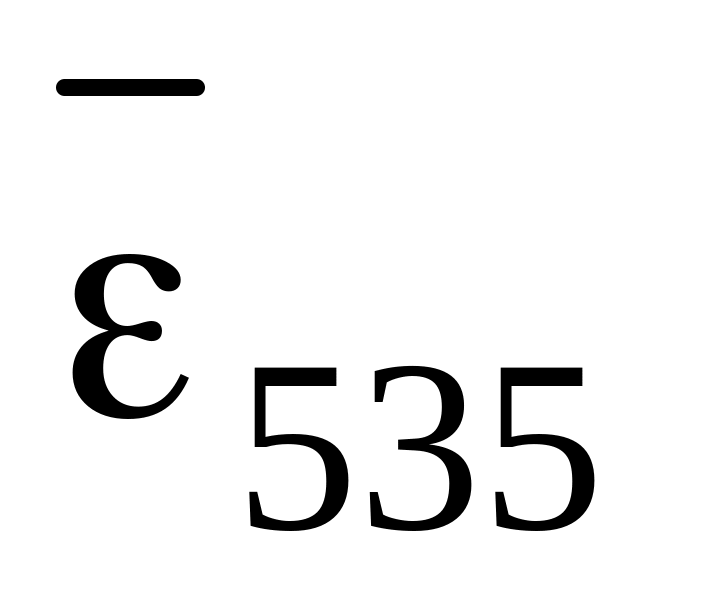 =2,2×103.
За наявності ЕДТА визначенню не заважають
іони важких металів.
=2,2×103.
За наявності ЕДТА визначенню не заважають
іони важких металів.Атомно-абсорбційно Ве визначають при неполуменевій атомізації у графітовій кюветі у межах концентрацій – 0,2-40,0 мкг/л. Вплив макроелементів усувають, виконуючи аналіз методом добавок.
Флуориметричний метод ґрунтується на взаємодії солей берилію з морином у лужному середовищі з утворенням сполуки, яка флуоресціює при l=365 нм. Визначувані концентрації 5-100 мкг/л.
Визначення ціанідів. Ціаніди є надзвичайно токсичними, навіть зв’язані у ціанідні комплекси. Малотоксичні лише гексаціаноферати та гаксаціанокобальтати. Солі ціанідної кислоти легко піддаються гідролізу у воді, а при доступі СО2 розкладаются:
KCN + H2O + CO2 HCN + KHCO3,
KCN + 2H2O HCOOK + NH3.
Розкладається також сама кислота:
НCN + 2H2O HCOONH4.
Виявити ціаніди можна за реакцією утворення гексаціаноферату (ІІ). Для цього до розчину додають ферум (ІІ) сульфат, луг, а потім ферум(ІІІ) хлорид:
2NaCN + FeSO4 Fe(CN)2 + Na2SO4,
Fe(CN)2 + 2NaCN Na4[Fe(CN)6],
3Na4[Fe(CN)6] + 4FeCl3 Fe4[Fe(CN)6] + 12NaCl.
Інший спосіб виявлення – за реакцією з пікриновою кислотою в лужному середовищі при нагріванні, під час якої утворюється сіль ізопурпурної кислоти червоного кольору:

Подібне забарвлення з пікриновою кислотою дають також альдегіди, ацетон, сульфіти і ін.
Якщо аналізують стічну воду, то пробу консервують додаванням лугу до рН>11. Вміст ціанідів у водах дуже малий, тому їх попередньо концентрують відгонкою леткого HCN, утвореного додаванням 0,1 М HCl, який вловлюють розчином лугу. Нетоксичні ціанідні комплекси утримуються в розчині. Якщо в розчині є сполуки феруму, то до розчину додають сіль цинку, щоб утворились стійкі недисоційовані сполуки з гексаціанофератами. Якщо крім того є комплекс, що містить Cu(І), його окиснюють дихроматом у малостійкий комплекс Cu(ІІ).
У випадку великого вмісту у розчині органічних речовин, до нього додають AgNO3 та NaCl. При цьому випадає в осад AgCl та AgCN, інші важкорозчинні сполуки аргентуму. Після фільтрування осаду з нього дією кислоти розчиняють AgCN, потім відганяють HCN.
Можна додавати вивільняючі реагенти, які дозволяють перетворити нетоксичні ціанідні комплекси у слабозв’язані ціаніди, а тоді аналогічно відігнати HCN. Такими вивільняючими реагентами є солі Mg2+ та Hg2+, за участю яких гексаціаноферати повністю, а гексаціанокобальтати частково розкладаються до CN-. Додаючи кислоту (H2SO4), одержують леткий HCN.
Фотометрично визначають ціаніди з піридином та бензидин гідрогенхлордом. Для цього відгон, що містить NaCN, нейтралізують кислотою і одержують HCN, який спочатку окиснюють бромом:
CN-+Br2®BrCN + Br-.
До розчину, який містить BrCN, додають суміш піридину з гідрохлорид бензидином і витримують деякий час. Спочатку утворюється ціанпіридиній бромід:
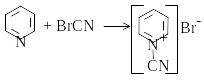
Ціаепіридиній
бромід дає продукт, при гідролізі якого
утворюється глутаконовий альдегід
червоного кольору, який визначають
фотометрично,
![]() =6,9×104.
=6,9×104.
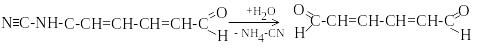
Можна провести визначення ціаніду безпосередньо з проби без відгонки гідроген ціаніду. Для цього після підкислення розчину та окиснення ціаніду бромом утворений бромціан екстрагують бутиловим або аміловим спиртом, а дальше визначення проводять аналогічно.
На ціанід можна діяти хлораміном з утворенням хлорціану ClCN:
CH3Cl + HCN ClCN + CH4.
Після
цього додають піридин
та
барбітурову кислоту
у присутності хлоридної кислоти. Механізм
реакції подібний, теж утворюється
глутаконовий альдегід. При взаємодії
похідного глутаконового альдегіду з
барбітуровою кислотою утворюєтся
барвник пурпурного кольору, який
визначають фотометрично,
![]() =1,24×105.
=1,24×105.
Одержаний відгонкою HCN можна визначити аргентометричним титруванням при рН 11:
Ag++2CN-® [Ag(CN)2]-.
Надлишок Ag+ з п-диметилбензилиденроданіном утворює червоний осад. Таким чином, титрування завершують після переходу жовтого забарвлення у оранжево-червоне. Визначенню заважають карбонові кислоти, які попередньо екстрагують гексаном або хлороформом. Межі визначуваних концентрацій 2-40 мкг/мл.
Визначення селену. Селеніт SeO32- визначають фотометрично з о-фенілендиаміном у кислому середовищі. Одержану сполуку екстрагують бензолом або толуолом.

Заважають визначенню: Fe3+, W(VI), які зв’язують дією Н3РО4; Ві3+, який зв’язують з ЕДТА.
Можна визначати селеніт з 3,3’-діамінобензидином в кислому середовищі, у результаті чого утворюється забарвлений продукт:

Одержаний
продукт екстрагують толуолом у
нейтральному середовищі і фотометрують,
![]() =9,9×103.
=9,9×103.
Визначення арсену. У водах спочатку окиснюють органічні сполуки арсену в арсенат дією KMnO4 або K2S2O8. Одержаний арсенат відновлюють до арсину:
AsO43-+[SnСl4]2-+2H+ +2Cl-®AsO33-+[SnCl6]2-+ H2O,
AsO33-+3Zn+9H+®AsH3+3H2O+3Zn2+.
Утворений
леткий AsH3
відганяють
і
вловлюють розчином діетилдитіокарбамату
Ag в
CCl4.
Утворюється забарвлена сполука,
яку
визначають фотометрично,
![]() =3,6×103.
=3,6×103.
Заважають визначенню: H2S – зв’язують у розчині Pb(CH3COOH)2; SbH3 у кількості >0,1 мг/л; органічні речовини. Органічні речовини руйнують, окисненням сумішшю H2SO4, HCl, H2O2.
У малій кількості AsO43- співосаджують з Fe(OH)3, осад FeAsO4 розчиняють у кислоті. Арсенат відновлюють до AsH3, після чого визначають аналогічно.
Визначення кадмію та плюмбуму екстракційно-фотометричним методом описане в розділі 10.1.
Визначення бісмуту
(ІІІ) з
тіокарбамідом
в кислому середовищі у формі жовтого
комплексу проводять фотометрично,
![]() =8,8×103:
=8,8×103:

Значно
чутливіше визначення в ультрафіолетовій
ділянці,
![]() =35×103.
Заважають катіони важких металів, які
маскують додаванням ЕДТА.
=35×103.
Заважають катіони важких металів, які
маскують додаванням ЕДТА.