- •9. Загальні показники якості об’єктів довкілля
- •9.1. Застосування хімічних методів в аналізі об’єктів довкілля
- •9.2. Загальні якісні характеристики ґрунту
- •9.3. Загальні кількісні характеристики ґрунту
- •9.4. Загальні кількісні характеристики, спільні для ґрунтів та вод
- •9.5. Загальні кількісні характеристики якості вод
- •9.6. Загальні кількісні характеристики газів та повітря
- •9.7. Загальні кількісні характеристики рослинного зразка
- •Контрольні запитання
- •10. Огляд фізико-хімічних методів аналізу, які застосовують в контролі об’єктів довкілля
- •10.1. Оптичні методів в аналізі об’єктів довкілля
- •10.1.1. Застосування спектрофотометричного аналізу
- •10.1.2. Застосування методів полуменевої фотометрії та індуктивно-зв’язаної плазми в аналізі
- •10.2. Електрохімічні методи в аналізі об’єктів довкілля
- •10.2.1. Застосування кондуктометричного методу аналізу
- •10.2.2. Застосування кулонометричного методу аналізу
- •10.2.3. Застосування вольтамперометричних методів аналізу
- •10.2.4. Застосування потенціометричного методу аналізу
- •10.3. Застосування кінетичних методів в аналізі об’єктів довкілля
- •Контрольні запитання
- •11. Методи концентрування і розділення в аналізі об’єктів довкілля
- •11.1. Застосування фізичних методів розділення та концентрування
- •11.2. Застосування відгонки летких речовин
- •11.3. Застосування сорбції (твердофазової екстракції)
- •11.4. Застосування екстракції
- •11.5. Застосування осадження та співосадження
- •11.6. Застосування електровиділення металів та електрофорезу
- •Контрольні запитання
- •12. Застосування хроматографічних методів в аналізі об’єктів довкілля
- •12.1. Застосування методів рідинної хроматографії
- •12.2. Застосування методів тонкошарової та паперової хроматографії
- •12.3. Застосування методів газової хроматографії
- •Контрольні запитання
10.2.4. Застосування потенціометричного методу аналізу
Потенціометричні методи аналізу ґрунтуються на вимірюванні електрорушійної сили (ЕРС):
Е = Е1 Е2 ,
де Е електрорушійна сила; Е1, Е2 потенціали електродів.
Потенціал електрода змінюється зі зміною концентрації (активності) окисненої та відновленої форм речовини в розчині, і ця залежність описується рівнянням Нернста (при 25С):
![]() ,
,
де Е, Ео – редокспотенціал пари окисник/відновник та стандартний редокс-потенціал; n – кількість приєднаних електронів a – активність окисненої та відновленої форм.
У потенціометрії один з електродів, потенціал якого змінюється, є індикаторним, а другий, потенціал якого сталий – порівняння. Вимірявши у такій системі величину ЕРС і знаючи величину потенціалу електрода порівняння, знаходять потенціал індикаторного електрода і, виходячи з рівняння Нернста, одержують інформацію про концентрацію інгредієнта у розчині.
Потенціометричні методи аналізу діляться на дві групи: пряму потенціометрію (іонометрію) і потенціометричне титрування.
У методах прямої потенціометрії для визначення певного іона необхідно застосувати електрод, потенціал якого залежить від концентрації даного іона – так званий іоноселективний електрод. За величиною потенціалу такого індикаторного електрода знаходять активність учасника електродної реакції. Визначення з іоноселективними електродами – це селективний метод, який дозволяє слідкувати за одним іоном, наприклад, у природній чи стічній воді.
Перевага методу – визначення можна проводити у забарвленій, каламутній воді з завислими частинками в присутності білкових речовин, коли проходять біохімічні процеси. До недоліків іоноселективних електродів належить їхня низька точність і чутливість, а також вплив рН розчину на визначення.
Переважно застосовують три групи іоноселективних електродів: кристалічні тверді, гетерогенні тверді, рідкі іонообмінні.
У твердих кристалічних електродах наявна іонна електропровідність кристалу, що має дефекти кристалічної ґратки. Як селективні електроди під час дослідження розчинів природних об’єктів, наприклад вод, використовують LaF3, Ag2S, AgHal, MeS, Me2S. Іонну провідність у них обумовлюють іони F-, Ag+, рідше Cu+, Pb2+, Cd2+. Вільні іони займають у кристалі вакансії за умови, що розмір, форма, розподіл заряду вакансії та іона співпадають. Тому через мембрану переноситься лише даний іон, а інші не включені у перенесення, за винятком дуже подібних.
Можна
записати рівняння Нернста для електрода
LaF3
(або LnF3,
де Ln – рідкісноземельний метал)
![]() ,
,
і
для електрода Ag2S
![]() .
.
Нижче наведено приклади визначень у водах та розчинах із застосуванням кристалічних селективних електродів.
F- визначають електродом, що містить кристалічний LaF3. Спочатку екстракцією з 8-гідроксихіноліном при рН 5,5 усувають з розчину іони Fe3+, Al3+, Ca2+, Mg2+. Під час визначення підтримують сталу іонну силу розчину та рН 5-7,5. Чутливість визначення становить 10-5-10-6 моль/л (похибка 2-5%).
S2- визначають електродом, що містить кристалічний Ag2S. Визначенню заважають іони Hg2+, Hg22+. Цим електродом можна визначати лише іони S2-, а не інші форми сульфіду (HS-, H2S), тому найкраще визначення проводити в лужному середовищі. Визначають вільний сульфід до 10-7 моль/л. Цим електродом можна визначати іон Ag+.
Cl-, Br-, J- визначають електродами, що містять відповідний галоген AgHal. На визначення не впливає кислотність, допустимий широкий діапазон величин рН 2-10. Чутливість визначень становить: J- – 310-8 моль/л; Br-–2,710-6 моль/л; Cl- – 3,810-5 моль/л.
Ці самі електроди можна використати і для визначення інших іонів, таких як SCN-, S2O32-; визначувані концентрації яких у межах 10-3-10-5 моль/л.
CN– визначають електродом з кристалічного AgJ, межі визначуваних концентрацій 10-1-10-6 моль/л.
Cu2+ визначають електродом з кристалічного Cu2S. Заважають визначенню іони Ag+, Hg+, Fe(ІІ,ІІІ). Чутливість визначення – 10-8 моль/л.
Pb2+, Cd2+ визначають електродами з кристалічних PbS, CdS. Заважають визначенню іони Ag+, Hg+, Cu2+, Fe(II,III) та кислота у розчині. Чутливість визначення становить 10-7 моль/л.
Недоліком електродів, що містять сульфіди, є руйнування матеріалу електроду в кислому середовищі.
Змішані кристалічні електроди застосовують для покращення іонної провідності у кристалічній мембрані, якщо основна речовина електроду – сульфід або галогенід металу. Введенням Ag2S до малорозчинних сульфідів збільшує число дислокацій кристалу та іонну провідність, зумовлену іонами Ag+.
У
випадку домішки менш розчинного Ag2S
до іншого сульфіду, коли розчинність
![]() ,
концентрація сульфіду в навколоелектродному
просторі завжди є більшою, ніж у випадку
чистого Ag2S.
Тому іони Меn+
з розчину переходять до електрода, який
реагує на іони металу, і рівняння Нернста
має вигляд:
,
концентрація сульфіду в навколоелектродному
просторі завжди є більшою, ніж у випадку
чистого Ag2S.
Тому іони Меn+
з розчину переходять до електрода, який
реагує на іони металу, і рівняння Нернста
має вигляд:
![]() .
.
Використовують змішані кристалічні електроди: CdS+Ag2S, CuS+Ag2S, PbS+Ag2S, AgHal+Ag2S. На визначення цими електродами впливає рН розчину: у кислому середовищі збільшується розчинність сульфідів, а в лужному можуть утворюватись важкорозчинні Me(OH)n.
Тверді мембранні електроди містять малорозчинну сіль або хелатну сполуку в інертній матриці – полімерному матеріалі (епоксидній смолі, поліхлорвінілі, полістиролі), який надає електроду міцність. Перенесення заряду відбувається іонним механізмом на межі між диспергованою твердою кристалічною фазою та інертною матрицею. Недолік цього типу електродів полягає у поступовій зміні величини редокспотенціалу, бо при роботі вимивається активна речовини з матриці, а полімерна матриця сповільнює дифузію іонів у приелектродному шарі. Такими електродами визначають у водах та ґрунтових витяжках деякі аніони:
SO42- – електродом, що містить BaSO4 у силіконовому каучуку.
РO43- – електродом з BіРO4, однак потенціал його малостабільний.
Визначувані концентрації SO42- та РO43- є в межах 10-1-10-6 моль/л.
В іонообмінних електродах з рідкими мембранами іон переміщається у мембрані дифузійно. Рідкий іонообмінник – це органічна речовина, здатна дисоціювати в полярному розчиннику. Реально використовують електроди, в яких рідкий іоніт введений у полімерну матрицю. Селективність електрода залежить від того, наскільки в мембрану може проникати визначуваний іон. Іонообмінник повинен утворювати з визначуваним іоном більш стійкий комплекс, ніж з іншими іонами у розчині. Перевага – можливість використовувати оборотні і селективні електроди до тих іонів, які не можна визначити з твердими кристалічними електродами, оскільки іони не є носіями струму в кристалах і не утворюють малорозчинних сполук. Недолік – електроди за селективністю поступаються твердим, але кращі від електродів на основі синтетичних іонітів.
Визначення з рідкими катіонообмінниками:
Са2+, Mg2+ – лише коли концентрація іонів Na+, H+ перевищує концентрацію іонів Са2+, ці іони можуть проникати у мембрану, заважаючи визначенню. Заважають визначенню Fe2+, Fe3+, Cu2+, Pb2+, Ni2+, Cr3+, а визначенню Са2+ – іони Mg2+. Тому стандартні розчини для потенціометричного визначення готують з додаванням солей цих іонів. Цим методом можна визначити вміст кальцію та магнію у межах концентрацій 10-1-10-5 моль/л. Найкращий спосіб уникнути впливу сторонніх іонів – застосувати потенціометричне титрування.
К+ – визначенню не заважає Na+ та інші катіони, але впливає присутність кислоти у розчині, якщо її концентрація перевищує концентрацію солі калію.
Визначення з рідкими аніонообмінниками. В електродах цього типу використовують солі четвертинних амонієвих основ [NR4]-An+ і внутрішньокомплексні сполуки металів [ML]+An-.
NO3-, ClO4- – чутливим елементом електрода є хелати металів, четвертинні амонієві солі.
NO2- – чутливим елементом електрода є хелати металів, четвертинні амонієві солі. Визначення можна проводити в широкому діапізоні рН 2-8. Визначенню заважає Cl-. Чутливість визначення 10-5 моль/л.
J-, Cl-, Br- – чутливим елементом електрода є NR4Hal. Важливо, що на визначення на впливає присутність іонів S2-, які при застосуванні кристалічного електрода AgHal утворюють важкорозчинний сульфід і заважають.
До мембранних електродів, у яких різниця потенціалів виникає на межі поділу фаз унаслідок іонообмінної реакції між мембраною та розчином, відноситься найбільше використовують скляний. У скляній мембрані іони гідрогену з розчину заміщують іони Na+, отже електродна реакція полягає в обміні іонів Н+ між розчином і склом. Іони гідрогену на поверхні зовнішнього боку скляної мембрани перебувають у рівновазі з іонами Н+ у досліджуваному розчині, а на внутрішній поверхні – у рівновазі з іонами Н+ всередині скляного електрода, що спричиняє виникнення різниці потенціалів. З урахуванням цих двох потенціалів загальний потенціал скляного електрода
![]() .
.
Скляним електродом можна вимірювати рН в діапазоні 0–10, а електроди, виготовлені зі спеціального скла, придатні для роботи в діапазоні рН 9–14.
При потенціометричному титруванні точку еквівалентності визначають за стрибкоподібною зміною потенціалу індикаторного електрода в процесі титрування. Потенціометричним титруванням можна визначати речовини за реакціями різних типів.
Метод потенціометричного титрування дає можливість легко автоматизувати процес титрування і на цій основі розроблено низку автоматичних титраторів. Їх доцільно використовувати для проведення численних серійних аналізів.
Для визначення кислотності розчину природного об’єкта дуже часто застосовують протолітометричне титрування з індикаторним скляним електродом. За одержаними даними будують криву потенціометричного титрування в координатах рН–V(NaOH) (рис. 10.5).
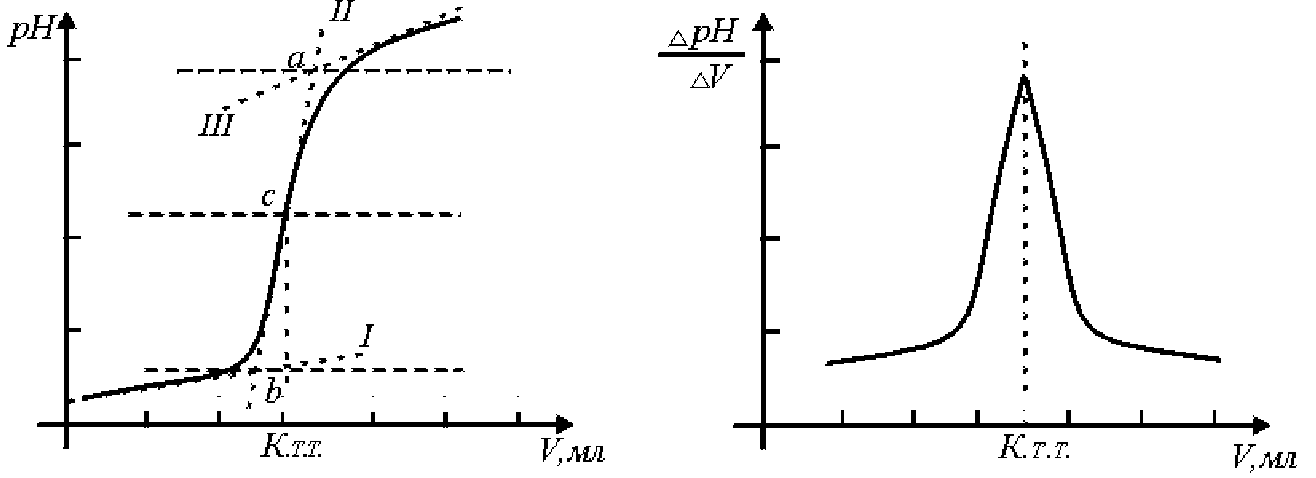
a б
Рис. 10.5. Крива потенціометричного титрування сильної кислоти сильною основою: а – інтегральна форма; б – диференційна форма
З кривої титрування знаходять точку еквівалентності, об’єм титранта та обчислюють масу кислоти HA.
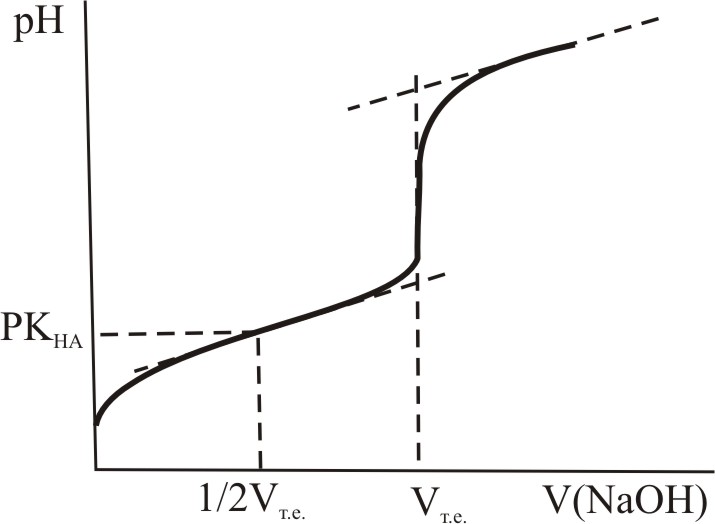
Якщо титрують слабкі кислоти (або основи), то можна приблизно обчислити величину константи протонізації кислоти (основи), що найчастіше виконують, аналізуючи рослинний матеріал. Для цього після завершення титрування (рис.10.6) визначають половину об’єму розчину лугу, затраченого на титрування, що відповідає області існування буферного розчину, в якому a(A–)=a(HA).
|
Рис. 10.6. Крива потенціометричного титрування слабкої кислоти сильною основою, інтегральна форма |
За формулою для обчислення рН буферного розчину знаходять значення рН, рівне величині рКHA:
![]() ,
,
при a(A–)=a(HA), pH=pKHA.
Титруванням за методом осадження з використанням як індикаторних металевих або мембранних електродів, можна визначати іони Ag+, Hg22+, Zn2+, Pb2+, Cl, Br, J. Якщо концентрації галогенідів приблизно однакові, то відносна похибка не перевищує 1-2%.
Індикаторні електроди для потенціометричного окисно-відновного титрування виготовляють із платини, золота, ртуті або срібла, так щоб вибраний метал не взаємодіяв з речовинами у розчині. Найчастіше використовують платиновий електрод.
Наприклад, потенціометричним титруванням з платиновим індикаторним електродом сіллю феруму (ІІ) визначають вміст дихромату у розчині чи стічній воді:
Cr2O72- + 6Fe2+ + 14H+ 2Cr3+ + 6Fe3+ + 7H2O.