
- •Лекция 1
- •3. Введем понятие – поток n вектора напряженности через площадку s:
- •Лекция 2
- •3. Два разноименно заряженных проводника называются конденсатором, если, если расстояние между ними намного меньше их размеров (рис.2.11)
- •Лекция 3
- •Н e1 e2 a а рисунке показан пример схемы цепи постоянного тока, в которой действуют два источника е1 и е2.
- •Лекция 4
- •Искровой разряд.
- •Коронный разряд.
- •Дуговой разряд.
- •Лекция 5
- •2. В результате многих опытов разных ученых был выведен закон Био – Савара – Лапласа, позволяющий рассчитывать магнитную индукцию полей, создаваемых проводниками с током.
- •3. Поместим проводник, согнутый в виде прямоугольной рамки, в однородное магнитное поле.
- •Лекция 6
- •2. Пусть частица с зарядом q и скоростью V влетает в однородное магнитное поле перпендикулярно к линиям магнитной индукции b (рис.6.3).
- •Лекция 7
- •2. Пусть в проводнике в виде катушки течет ток (рис.7.4).
- •3. Рассмотрим электрическую цепь, изображенную на рис.7.6.
- •Лекция 8
- •Лекция 9
- •2. Из уравнений Максвелла были получены волновые уравнения для векторов е и в. В случае однородной нейтральной непроводящей среды с постоянными проницаемостями ε и μ
- •3. Электромагнитные волны классифицируются по длине волны λ или связанной с ней частотой υ волны. Спектром электромагнитных волн называется полоса частот электромагнитных волн, существующих в природе.
- •Лекция 10
- •Еще во времена ранней истории были открыты законы лучевой, или так называемой геометрической, оптики.
- •3. Линза диск из однородного материала, ограниченный двумя полированными поверхностями — сферическими или плоской и сферической.
- •Лекция 11
- •3. Если источник света удален и волну, которая падает на узкую длинную щель можно считать плоской, то наблюдается дифракция Фраунгофера.
- •Лекция 12
- •Лекция 13
- •3. Эйнштейн выдвинул гипотезу, что поток света состоит из дискретных частиц – фотонов. Термин «фотон» был введен в 1926 году. Существование фотонов подтверждается опытами.
- •Лекция 14
- •5. Люминесценция — нетепловое свечение вещества, происходящее после поглощения им энергии возбуждения. В зависимости от вида поглощаемой энергии люминесценция делится на виды:
- •Лекция 15
- •4. Рассмотрим атом, в котором электрон движется вокруг ядра (атом водорода или ион гелия). Потенциальная энергия электрона в поле ядра
- •Лекция 16
Лекция 14
Тема: Теория атома
Вопросы:1) Закономерности в атомных спектрах
2) Ядерная модель атома
3) Постулаты Бора
4) Рентгеновское излучение
5) Люминесценция
6) Лазерное излучение
1. В результате сильного нагрева вещества в его парообразном или газообразном состоянии возникает излучение света атомами, которые можно считать невзаимодействующими. Излучение атомов имеет вид спектров, состоящих из отдельных линий (рис.14.1). Такие спектры называются линейчатыми. Изучение линейчатых спектров в конце 19 века привело к пониманию строения атома.
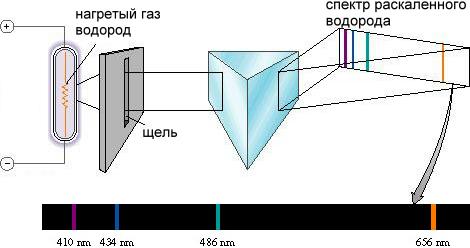
Рис.14.1
Было замечено, что линии в спектрах объединяются в группы (серии), особенно наглядно это проявляется в спектрах водорода. Бальмер в 1885 году установил, что длины волн видимой части спектра водорода (рис.14.1) могут быть представлены формулой
![]() ,
где n
= 3, 4, 5,….
,
где n
= 3, 4, 5,….
Позже были
изучены линии в ультрафиолетовой (УФ)
и инфракрасной (ИК) областях спектра
водорода и получены такие же формулы в
другой записи. В УФ области спектра
серия Лаймана
![]() ;
n
= 2, 3, 4,…
;
n
= 2, 3, 4,…
В видимой области
серия Бальмера
![]() ;
n
= 3, 4, 5,…
;
n
= 3, 4, 5,…
В ИК области серия
Пашена
![]() ;
n
= 4, 5, 6,…
;
n
= 4, 5, 6,…
серия Брекета
![]() ;
n
= 5, 6, 7, …
;
n
= 5, 6, 7, …
серия Пфунда
![]() ;
n
= 6, 7, 8,….
;
n
= 6, 7, 8,….
Константа R
= 2,07·10![]() с
с![]() называется
постоянной Ридберга.
называется
постоянной Ридберга.
Частоты всех линий спектра можно представить обобщенной формулой Бальмера
![]() ,
где m
= 1, 2, 3, 4, .. , n
= m+1
,
где m
= 1, 2, 3, 4, .. , n
= m+1
К концу 19 века накопились данные о сложном строении атома – был открыт электрон, надо было объяснить природу спектров, уже были открыты радиоактивные элементы и ионизирующее излучение атомов. Поэтому предлагались различные модели строения атома. Так, в 1903 году Томсон предложил модель атома в виде сферы, равномерно заполненной положительным зарядом с электроном внутри.
Непосредственное зондирование атома провел Резерфорд; узкий пучок α-частиц направлялся на тонкую металлическую фольгу и регистрировались углы, под которыми α-частицы рассеивались фольгой (рис.14.2).
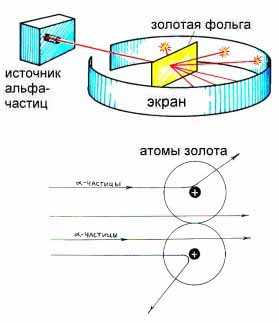
Рис.14.2
Рассеянные частицы ударялись об экран с люминофором и вызывали его свечение, при этом некоторые отклонялись на очень большие углы. Проведя расчеты, Резерфорд пришел к выводу, что внутри атома есть большая масса в очень малом объеме, создающая сильное электрическое поле. На основании своих исследований в 1911 году Резерфорд предложил ядерную модель атома.
Согласно ядерной
модели, в центре любого атома находится
тяжелое положительно заряженное ядро.
Если принять заряд электрона qе
= 1,6·10
Кл
за единицу, то заряд ядра равен порядковому
номеру элемента в периодической системе,
а размеры не превышают 10
см
(размеры атома порядка 10
см).
Атомы электронейтральны, поэтому число
отрицательно заряженных электронов в
атоме тоже равно порядковому номеру
элемента. Электроны вращаются вокруг
ядра, т.к. такая система неподвижных
зарядов не может быть устойчива. Электроны
имеют очень малую массу me
= 9,1·10![]() кг,
поэтому практически вся масса атома
сосредоточена в ядре.
кг,
поэтому практически вся масса атома
сосредоточена в ядре.
В целом модель атома Резерфорда неоднократно подтверждалась на опыте, но при движении электрона с центростремительным ускорением, согласно классической электродинамике, должны излучаться электромагнитные волны, уменьшаться энергия и электрон должен упасть на ядро. Почему этого не происходит, классическая электродинамика не могла объяснить. Кроме того, расчеты на основе классической электродинамики дают непрерывный спектр энергии, излучаемой атомом, а не линейчатый спектр, наблюдаемый на опыте.
В 1913 году Нильс Бор предложил теорию атома, в которой объединил ядерную модель с квантовыми представлениями о природе света. Теория сформулирована в виде постулатов.
Электрон в атоме может иметь не любые, а только определенные дискретные орбиты. Эти орбиты называются стационарными и каждой орбите соответствует строго определенное значение энергии Е1, Е2, Е3, … Еn.
Двигаясь по стационарной орбите, электрон не излучает энергию.
Излучение испускается или поглощается в виде светового кванта энергии hν при переходе из одного стационарного состояния в другое. Величина кванта энергии равна разности энергий тех стационарных состояний, между которыми совершается скачок электрона:
hν = En - Em
Бор исходил из представлений Планка о том, что атом как гармонический осциллятор может иметь только такие состояния, энергия которых равна En = nhν, где n – ряд целых чисел. Правило квантования Бор распространил и на другие характеристики. Он пришел к выводу, что возможны только такие орбиты, для которых момент импульса электрона удовлетворяет условию
mevr = n h/2π, где n = 1, 2, 3,…
Рассматривая электрон, движущийся в поле атомного ядра с зарядом Zqe , где Z – порядковый номер атома, Бор получил формулу энергии электрона атома в стационарном состоянии
![]() ,
где n
= 1, 2, 3,… и называется главным квантовым
числом.
,
где n
= 1, 2, 3,… и называется главным квантовым
числом.
При переходе
электрона в атоме водорода (Z
= 1) из состояния n
в состояние m
испускается фотон
hν = En
– Em
=
![]() .
.
Частота
световой волны ν=![]() .
Таким образом, получается обобщенная
формула Бальмера, в которой постоянная
Ридберга
.
Таким образом, получается обобщенная
формула Бальмера, в которой постоянная
Ридберга
![]() .
.
Энергетическая диаграмма для атома водорода приведена на рис.14.3
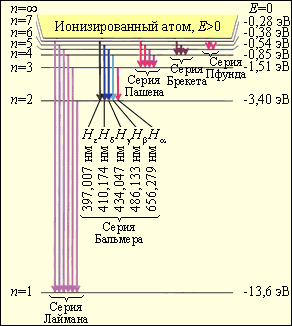
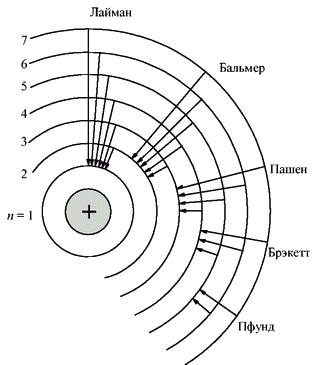
Рис.14.3
Получив извне
достаточную энергию, электрон переходит
с нижнего основного уровня энергии на
более высокий. Такое состояние атома
называется возбужденным, оно неустойчиво
и через 10![]() с
электрон самопроизвольно (спонтанно)
переходит в состояние с меньшим значением
энергии, испуская избыточную энергию
в виде кванта света определенной частоты.
Например, электрон может перейти с
четвертого на третий или на второй, или
сразу на первый основной уровень – во
всех случаях частоты разные. На третьем
и втором уровнях электрон также находится
не более 10
с.
Все переходы носят случайный характер,
поэтому, если сообщить газу, состоящему
из множества атомов, достаточную энергию,
то наблюдается полный спектр излучения.
с
электрон самопроизвольно (спонтанно)
переходит в состояние с меньшим значением
энергии, испуская избыточную энергию
в виде кванта света определенной частоты.
Например, электрон может перейти с
четвертого на третий или на второй, или
сразу на первый основной уровень – во
всех случаях частоты разные. На третьем
и втором уровнях электрон также находится
не более 10
с.
Все переходы носят случайный характер,
поэтому, если сообщить газу, состоящему
из множества атомов, достаточную энергию,
то наблюдается полный спектр излучения.
Теория Бора явилась переходным этапом в изучении атома. Она объяснила спектр излучения водорода, но испытала существенные трудности в построении теории более сложных атомов. Причина в том, что Бор попытался совместить классические и квантовые представления, которые применительно к микрочастицам противоречивы.
4. Рентгеновское излучение – это электромагнитные волны с частотой от 0,005 нм до 10 нм. Рентгеновские лучи возникают при бомбардировке электронов с высокой кинетической энергией твердых мишеней. Есть два вида рентгеновского излучения – тормозное и характеристическое.
Для получения рентгеновских лучей используют рентгеновскую трубку (рис.14.4). Электроды помещены в откачанный баллон.
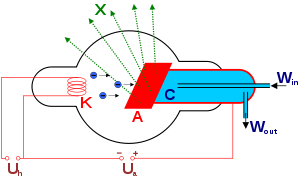
Рис. 14.4 X — рентгеновские лучи, K — катод, А — анод (иногда
называемый антикатодом), С — теплоотвод, Uh — напряжение накала
катода, Ua — ускоряющее напряжение, Win — впуск водяного
охлаждения, Wout — выпуск водяного охлаждения.
Электроны вылетают из нагретого катода в результате термоэлектронной эмиссии и ускоряются полем анода. Анод является мишенью и изготавливается из тяжелых металлов: вольфрама, меди, платины и др. Напряжение между катодом и анодом до 50 кВ, разгоняет электроны до скорости 0,4с. Большая часть энергии выделяется на аноде в виде тепла, поэтому анод приходится охлаждать.
Попав в вещество, электроны испытывают сильное торможение и испускают электромагнитные волны (тормозное излучение). Максимальная энергия рентгеновских фотонов соответствует максимальной кинетической энергии электронов Екин = qeU, поэтому по мере увеличения напряжения длина волны, на которую приходится максимум мощности излучения (интенсивности), уменьшается (рис. 14.5).
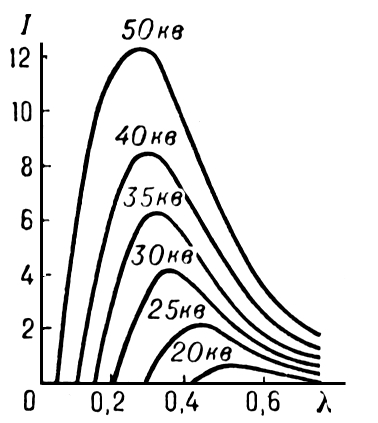
Ритс.14.5.
Спектр
тормозного рентгеновского излучения
не зависит от природы вещества анода.
Согласно классической электродинамике
при торможении должны возникать волны
всех длин, однако, на опыте установлено,
что имеется коротковолновая граница
излучения. Объясняет этот факт квантовая
теория: величина излучаемого рентгеновского
кванта не может превысить энергию,
теряемую электроном при торможении
hν≤
qeU.
Значит, минимальная длина излучаемой
волны
![]() ,
что соответствует результатам опыта.
,
что соответствует результатам опыта.
Когда энергия бомбардирующих электронов становится достаточной для вырывания электронов из внутренних оболочек атома, на фоне тормозного излучения появляются резкие линии характеристического излучения (рис.14.6).
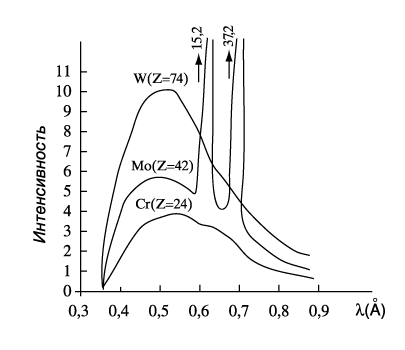
Рис.14.6
Этот тип излучения возникает, когда быстрый электрон, достигая анода, проникает во внутренние орбитали атомов и выбивает один из их электронов. В результате появляется свободное место, которое может быть заполнено другим электроном, спускающимся с одной из верхних атомных орбиталей. Такой переход электрона с более высокого на более низкий энергетический уровень вызывает рентгеновское излучение определенной длины волны. Поэтому характеристическое рентгеновское излучение имеет линейчатый спектр.
Частота линий характеристического излучения зависит от структуры электронных орбиталей атомов анода. Линии спектра характеристического излучения разных химических элементов имеют одинаковый вид, поскольку структура их внутренних электронных орбитальных идентична (рис.14.7).
Рентгеновские спектры состоят из нескольких серий, обозначаемых буквами К, L, M, N, O по наименованию электронной оболочки, на которую совершаются переходы электронов (К – уровень первая ближайшая к ядру оболочка, L – вторая и т.д.). Каждая серия включает небольшое число спектральных линий, обозначаемых в порядке возрастания частоты α, β, γ…. При увеличении атомного номера Z весь рентгеновский спектр смещается в сторону коротких длин волн, не меняя своей структуры, которая одинакова у разных атомов. Разница в частоте объясняется энергетическим различием между внутренними орбиталями легких и тяжелых атомов.
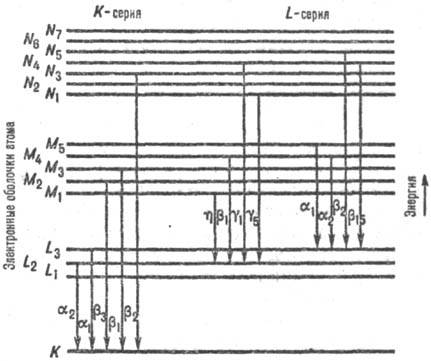
Рис.14.7
Частота линий спектра характеристического рентгеновского излучения определяется законом Мозли: корень квадратный из частоты является линейной функцией атомного номера
ν1/2=A(Z-σ), где Z - атомный номер химического элемента, A и - σ константы.
Закон Мозли позволяет по длине излучаемой рентгеновской волны определять атомный номер элемента, на этом основан рентгеноспектральный анализ веществ.
