
- •Лекция 1: 9.09.2015
- •Требования, предъявляемые к катодным осадкам в гальванотехнике и гидроэлектрометаллургии. 2
- •Механизм электрокристаллизации металлов
- •Лекция 3: 23.09.2015
- •Влияние природы осаждаемого Ме на величину кристаллов и Ме-п
- •Влияние режима электролиза на структуру металлических покрытий/осадков
- •Влияние состава электролита на структуру гальванических осадков
- •Лекция 4: 30.09.2015
- •Условия получения компактных поликристаллических осадков
- •Влияние различных факторов на рс электролита
- •Методы измерения рассеивающей способности
- •Анодные процессы гальванотехники. Выбор материала, вида и площади поверхности анода
- •Обезжиривание
- •Химическое обезжиривание
- •Электрохимическое обезжиривание
- •Промывочные операции
- •Электрополировка поверхностей Ме
- •Цинкование
- •Сульфатные электролиты цинкования
- •Лекция 10: 18.11.2015
- •Хлористоаммонийные и аммиакатные электролиты цинкования
- •Заключительные операции при цинковании
- •Сульфатные электролиты никелирования
- •Блестящее никелирование
- •Перспективные электролиты никелирования
- •Многослойное никелирование
- •1)Би-никель (двухслойное никелирование).
- •Хромирование. Целевое назначение. Электролиты и их сравнительная характеристика
- •Хромирование из сульфатного электролита
- •Усовершенствование процессов хромирования
- •Интенсификация процесса хромирования
- •Физико – химические свойства Cr-п
- •Механизм процесса анодирования
- •Заключительные операции при анодировании
- •Особые случаи анодирования
- •Электроосаждение сплавов
- •Лекция 15: 23.12.2015
- •Электроосаждение Ме-п в насыпном виде
- •1)Наливной колокол
- •2)Погружные вращающиеся барабаны. Они погружаются в гальваническую ванну, аноды с 2-х сторон вдоль граней барабана, он вращается и идет покрытие.
- •Осаждение Ме-п на реверсивном токе
Хромирование из сульфатного электролита
В
качестве катализатора используют H2SO4
и соотношение концентраций:
 =100/1,
если нарушается, то снижается и без
того маленький Вт. Сульфатные электролиты
делят на разбавленные, с концентрацией
150-200 г/л CrO3;
средние – 200-250 г/л; концентрированные
>250 г/л. Разбавленные электролиты имеют
самый высокий Вт=18-20%, могут работать
на высоких плотностях тока, но достаточно
быстро вырабатываются по CrO3
и
требуют частой корректировки, что
неудобно. Чаще используют средние или
стандартные электролиты с Вт=15-18%. Их
нужно не так часто корректировать,
менее температурный и токовый режим,
можно менять структуру самого покрытия
и его функциональные свойства.
Концентрированный электролит хорош
тем, что имеет высокую кроющую способность,
т.е. способен давать покрытие на
труднодоступных участках детали, правда
без учета равномерности толщины.
Электролит достаточно вязкий, и его
достаточно много уносится вместе с
деталью, что дает повышенную нагрузку
на очистные сооружения. Правда из-за
такого электролита покрытия менее
твердые и легко полируются, Вт не
превышает 12%. Исходя из концентрации
CrO3
видно,
что тем она больше, тем меньше Вт, а
стало быть растворимые хромовые аноды
применять нельзя. Кроме того, Вт сильно
зависит от температуры и плотности
тока, что видно из поляризационных
кривых:
=100/1,
если нарушается, то снижается и без
того маленький Вт. Сульфатные электролиты
делят на разбавленные, с концентрацией
150-200 г/л CrO3;
средние – 200-250 г/л; концентрированные
>250 г/л. Разбавленные электролиты имеют
самый высокий Вт=18-20%, могут работать
на высоких плотностях тока, но достаточно
быстро вырабатываются по CrO3
и
требуют частой корректировки, что
неудобно. Чаще используют средние или
стандартные электролиты с Вт=15-18%. Их
нужно не так часто корректировать,
менее температурный и токовый режим,
можно менять структуру самого покрытия
и его функциональные свойства.
Концентрированный электролит хорош
тем, что имеет высокую кроющую способность,
т.е. способен давать покрытие на
труднодоступных участках детали, правда
без учета равномерности толщины.
Электролит достаточно вязкий, и его
достаточно много уносится вместе с
деталью, что дает повышенную нагрузку
на очистные сооружения. Правда из-за
такого электролита покрытия менее
твердые и легко полируются, Вт не
превышает 12%. Исходя из концентрации
CrO3
видно,
что тем она больше, тем меньше Вт, а
стало быть растворимые хромовые аноды
применять нельзя. Кроме того, Вт сильно
зависит от температуры и плотности
тока, что видно из поляризационных
кривых:

Чем
выше температура, тем ниже Вт и это
связывают с тем, что за счет температуры
поверхностная сульфат - содержащая
пленка разрыхляется, освобождает
поверхность и в большей степени идет
выделение Н2
на такой поверхности. Чтобы скомпенсировать
снижение с ростом температуры необходимо
повысить плотность тока, которая будет
формировать и уплотнять необходимую
приповерхностную пленку. Из-за того,
что в большинстве случаев стараются
получать блестящие Cr-П из электролита,
необходимо следить за количеством в
электролите ионов
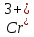 .
Они не влияют на Вт, но сильно влияют
на качество Ме-П:
.
Они не влияют на Вт, но сильно влияют
на качество Ме-П:
 должен быть в пределах 5-7 г/л. Если
концентрация не оптимальна, область
получения блестящих покрытий сильно
сужается, они получаются серыми, грубыми
и шероховатыми. Сам
должен быть в пределах 5-7 г/л. Если
концентрация не оптимальна, область
получения блестящих покрытий сильно
сужается, они получаются серыми, грубыми
и шероховатыми. Сам
 в ходе процесса нарабатывается по 2
реакции, но нужно, чтобы его количество
было в заданном интервале. Для этого
первоначально
в ходе процесса нарабатывается по 2
реакции, но нужно, чтобы его количество
было в заданном интервале. Для этого
первоначально
 специально нарабатывают, изменяя
соотношение площади катодной поверхности
к анодной в пределах 4:1 – 6:1. В рабочем
режиме наоборот, надо сделать ток, чтобы
концентрация
специально нарабатывают, изменяя
соотношение площади катодной поверхности
к анодной в пределах 4:1 – 6:1. В рабочем
режиме наоборот, надо сделать ток, чтобы
концентрация
 не увеличивалась. Поэтому здесь
соотношение площади катодной к анодной
поверхности держат в пределах 1,5:1 , 2:1.
Аноды при хромировании используют
нерастворимые свинцовые, могут применять
сплавы Pb с Sn, и с Sb. Такие сплавы имеют
лучшие механические, прочностные и
литейные свойства. На ход анодных
реакций эти сплавы влияют мало, основным
анодным процессом является выделение
О2
(более 80%), остальное на процесс окисления
не увеличивалась. Поэтому здесь
соотношение площади катодной к анодной
поверхности держат в пределах 1,5:1 , 2:1.
Аноды при хромировании используют
нерастворимые свинцовые, могут применять
сплавы Pb с Sn, и с Sb. Такие сплавы имеют
лучшие механические, прочностные и
литейные свойства. На ход анодных
реакций эти сплавы влияют мало, основным
анодным процессом является выделение
О2
(более 80%), остальное на процесс окисления
 до
до
 (реакция, обратная реакции 2). Именно
равновесие 2-ой реакции балансирует
нужное количество
(реакция, обратная реакции 2). Именно
равновесие 2-ой реакции балансирует
нужное количество
 в
электролите. Т.к. анод ионы
в
электролите. Т.к. анод ионы
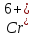 не поставляет в нужных количествах и
на осаждение Ме требуется корректировка
электролита по CrO3,
расчет ведут по закону Фарадея:
не поставляет в нужных количествах и
на осаждение Ме требуется корректировка
электролита по CrO3,
расчет ведут по закону Фарадея:
 .
Основным процессом при хромировании
является электролиз воды, значит большое
газовыделение, а растворы вязкие,
.
Основным процессом при хромировании
является электролиз воды, значит большое
газовыделение, а растворы вязкие,
 вреден. За счет газовых пузырьков в
атмосферу и в вентиляцию уносится
большое количества H2SO4
и CrO3
–
это плохо. Для снижения такого уноса в
электролиты рекомендуют вводить
спец.вещества – ПАВ, создающие на
поверхности электролита пленку в виде
пены. В этой пленке происходит отделение
газовых пузырьков от жидкости. Газ
достаточно быстро выделяется, а частички
электролита конденсируются и остаются
в объеме, унос сильно уменьшается. В
старых ГОСТах приводятся препараты
Хромин, Хромоксан. Если переборщить с
добавками ПАВ – пена выплескивается
за пределы ванны, что плохо, особенно
при высоких плотностях тока и поэтому
вместе с ПАВ вводят пеногасители.
Нормальным является при хромировании
– микровзрывы, происходящие из-за того,
что запутавшиеся пузырьки Н2
и О2
образуют гремучую смесь, приводящую к
микровзрывам.
вреден. За счет газовых пузырьков в
атмосферу и в вентиляцию уносится
большое количества H2SO4
и CrO3
–
это плохо. Для снижения такого уноса в
электролиты рекомендуют вводить
спец.вещества – ПАВ, создающие на
поверхности электролита пленку в виде
пены. В этой пленке происходит отделение
газовых пузырьков от жидкости. Газ
достаточно быстро выделяется, а частички
электролита конденсируются и остаются
в объеме, унос сильно уменьшается. В
старых ГОСТах приводятся препараты
Хромин, Хромоксан. Если переборщить с
добавками ПАВ – пена выплескивается
за пределы ванны, что плохо, особенно
при высоких плотностях тока и поэтому
вместе с ПАВ вводят пеногасители.
Нормальным является при хромировании
– микровзрывы, происходящие из-за того,
что запутавшиеся пузырьки Н2
и О2
образуют гремучую смесь, приводящую к
микровзрывам.
