
- •Лекция 1: 9.09.2015
- •Требования, предъявляемые к катодным осадкам в гальванотехнике и гидроэлектрометаллургии. 2
- •Механизм электрокристаллизации металлов
- •Лекция 3: 23.09.2015
- •Влияние природы осаждаемого Ме на величину кристаллов и Ме-п
- •Влияние режима электролиза на структуру металлических покрытий/осадков
- •Влияние состава электролита на структуру гальванических осадков
- •Лекция 4: 30.09.2015
- •Условия получения компактных поликристаллических осадков
- •Влияние различных факторов на рс электролита
- •Методы измерения рассеивающей способности
- •Анодные процессы гальванотехники. Выбор материала, вида и площади поверхности анода
- •Обезжиривание
- •Химическое обезжиривание
- •Электрохимическое обезжиривание
- •Промывочные операции
- •Электрополировка поверхностей Ме
- •Цинкование
- •Сульфатные электролиты цинкования
- •Лекция 10: 18.11.2015
- •Хлористоаммонийные и аммиакатные электролиты цинкования
- •Заключительные операции при цинковании
- •Сульфатные электролиты никелирования
- •Блестящее никелирование
- •Перспективные электролиты никелирования
- •Многослойное никелирование
- •1)Би-никель (двухслойное никелирование).
- •Хромирование. Целевое назначение. Электролиты и их сравнительная характеристика
- •Хромирование из сульфатного электролита
- •Усовершенствование процессов хромирования
- •Интенсификация процесса хромирования
- •Физико – химические свойства Cr-п
- •Механизм процесса анодирования
- •Заключительные операции при анодировании
- •Особые случаи анодирования
- •Электроосаждение сплавов
- •Лекция 15: 23.12.2015
- •Электроосаждение Ме-п в насыпном виде
- •1)Наливной колокол
- •2)Погружные вращающиеся барабаны. Они погружаются в гальваническую ванну, аноды с 2-х сторон вдоль граней барабана, он вращается и идет покрытие.
- •Осаждение Ме-п на реверсивном токе
Заключительные операции при цинковании
Улучшают
внешний вид покрытия и значительно
повышают его коррозионную стойкость,
в ~2÷3 раза. Традиционно Zn-П подвергают
операциям осветления и хроматирования.
1-ая проводится в растворе HNO3
3-5%-ном и происходит хим.стравливание
несоориентированных цинковых кристаллов,
благодаря чему поверхность становится
более ровной и из темно-серого в
светло-серой. Операция необходима,
когда не было надежных блескообразующих
и выравнивающих добавок для покрытия,
полученного из цинкатного электролита
цинкования. Затем промывают холодной,
теплой водой и Zn-П приобретает равномерный
светло-серый цвет и не захватывается
руками. В последнее время от осветления
отказываются или совмещают с последующей
операцией хроматирования, которые
важны и, как правило, обязательны. Здесь
Zn-П обрабатывается в растворах солей
хромовой кислоты, содержащей ионы
 .
В результате химической реакции
образуется хроматная пленка:
.
В результате химической реакции
образуется хроматная пленка:
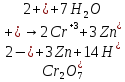 .
На поверхности цинка будут присутствовать
ионы цинка,
.
На поверхности цинка будут присутствовать
ионы цинка,
 ,
,
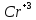 ,
которые в той или иной степени будут
гидратированы. Пленка имеет переменный
состав, в нее могут входить: ZnCrO4,
(ZnO)2CrO4,
Cr2O3·CrO3·nH2O.
И такой переменный состав делает пленку
разноцветной, она получается красивой
по внешнему виду: желтая, зеленая,
голубая, оранжевая, фиолетовая и
радужная. Хроматная пассивация приводит
к тому, что часть нанесенного Zn-П
растворяется и съедается 1-3 мкн заложенной
толщины, поэтому предварительно нужно
делать запас толщины покрытия, чтобы
учесть это растворение. Операцию
хроматирования совмещают с осветлением:
в состав содержащий соли Cr
и H2SO4,
дополнительно вводят HNO3,
состав совмещенного раствора мб:
,
которые в той или иной степени будут
гидратированы. Пленка имеет переменный
состав, в нее могут входить: ZnCrO4,
(ZnO)2CrO4,
Cr2O3·CrO3·nH2O.
И такой переменный состав делает пленку
разноцветной, она получается красивой
по внешнему виду: желтая, зеленая,
голубая, оранжевая, фиолетовая и
радужная. Хроматная пассивация приводит
к тому, что часть нанесенного Zn-П
растворяется и съедается 1-3 мкн заложенной
толщины, поэтому предварительно нужно
делать запас толщины покрытия, чтобы
учесть это растворение. Операцию
хроматирования совмещают с осветлением:
в состав содержащий соли Cr
и H2SO4,
дополнительно вводят HNO3,
состав совмещенного раствора мб:
Na2Cr2O7 25-35 г/л
HNO3 3-5 г/л
Na2SO4 10-20 г/л
t=15-30◦C, τ=30-60 с
Все
операции осветления и хроматирования
кратковременны, 1 минута – максимум.
Хромсодержащая пассивная пленка
формируется не сразу, для ее формирования
за счет гидратации требуется время.
Максимальные характеристики по
твердости, защитным характеристикам
и гидрофобности приобретает за сутки.
Эта первоначальная пленка боится
перегрева, поэтому после хроматирования,
промывки, сушку готового покрытия ведут
при t≤50-60◦С.
Первоначально защитная пленка мягкая
и это плохо, если хромирование ведется
насыпью. Чтобы этого избежать немного
увеличивают рН раствора хроматирования
до ~ 4. Твердость такой пленки увеличивается
и она уверенно формируется в условиях
вращения барабана. Соединения
 в Европе запрещены к применению. На
смену операции хроматирования пришли
другие, где
в Европе запрещены к применению. На
смену операции хроматирования пришли
другие, где
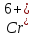 отсутствует полностью или его количество
минимально. Это операции хромитирования:
в качестве исходного вещества используется
отсутствует полностью или его количество
минимально. Это операции хромитирования:
в качестве исходного вещества используется
 и в ходе хромитирования восстанавливается
до
и в ходе хромитирования восстанавливается
до
 .
Возможная реакция превращения: Zn+
.
Возможная реакция превращения: Zn+ .
.
 входят
в состав пленки в различной степени
гидратирования. Защитные свойства и
цветовая гамма ниже, чем у хроматных,
но эту хромистую пленку часто дополнительно
подвергают обработке в полимерах. В
частности, в пленкообразователях,
характерных для ЛКП: акриловые или
алкидные смолы. В результате защитные
способности повышаются, для формирования
полимерной пленки часто требуется
повышенная температура, но это не
страшно, т.к. хромитные пленки, в отличие
от хроматных, перегрева не боятся. В
последнее время в состав хромитных
пленок и в полимерный состав рекомендуют
вводить добавки некоторых веществ
очень малых размеров: наночастицы
оксида циркония или кремния. В случае
нарушения целостности защитной пленки,
эти частицы проникают в пору и закрывают
поверхность. Явление называется
самолечеванием. Этот же эффект характерен
для обычных хроматных пленок. Открытых
составов для хромитирования нет.
Хромит-2А:
входят
в состав пленки в различной степени
гидратирования. Защитные свойства и
цветовая гамма ниже, чем у хроматных,
но эту хромистую пленку часто дополнительно
подвергают обработке в полимерах. В
частности, в пленкообразователях,
характерных для ЛКП: акриловые или
алкидные смолы. В результате защитные
способности повышаются, для формирования
полимерной пленки часто требуется
повышенная температура, но это не
страшно, т.к. хромитные пленки, в отличие
от хроматных, перегрева не боятся. В
последнее время в состав хромитных
пленок и в полимерный состав рекомендуют
вводить добавки некоторых веществ
очень малых размеров: наночастицы
оксида циркония или кремния. В случае
нарушения целостности защитной пленки,
эти частицы проникают в пору и закрывают
поверхность. Явление называется
самолечеванием. Этот же эффект характерен
для обычных хроматных пленок. Открытых
составов для хромитирования нет.
Хромит-2А:
 ,
кислота (H2SO4
или HNO3),
доп.деполяризующие добавки - соли Co,
ускоряющие окисление Zn.
,
кислота (H2SO4
или HNO3),
доп.деполяризующие добавки - соли Co,
ускоряющие окисление Zn.
Лекция 11: 25.11.2015
Никелирование. Целевое назначение, электролиты и их основные характеристики.
Никелирование
весьма распространенный процесс, т.к.
Ni-П
может использоваться в качестве
защитного, чаще защитно-декоративного,
функционального.
 =
-0,25 В. Но поверхность достаточно быстро
пассивируется, реальный Ɛ сдвинут в
«+»
направлении на 200 мВ, а значит, по
отношению к стальным основам Ni-П
является катодным и защищает Ме- основы
за счет собственной толщины и
беспористости. Беспористые Ni-П получаются
толщиной 25-28 микрон, а такой толстый
слой дорогой, поэтому для защиты
Ме-основы используют или многослойные
Ni-П
различного состава и структуры, или же
используют многослойные покрытия, где
Ni
является лишь составной частью. В
автомобиле- и приборостроении, бытовой
технике часто используют трехслойное
покрытие из 1-ого слоя Cu, затем Ni и
верхнего тонкого слоя Cr.
Наибольшая толщина, как правило, у 1-ого
слоя Cu, он недорогой, толщина 20÷30 и более
микрон. За счет этого можно уменьшить
следующий слой Ni и вместо 25÷28 можно
использовать 15÷18 микрон. Кроме того, в
этих условиях Ni по отношению к Cu
становится анодным покрытием и защищает
медный подслой электрохимически. В
результате такой защиты поверхность
Ni со временем тускнеет и теряет блеск,
декоративные свойства снижаются. Чтобы
этого не было: поверх Ni осаждают тонкий,
но блестящий слой Cr с толщиной до 1,5
микрон, тогда декоративные свойства
покрытия сохраняются длительное время
– это защитно-декоративное трехслойное
покрытие.
=
-0,25 В. Но поверхность достаточно быстро
пассивируется, реальный Ɛ сдвинут в
«+»
направлении на 200 мВ, а значит, по
отношению к стальным основам Ni-П
является катодным и защищает Ме- основы
за счет собственной толщины и
беспористости. Беспористые Ni-П получаются
толщиной 25-28 микрон, а такой толстый
слой дорогой, поэтому для защиты
Ме-основы используют или многослойные
Ni-П
различного состава и структуры, или же
используют многослойные покрытия, где
Ni
является лишь составной частью. В
автомобиле- и приборостроении, бытовой
технике часто используют трехслойное
покрытие из 1-ого слоя Cu, затем Ni и
верхнего тонкого слоя Cr.
Наибольшая толщина, как правило, у 1-ого
слоя Cu, он недорогой, толщина 20÷30 и более
микрон. За счет этого можно уменьшить
следующий слой Ni и вместо 25÷28 можно
использовать 15÷18 микрон. Кроме того, в
этих условиях Ni по отношению к Cu
становится анодным покрытием и защищает
медный подслой электрохимически. В
результате такой защиты поверхность
Ni со временем тускнеет и теряет блеск,
декоративные свойства снижаются. Чтобы
этого не было: поверх Ni осаждают тонкий,
но блестящий слой Cr с толщиной до 1,5
микрон, тогда декоративные свойства
покрытия сохраняются длительное время
– это защитно-декоративное трехслойное
покрытие.
В качестве защитного покрытия Ni используют в хим. промышленности, особенно в некоторых органических средах и практически во всех щелочных. Раньше никелированию подвергался почти весь медицинский инструмент, но такое покрытие за рубежом признано канцерогенным и его не рекомендуют применять на деталях, которые контактируют с человеческим телом.
Много Ni и его сплавов используются в качестве функциональных покрытий, т.к. покрытия достаточно твердые, износостойкие, наносятся толстым слоем, хорошо запрессовываются, являются основным компонентом многих сплавов с Ме и неМе, можно менять магнитные и отражательные свойства. Ni-П можно использовать в приборостроении в качестве подслоя под драгоценные Ме. Он является диффузионным барьером для проникновения атомов Ме-основы в верхние слои покрытия из драгоценных металлов. Толщина Ni-покрытия в зависимости от условий эксплуатации для большинства потребителей редко превышает 15÷18 микрон. Может наносится как на подвесках, так и насыпью.
Электролиты в большинстве случаев являются простыми и работают в слабокислых средах, значит им присущи свойства, характерные для простых электролитов (см. раздел цинкования). Здесь электролиты стабильны, можно работать на больших плотностях тока, Вт под 100% и мало зависит от плотности. Но РС невелика и в обычных режимах лучше покрывать простые по форме изделия. Электролиты называются по виду соли Ме и существуют: сульфатные, где основной компонент – сульфат Ni; хлоридные электролиты – хлорид Ni; борфторатные – борфторат Ni и сульфаминовые, где соль – сульфамат Ni. Самые распространенные – сульфатные, позволяют получать матовые и блестящие покрытия. Наиболее производительные BF-электролиты, т.к. растворимость соли никеля высокая 400-500 г/л, можно работать на высоких плотностях до 30 А/дм2, т.е. за короткое время получать толстые покрытия. Сульфаматные электролиты дают чаще самые пластичные покрытия никелем и такие покрытия целесообразно наносить, когда требуется толстый слой или деталь подвержена изгибающим нагрузкам. BF и сульфаматные часто используются в гальванопластике для получения гальванических копий толщиной примерно несколько микрон. Хлоридные электролиты используются реже, т.к. они более дорогие, но часто их применяют в технологиях ударного никелирования при покрытиях различных Ме с пассивными пленками (нержавеющие стали). Реже используют комплексные электролиты: пирофосфатные, лимоннокислые, цитратные. Последние отличаются высокой РС, работают при нейтральных pH, дают весьма пластичные покрытия, равномерные по толщине, правда здесь небольшие рабочие j≈2 А/дм2. На основе цитратных электролитов можно осадить Ni-сплавы, в том числе Ме с неМе.
