
- •Лекция 1: 9.09.2015
- •Требования, предъявляемые к катодным осадкам в гальванотехнике и гидроэлектрометаллургии. 2
- •Механизм электрокристаллизации металлов
- •Лекция 3: 23.09.2015
- •Влияние природы осаждаемого Ме на величину кристаллов и Ме-п
- •Влияние режима электролиза на структуру металлических покрытий/осадков
- •Влияние состава электролита на структуру гальванических осадков
- •Лекция 4: 30.09.2015
- •Условия получения компактных поликристаллических осадков
- •Влияние различных факторов на рс электролита
- •Методы измерения рассеивающей способности
- •Анодные процессы гальванотехники. Выбор материала, вида и площади поверхности анода
- •Обезжиривание
- •Химическое обезжиривание
- •Электрохимическое обезжиривание
- •Промывочные операции
- •Электрополировка поверхностей Ме
- •Цинкование
- •Сульфатные электролиты цинкования
- •Лекция 10: 18.11.2015
- •Хлористоаммонийные и аммиакатные электролиты цинкования
- •Заключительные операции при цинковании
- •Сульфатные электролиты никелирования
- •Блестящее никелирование
- •Перспективные электролиты никелирования
- •Многослойное никелирование
- •1)Би-никель (двухслойное никелирование).
- •Хромирование. Целевое назначение. Электролиты и их сравнительная характеристика
- •Хромирование из сульфатного электролита
- •Усовершенствование процессов хромирования
- •Интенсификация процесса хромирования
- •Физико – химические свойства Cr-п
- •Механизм процесса анодирования
- •Заключительные операции при анодировании
- •Особые случаи анодирования
- •Электроосаждение сплавов
- •Лекция 15: 23.12.2015
- •Электроосаждение Ме-п в насыпном виде
- •1)Наливной колокол
- •2)Погружные вращающиеся барабаны. Они погружаются в гальваническую ванну, аноды с 2-х сторон вдоль граней барабана, он вращается и идет покрытие.
- •Осаждение Ме-п на реверсивном токе
Многослойное никелирование
В практике для улучшения качества, сокращения суммарной толщины и для повышения антикоррозионных свойств используют варианты многослойного никелирования:
1)Би-никель (двухслойное никелирование).

Ni I наносится из электролитов или не содержащих БО, или из электролитов, где отсутствуют серосодержащие БО, толщина 50-70% от суммарной. Нижний слой имеет столбчатую структуру, которая дает сквозные поры до основы. 2-ой слой из электролитов серосодержащих БО. Получается слой Ni-S, S=0,05%. Структура преимущественно слоистая, поры мб, но насквозь почти не пронизывают. По сравнению с предыдущим слоем эти поры перекрываются. Главное, что верхний слой благодаря наличию серы имеет более «─» Ɛ, чем нижний слой. Значит, зона коррозии в случае пористого покрытия перенесется с границы сталь-нижний слой на границу верхний-нижний слой, сама Ме-основа не разрушается. Разрушается верхний слой на границе, а нижний слой – Fe, имеет более «+» Ɛ. Такая технология позволяет сократить суммарную толщину и экономить дорогой Ni.
2)Три-никель (трехслойное покрытие). Верхний и нижний слои разделены доп.серосодержащим слоем с большим количеством серы. Этот средний слой будет иметь наиболее «-» Ɛ и зона разрушения будет находиться на границе между верхним и средним слоем, причем верхний слой разрушаться не будет
 (где
«-» 0,1-0,12%)
(где
«-» 0,1-0,12%)
Такая технология за счет сохранения верхнего слоя позволяет надолго сохранить его декоративные качества.
3)Никель-сил – это двухслойное покрытие. Основа – би-никель, но верхний слой включает большое количество неМе дисперсного компонента. Частицы очень маленьких размеров, в виде взвеси в электролите и мб аэросил. Такие частицы в растущее покрытие включаются в больших количествах и делают его более твердым и износостойким. Из-за малых размеров таких частиц они практически не влияют на блеск. В случае образования пор, коррозия идет до тех участков, где находятся частицы порошка. Частица непроводящая, сопротивление коррозионному процессу на этих участках резко возрастает и коррозионный процесс затухает. Часто покрытие никель-сил наносится в качестве подслоя под тонкое хромовое покрытие, которое стабилизирует блеск на более длительный срок и формируется микропористым в результате чего в коррозионно активной среде из-за большой площади пор плотность тока коррозии уменьшится и покрытие остается в пассивном состоянии.
Эти виды многослойных покрытий в основном применяются для защитно-декоративной отделки автомобилей, приборов, изделий машиностроения и хим. промышленности.
Хромирование. Целевое назначение. Электролиты и их сравнительная характеристика
Распространенный процесс и используется как для защитно-декоративной отделки детали, так и в качестве самостоятельного покрытия, многослойные покрытия, но чаще как функциональное покрытие, потому что слой хрома обеспечивает очень высокую твердость, износостойкость, теплоустойчивость и хорошую коррозионную стойкость. Часто с помощью Cr-П восстанавливают изношенные детали машин, нанося слой хрома в несколько сотен микрон или несколько мм. Хром имеет «-» Ɛ (-0,71 В), но легко пассивируется и Ɛ становится более «+» 1,0 В. Значит в паре с другими Ме и Ме-основами - хром в качестве катодного покрытия, и защиту от коррозии осуществляет за счет толщины слоя и его беспористости. Толщина хрома выбирается в зависимости от вида и назначения детали: в многослойных П достаточно 1÷1,5 мкм (т.к. защитные свойства обеспечивают нижние слои), при однослойных 50÷60 мкм, для придания жаростойкости – несколько десятком мкм, для восстановления изношенных деталей машин – несколько сотен. Электролиты для хромирования не отличаются разнообразием – относятся к простым сильнокислым и созданы на основе CrO3. В кислой среде хромовый ангидрид образует различные хромовые кислоты, из которых идет восстановление Ме, но Ме получается лишь тогда, когда в состав электролита вводят добавки катализаторов. Самой простой добавкой является H2SO4. Если добавок катализаторов нет, то Вт→0 и весь ток идет на выделение Н2, поэтому электролиты хромирования называют по виду вводимого катализатора. Если это H2SO4 – сульфатные, сернокислые электролиты, кремниевокислые – саморегулирующиеся. Если часть хромовой кислоты нейтрализована щелочью, то называются тетрахроматные. Все электролиты хромирования отличаются плохой РС и возникают проблемы при нанесении покрытия на деталь сложного профиля. Кроме того, при хромировании требуются очень высокие плотности тока, часто в 10 раз выше, чем для других процессов и 80-100 А/дм2 и более – нормальные рабочие. Но несмотря на высокие плотности тока, Вт остается очень маленьким и почти не превышает 30%, уменьшается с увеличением концентрации хромого ангидрида. Поэтому растворимые хромовые аноды, которые бы поставляли ионы хрома, здесь применять нельзя. Значит, надо использовать нерастворимые коррозионно стойкие аноды (Pd и его сплавы). Надежно процесс идет только при наличии добавок катализаторов неорганических веществ. В их присутствии ионы хрома восстанавливаются до Ме. Без катализаторов выделяется лишь один водород. Но важно четко поддерживать соотношение между ионами хрома и количеством катализатора (100:1). Оно может нарушаться, т.к. ионы хрома тратятся на получение Ме-П. Стало быть, такой электролит хромирования нужно постоянно корректировать по CrO3 исходя из количества прошедшего электричества. По структуре, качеству, механическим свойствам хромового покрытия можно управлять, меняя режим электролиза – плотность тока и температуру. В большинстве случаев Cr-П гладкое и блестящее в отсутствие спец.добавок.
Лекция 13: 9.12.2015
Механизм процесса хромирования
Процесс хромирования протекает при крайне низком Вт, т.к. в прикатодном пространстве протекают достаточно сложные превращения, причем отложения металлического хрома возможно лишь при наличии добавок катализаторов. Исходными ионами для восстановления хрома могут являться полихромовые кислоты, которые формируются в водной среде при растворении хромового ангидрида. Между этими кислотами устанавливаются разнообразные равновесия:

В
большинстве случаев преобладают
равновесия между:
 и при увеличении концентрации хромового
ангидрида начинают преобладать ионы
хроматов. Если вести электролиз раствора
хромового ангидрида, то металлического
хрома нет и весь ток на выделение Н2.
и при увеличении концентрации хромового
ангидрида начинают преобладать ионы
хроматов. Если вести электролиз раствора
хромового ангидрида, то металлического
хрома нет и весь ток на выделение Н2.

В
отсутствии катализатора на поверхности
преобладают при электролизе коллоидные
пленки, содержащие оксидные и гидроксидные
соединения
 и
и
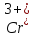 .
Восстановление хрома в любом случае
протекает ступенчато через образование
ионов
.
Восстановление хрома в любом случае
протекает ступенчато через образование
ионов
 .
Первое превращение из
.
Первое превращение из
 до
до
 идет достаточно быстро и легко, а второе
превращение из
идет достаточно быстро и легко, а второе
превращение из
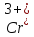 до Cr сильно заторможено и чувствительно
к состоянию поверхности. Если ионов
катализатора нет, то коллоидная пленка
содержит
до Cr сильно заторможено и чувствительно
к состоянию поверхности. Если ионов
катализатора нет, то коллоидная пленка
содержит
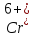 и накопившийся
и накопившийся
 ,
который не в состоянии восстанавливаться.
Пленка достаточно проницаема к раствору
и единственным процессом является
выделение Н2,
для хрома Вт=0. Если ввести ионы
,
который не в состоянии восстанавливаться.
Пленка достаточно проницаема к раствору
и единственным процессом является
выделение Н2,
для хрома Вт=0. Если ввести ионы
 ,
то характер восстановления сильно
меняется. Сам процесс начинается при
более «+»
Ɛ (участок аb), а заканчивается при более
«─» (участок cd). Следовательно, у
поверхности катода произошло видоизменение
пленки. Она помимо гидроксидных и
оксидных соединений содержит ионы
,
то характер восстановления сильно
меняется. Сам процесс начинается при
более «+»
Ɛ (участок аb), а заканчивается при более
«─» (участок cd). Следовательно, у
поверхности катода произошло видоизменение
пленки. Она помимо гидроксидных и
оксидных соединений содержит ионы
 .
На участке ab происходит восстановление
.
На участке ab происходит восстановление
 до
до
 .
Этот процесс идет достаточно легко, но
начиная с точки b,
поверхность обволакивается пленкой,
содержащей сульфат-ион. Состав этой
пленки был определен: на 66-70% состоит
из
.
Этот процесс идет достаточно легко, но
начиная с точки b,
поверхность обволакивается пленкой,
содержащей сульфат-ион. Состав этой
пленки был определен: на 66-70% состоит
из
 ,
на 15-20% из 3-х валентного хрома, остальное
сульфат-ионы. Эта пленка блокирует
поверхность и задерживает процесс
выделения Н2,
в результате чего достигается более
«-» Ɛ точки с, начиная с которой хром
восстанавливается до металлического
состояния. И если на 1-ом участке идет
только 1 процесс (
,
на 15-20% из 3-х валентного хрома, остальное
сульфат-ионы. Эта пленка блокирует
поверхность и задерживает процесс
выделения Н2,
в результате чего достигается более
«-» Ɛ точки с, начиная с которой хром
восстанавливается до металлического
состояния. И если на 1-ом участке идет
только 1 процесс ( в
в
 ),
то на последнем все возможные процессы
(
),
то на последнем все возможные процессы
( до
до
 ,
,
 до Cr,
выделение Н2).
Теорий, объясняющих такой эффект,
достаточно много. По одним считают, что
образуются при наличии катализатора
смешанные сульфатно-хроматные комплексы,
которые более активны и легче разряжаются.
По другим – при больших плотностях
тока прикатодное пространство быстро
подщелачивается и восстановившийся
до Cr,
выделение Н2).
Теорий, объясняющих такой эффект,
достаточно много. По одним считают, что
образуются при наличии катализатора
смешанные сульфатно-хроматные комплексы,
которые более активны и легче разряжаются.
По другим – при больших плотностях
тока прикатодное пространство быстро
подщелачивается и восстановившийся
 образует гидроокись, и из нее
восстанавливаться не может, а в
присутствии
образует гидроокись, и из нее
восстанавливаться не может, а в
присутствии
 эта гидроокись частично нейтрализуется.
В результате ионы
эта гидроокись частично нейтрализуется.
В результате ионы
 освобождаются и способны к восстановлению
до Ме. Третья теория: в ходе катодного
процесса начинают преобладать не
бихроматные комплексы, а хроматные
(CrO4),
которые легче разряжаются на катоде,
особенно в условиях наличия катализатора.
Несмотря на различия в теоретических
подходах, сам процесс хромирования
рассматривают состоящим из 3-х основных
реакций: восстановление хрома до
освобождаются и способны к восстановлению
до Ме. Третья теория: в ходе катодного
процесса начинают преобладать не
бихроматные комплексы, а хроматные
(CrO4),
которые легче разряжаются на катоде,
особенно в условиях наличия катализатора.
Несмотря на различия в теоретических
подходах, сам процесс хромирования
рассматривают состоящим из 3-х основных
реакций: восстановление хрома до
 ,
Ме (Cr), выделение Н2:
,
Ме (Cr), выделение Н2:
 ,
Вт=12-18%
,
Вт=12-18%
 ,
Вт=6-10%
,
Вт=6-10%
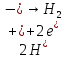 ,
Вт = остальное
,
Вт = остальное
Вт для этих процессов немного зависит от состава электролита, меньше от режима процесса и для основного процесса (1-ая реакция) Вт незначителен.
