
- •Список основных сокращений
- •Часть 1. Статическая биохимия тема 1. Строение, свойства, биологическая роль углеводов и липидов
- •1.1.1. Основные понятия биохимии
- •1.1.2. Основные разделы биохимии
- •1.1.3. Основные закономерности строения и метаболизма макромолекул в живых системах
- •1.1.4. Превращение энергии в живых клетках
- •1.1.5. Химические реакции в живых клетках
- •1.1.6. Строение, свойства, биологическая роль углеводов
- •1.1.6.1. Биологические функции углеводов
- •Слайд: Биологические функции углеводов
- •1.1.6.2. Моносахариды
- •Стереоизомерия моносахаридов
- •1.1.6.3. Олигосахариды
- •1.1.6.4. Полисахариды (гликаны)
- •1.1.7.1. Строение, свойства, биологическая роль липидов
- •1.1.7.2. Биологическая роль липидов
- •1.1.7.3. Нейтральные липиды (ацилглицеролы)
- •1.1.7.4. Жирные кислоты
- •1.1.7.5. Нейтральные диольные липиды
- •1.1.7.6. Нейтральные плазмалогены
- •1.1.7.11. Стероиды
- •1.1.7.12. Терпены
- •Тема 2. Строение, свойства, биологическая роль белков
- •2.1. Состав белков
- •2.2. Аминокислоты
- •2.3. Стереохимия аминокислот
- •2.4. Связи, стабилизирующие белковую молекулу
- •Пептидные связи
- •Часть молекулы полипептида Ионная связь
- •Дисульфидная связь
- •Водородная связь
- •2.5. Конформации белков
- •1.2.5.1. Первичная структура
- •1.2.5.2. Вторичная структура
- •1.2.5.3. Третичная структура
- •1.2.5.4. Четвертичная структура
- •1.2.5.5. Биологические функции белков
- •1.2.5.6. Классификация белков
- •1.2.5.7. Простые белки
- •1.2.5.8. Сложные белки
- •Тема 3. Строение, сворйства, биологическая роль нуклеотидов
- •1.3.1. Строение нуклеотидов. Компоненты нуклеотидов
- •1.3.2. Образование нуклеотида
- •1.3.3. Строение динуклеотидов и полинуклеотидов
- •Фрагмент полинуклеотида
- •1.3.3.1. Структура днк
- •1.3.3.2. Структура рнк
- •Тема 4. Витамины, ферменты
- •1.4.1. Витамины
- •1.4.1.2. Водорастворимые витамины витамин в1 (тиамин)
- •Витамин в2 (рибофлавин)
- •Витамин рр (в5) (никотинамид)
- •Витамин в6 (пиридоксин)
- •Витамин р (витамин проницаемости)
- •Витамин в12 (антианемический витамин, кобаламин)
- •Витамин с
- •Пантотеновая кислота (витамин в3)
- •Пара-аминобензойная кислота
- •Фолиевая кислота (витамин Вс)
- •1.4.1.2. Жирорастворимые витамины витамин а (ретинол)
- •Витамин d (антирахитический витамин)
- •Витамин е (витамин размножения, токоферол)
- •Витамин к (антигеморрагический витамин)
- •1.4.2. Ферменты
- •1.4.2.1. Химическая кинетика
- •1.4.2.2. Кинетика ферментативных реакций
- •1.4.2.3. Структура ферментов
- •1.4.2.4. Регуляция активности ферментов
- •1.4.2.5. Классификация ферментов
- •1. Оксидоредуктазы (окислительно-восстановительные реакции)
- •2. Трансферазы (перенос функциональных групп)
- •3. Гидролазы (реакции гидролиза)
- •1.5.1. Механизм действия гормонов
- •1.5.2. Гормоны гипоталамуса
- •Гормоны гипофиза
- •1.5.3. Гормоны поджелудочной железы
- •1.5.4. Гормоны щитовидной железы
- •1.5.5. Гормоны коры надпочечников
- •1.5.6. Гормоны мозгового вещества надпочечников
- •1.5.7. Гормоны половых желез
- •1.5.8. Гормоны паращитовидной железы
- •1.5.9. Гормоны тимуса (вилочковая железа)
- •Часть 2. Динамическая биохимия
- •Тема 6. Переваривание углеводов в пищеварительном тракте. Гликолиз. Окислительное декарбоксилирование пирувата
- •2.6.1. Метаболические пути и обмен энергии
- •А → б → в → г → д, где а - исходное вещество (предшественник), б, в, г – интермедиаты, д – конечный продукт.
- •2.6.2. Обмен углеводов
- •2.6.2.1. Переваривание углеводов
- •2.6.2.2. Всасывание моносахаридов
- •2.6.2.3. Транспорт углеводов в клетки
- •2.6.3. Гликолиз
- •Аденозинтрифосфорная кислота
- •Брожение и дыхание
- •Стадии гликолиза
- •Ферментативные реакции первой стадии гликолиза
- •1. Фосфорилирование d-глюкозы за счет атф
- •Полный баланс гликолиза
- •2.6.4. Гликогенолиз
- •Тема 7. Аэробный метаболизм углеводов
- •2.7.1. Энергетика брожения и дыхания
- •2.7.2. Общая схема дыхания
- •2.7.3. Окисление пирувата до ацетил-КоА
- •2.7.4. Цикл трикарбоновых кислот (цикл Кребса)
- •Цитрат-синтаза
- •Аконитазное равновесие
- •Изоцитратадегидрогеназа
- •Окисление -кетоглутарата до сукцината
- •Сукцинатдегидрогеназа
- •Фумараза
- •Окисление малата до оксалоацетата
- •Баланс одного оборота цикла Кребса
- •2.7.5. Перенос электронов и окислительное фосфорилирование
- •2.7.6. Путь переноса электронов – дыхательная цепь
- •Баланс энергии
- •2.7.7. Хемиосмотическая гипотеза Митчелла
- •Тема 8. Липидный обмен
- •2.8.1. Превращение липидов в процессе пищеварения
- •2.8.2. Всасывание продуктов переваривания липидов и ресинтез липидов в кишечной стенке
- •2.8.3. Внутриклеточные процессов расщепления и синтеза липидов различных классов
- •2.8.4. Обмен триглицеридов и холестерина в тканях
- •2.8.5. Интеграция и регуляция метаболизма липидов
- •2.8.6. Нарушение обмена липидов при ожирении
- •Тема 9. Белковый обмен
- •2.9.1. Общие представления об обмене белков
- •2.9.2. Пищеварение белков
- •2.9.3. Синтез белков
- •2.9.4. Внутриклеточный распад белков
- •2.9.5. Пути выведения аммиака из организма
- •Тема 10. Интеграция клеточного обмена
- •2.10.1. Взаимосвязь процессов обмена углеводов, липидов, белков
- •2.10.2. Внутриклеточная регуляция обмена веществ
- •2.10.3. Нервная и гормональная регуляция обмена веществ
- •Часть 3. Спортивная биохимия тема 11. Биохимия мышечного сокращения
- •3.11.1. Типы мышечных волокон
- •3.11.2. Ультраструктура мышечного волокна
- •Тема 12. Энергетическое обеспечение мышечной деятельности
- •3.12.1. Креатинфосфокиназный механизм ресинтеза атф
- •3.12.2. Гликолитический механизм ресинтеза атф
- •3.12.3. Миокиназный механизм ресинтеза атф
- •3.12.4. Аэробный механизм ресинтеза атф
- •3.12.5. Соотношение анаэробных и аэробных механизмов ресинтеза атф при мышечной нагрузке
- •3.12.6. Биохимические факторы спортивной работоспособности
- •Тема 13. Биохимические изменения в организме при работе различного характера. Биохимические изменения при утомлении.
- •3.13.1. Общие изменения в организме при физической нагрузке
- •3.13.2. Биохимические изменения в мышцах при физической нагрузке
- •3.13.3. Систематизация упражнений по характеру биохимических изменений при физической работе
- •3.13.4. Биохимические изменения при утомлении
- •Тема 14. Биохимические превращения в период восстановления после мышечной работы
- •3.14.1. Срочное и отставленное восстановление
- •Тема 15. Закономерности биохимической адаптации под влиянием систематической тренировки
- •Сверхотягощение
- •Специфичность
- •3.15.3. Принцип обратимости действия
- •3.15.4. Принцип положительного взаимодействия
- •3.15.5. Принцип цикличности
- •Тема 16. Биохимический контроль при занятиях физической культурой
- •3.16.1. Биохимический контроль развития систем энергообеспечения организма и уровнем тренированности, утомления и восстановления организма
- •3.16.2. Контроль за применением допинга в спорте
- •Тема 17. Биохимические основы силы, быстроты и выносливости
- •3.17.1. Морфологические и биохимические основы скоростно-силовых качеств
- •3.17.2. Биохимические основы методов скоростно-силовой подготовки спортсменов
- •3.17.3. Биохимические основы выносливости
- •3.17.4. Методы тренировки, способствующие развитию выносливости
- •Тема 18. Биохимическое обоснование методики занятий физической культурой и спортом с лицами разного возраста. Биохимические основы рационального питания при занятиях физической культурой.
- •3.18.1. Биохимическое обоснование методики занятий физической культурой и спортом с лицами разного возраста
- •3.18.2. Биохимические основы рационального питания спортсменов
2.2. Аминокислоты
Общим признаком, характерным для всех аминокислот, входящих в состав белков (исключение - пролин) является наличие свободной карбоксильной группы и свободной незамещенной аминогруппы у углеродного атома.
Общая формула аминокислот
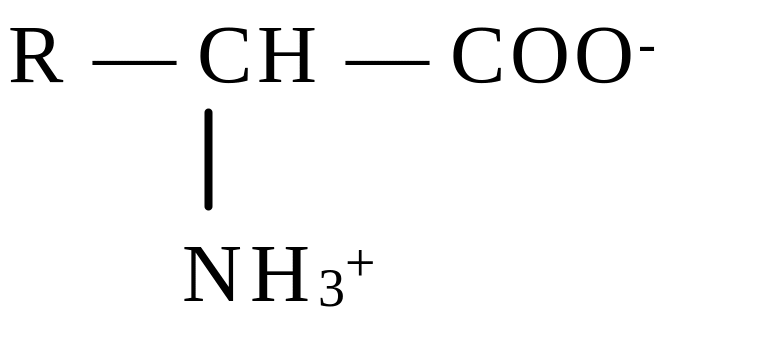
Каждая аминокислота содержит характерную R-группу. Она определяет уникальные свойства каждой аминокислоты. У большей части аминокислот имеются одна карбоксильная и одна аминогруппа, эти аминокислоты называются нейтральными. У основных аминокислот более чем одна аминогруппа, у кислых аминокислот - более чем одна карбоксильная группа.
Аминокислоты подразделяются на 4 основные класса: 1) неполярные, или гидрофобные (аланин, валин, лейцин,изолейцин, пролин, фенилаланин, триптофан, метионин), 2) полярные, но не заряженные (глицин, серин, треонин, цистеин, тирозин, аспарагин, глутамин), 3) положительно заряженные (лизин, гистидин, аргинин), 4) отрицательно заряженные (аспарагиновая кислота, глутаминовая кислота).
Аминокислоты – это бесцветные кристаллические твердые вещества, плавятся или разлагаются при сравнительно высоких температурах - выше 200С. Они лучше растворяются в воде, чем в менее полярных растворителях. В нейтральных водных растворах аминокислоты существуют в виде биполярных ионов – цвиттерионов и ведут себя как амфотерные соединения, т.е. проявляют свойства кислот и оснований. Амфотерная природа аминокислот существенна в биологическом значении, т.к. означает, что аминокислоты могут выполнять роль буферов. В зависимости от условий они могут выступать в роли доноров протонов водорода и в роли их акцепторов.
2.3. Стереохимия аминокислот
Все аминокислоты обладают оптической активностью, т.е. способностью вращать плоскость поляризованного луча. Оптической активностью обладают все соединения, способные существовать в двух формах, представляющих по своей структуре несовместимые зеркальные отражения друг друга. Все стереоизомеры аминокислот структурно соответствуют 2 изомерам глицеральдегида. Стереоизомеры, соответствующие L-глицеральдегиду, обозначаются буквой L, а стереоизомеры D-глицеральдегида - буквой D. Таким образом, символы D и L соответствуют абсолютной конфигурации, а не направлению вращения. Все встречающиеся в белках аминокислоты принадлежат к L-ряду. D-аминокислоты могут встречаться в клетках.
2.4. Связи, стабилизирующие белковую молекулу
Аминокислоты способны образовывать связи с различными реакционно-способными группами. Это свойство важно для структуры белков.
Пептидные связи
Пептидная связь образуется в результате выделения молекулы воды при взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой. Реакция с выделением воды называется реакцией конденсации, а возникающая ковалентная азот-углеродная связь – пептидной. Соединение, образующееся в результате конденсации двух аминокислот, называется дипептидом. На одном конце его молекулы находится свободная аминогруппа, на другом конце – свободная карбоксильная группа. Если таким образом соединяется много аминокислот, то такое соединение называется полипептид.
R1 H

 H
| O
H |
O
H
| O
H |
O


 N
–––– C ––––– C
N ––– C –––– C
N
–––– C ––––– C
N ––– C –––– C
 H
| OH
H |
OH
H
| OH
H |
OH
 H
R2
H
R2
 Конденсация
Конденсация
 H2O
H2O
R1 O H
 H
| || |
O
H
| || |
O
 N
–––– C –––––– C –––––– N ––––
C –––– C Дипептид
N
–––– C –––––– C –––––– N ––––
C –––– C Дипептид
H | | | OH
H H R2
R1 O R3
| H || |


 CH
N
C
CH
CH
N
C
CH
N C CH N C
H || | H ||
O R2 O
