
- •660025, Г. Красноярск, ул. Вавилова, 66 а
- •1.1.Распространение в природе и получение
- •1.2 Физические свойства
- •Химические свойства
- •Соединения s – металлов
- •1.6.Применение
- •Элементы іііа – группы
- •Распространение в природе и получение
- •Физические свойства
- •Химические свойства
- •Соединения металлов
- •2.1.4. Применение
- •Глава 3. Химия переходных металлов
- •В периоде с ростом z восстановительные свойства металлов уменьшаются, достигая минимума у элементов iв группы (табл.3.1.). Тяжелые металлы viiiв и iв групп за свою инертность названы благородными.
- •3.1. Элементы iв группы
- •Химические свойства
- •Применение
- •3.2. Элементы подгруппы II в
- •3.2.1.Распространение в природе и получение
- •3.2.2.Физические свойства
- •3.2.3. Химические свойства По химическим свойствам Zn и его аналоги менее активны, чем подгруппа Са. В ряду от Zn к Hg-химическая активность металлов уменьшается (см. Табл.3.3.).
- •3.2.4. Соединения металлов
- •3.2.5. Применение
- •3.3. Элементы подгруппы iiia
- •3.3.1. Способы получения
- •3.3.2.Физические и химические свойства
- •3.3.3. Соединения металлов
- •3.3.4. Применение
- •3.4. Элементы подгруппы ivb
- •3.4.1.Распространение в природе и получение
- •3.4.2.Физические свойства
- •3.4.3. Химические свойства
- •3.4.4. Соединения металлов
- •3.4.5. Применение
- •3.5. Элементы подгруппы vb
- •3.5.1.Распространение в природе и получение
- •3.5.1.Физические свойства
- •3.5.2. Химические свойства
- •3.5.4. Cоединения металлов
- •3.5.5.Применение
- •3.6. Элементы подгруппы viв
- •3.6.1. Распространение в природе и получение
- •В промышленности чистый хром получают из хромистого железняка:
- •Вольфрам, молибден получают из соответствующих оксидов, например:
- •3.6.2.Физические свойства
- •3.6.3. Химические свойства
- •3.6.4. Соединения металлов
- •3.6.5. Применение
- •3.8. Элементы подгруппы VII b
- •3.8.1. Распространение в природе и получение
- •3.8.2.Физические свойства
- •3.8.4. Химические свойства
- •3.8.5.Соединения металлов
- •3.8.6. Применение
- •3.9.2. Физические свойства
- •3.9.3. Химические свойства
- •3.9.4.Соединения металлов
- •3.9.5. Применение
- •3.9. Элементы VIII в группы (платиновые металлы)
- •3.9.1. Распространение в природе и получение
- •В виде соединений находятся в Си- Ni сульфидных рудах.
- •3.9.2. Физические свойства
- •3.9.3. Химические свойства
- •3.9.4.Соединения металлов
- •3.9.5.Применение
- •Глава 4. Лантаноиды и актиноиды
- •4.1. Электронные конфигурации атомов лантаноидов и актиноидов и их свойства.
- •4. 1.1.Монотонно изменяющиеся
- •4.1.2.Периодически изменяющиеся свойства
- •4.2.Распространение f - элементов в природе и получение
- •4.3.Разделение смеси соединений лантаноидов (актиноидов)
- •4.3.1.Ионообменная хроматография
- •4. 3.2.Жидкостная экстракция
- •4.3.3.Разделение по изменению степени окисления
- •4.4.Физические свойства
- •4.5.Химические свойства
- •4.6.Соединения f-металлов
- •4.7.Применение
3.8.6. Применение
Марганец входит в состав сплавов, обладающих ценными свойствами. Так, манганин (сплав марганца с медью и никелем) обладает ничтожно малым температурным коэффициентом электросопротивления и другими свойствами, ценными для электроизмерительной аппаратуры. Из сплавов Гейслера (А1-Мп) изготавливают сильные постоянные магниты.
Диоксид марганца широко используют в качестве окислителя (деполяризатора) в химических источниках тока. Перманганат калия применяют как окислитель во многих органических синтезах, в аналитической химии (перганатометрия), в медицине. Соединения марганца входят в состав многих катализаторов, в том числе ускорителей «высыхания» масляной краски (масло, входящее в состав краски, окисляется кислородом воздуха, образуя при этом полимер).
Технеций вследствие его радиоактивности и трудности выделения не получил пока большого применения. Наиболее важным соединением технеция является пертехнат натрия NaTcO4 - очень эффективный ингибитор коррозии металлов, применяющийся для защиты от коррозии важнейших узлов ядерных реакторов, точных приборов и т. д. Тс- как конструктивный материал в реакторооборудовании, используется для пассивации черных металлов.
Рений — металл, обладающий исключительно ценными свойствами (тугоплавкость, механическая прочность, хорошая электропроводность, устойчивость к действию химических реагентов и др.). Рений используют в вакуумной электротехнике; добавка его к вольфраму делает нить для ламп накаливания более долговечной. Из железных листов с электролитическим рениевым покрытием изготовляют цистерны и баки для перевозки соляной кислоты. Рений и его соединения используют в химической промышленности в качестве катализаторов. Сплавы рения с W, Мо, Та, Ir, Pt, Os, Ni тугоплавки, нелетучи, механически прочны, трудно окисляются, устойчивы к действию различных химических реагентов, поэтому их широко применяют для изготовления термопар, ювелирных изделий, деталей сверхзвуковых самолетов, ракет и точных приборов, для антикоррозионных покрытий, в производстве ТV и др.
Вопросы и упражнения
-
В виде каких соединений встречается молибден? Как получить оксид молибдена (VI) из дисульфида молибдена и молибден из оксида молибдена (VI). Составьте уравнения реакций.
-
Как изменяются окислительные и восстановительные свойства в подгруппе?
-
Какие свойства проявляют перманганаты? Какие продукты они образуют в зависимости от среды?
-
Какие оксиды образует марганец и рений?. Как изменяются свойства оксидов марганца с повышением степени окисления? Напишите уравнения их взаимолдействия со щелочами и кислотами.
-
Как изменяется окислительная активность в ряду соединений в высшей степени окисления от марганца к рению?
-
Кто легче окислится кислородом воздуха манганат калия или ренат калия? Составьте уравнение реакции.
-
Определите роль диоксида марганца в реакциях:
МnО2 + СО2 +КJ =J2 + MnCO3 +KHCO3
MnO2 +NH3 = Mn2O3 +N2 + H2O
-
Определите продукты реакции:
МnО2
+KNO3
+ Na2CO3![]() NO2+….
NO2+….
MnO2 +O2 + KOH = …..
Mn(NO3)2 + NaBiO3 + HNO3 = HMnO4 +….
-
Рассчитайте при какой температуре возможен процесс:
WO3 + 3H2 = W + 3H2O
-843 0 0 -242 H0298,кДж/моль
76,1 130,7 32,6 189 S0298, Дж/(мольград)
-
Рассчитайте сколько выделится магния при пропускании тока силой 1А в течении 10 ч через раствор сульфата марганца.
3.9. Элементы VIII В группы (подгруппа железа)
К d- элементам 8 группы побочной подгруппы относятся:
Fe Co Ni
Ru Rh Pd
Os Jr Pt
Они образуют три триады в соответствии с периодами, в которых расположены. Рассмотрение свойств этих элементов целесообразно вести по периодам, что соответствует и их применению в технике.
Свойства их закономерно изменяются в соответствии с заполнением электронами d-подуровня и в пределах электронных аналогий. Поэтому
Fe - Co - Ni – семейство железа
Ru - Rh – Pd - легкие платиновые металлы
Os - Jr – Pt - тяжелые платиновые металлы.
3.9.1.Распространение в природе и получение
Железо один из самых распространенных (после А1) металлов, содержание в земной коре составляет 4,65 мас.%. Co и Ni встречается значительно реже –210-3 мас.%.
Основные минералы: Fe2О3 - красный железняк, (гематит); Fe3О4 - магнитный железняк; или магнетит, СuFeS2 – халькоперит; FeСО3 - сидерит; FeS2 –пирит (железный колчедан).
Кобальт входит в состав полиметаллических руд, сопутствующих Сu, Ni, Fe. Встречается в вине минералов: СоS2 - кобальт-пирит; СоAsS - кобальтовый блеск.
Минералы никеля: NiS - миллерит; NiAsS-никелевый блеск; NiAs2- купферникель, NiО -бунзенит.
Сплавы на основе железа принято называть черными металлами, а их производство – черной металлургией.
Выплавка чугуна производится в доменных печах (домнах).
Доменный процесс. Схема химических реакций, протекающих в различных частях доменной печи, представлена на рис. 3.3.
В доменную печь через верхнее отверстие - колошник - загружают шихту, которая состоит из чередующихся слоев руды, кокса и флюсов. Кокс служит источником теплоты, необходимой для процесса восстановления руды; из него же образуется оксид углерода (II), играющий роль восстановителя.
Флюсы необходимы для превращения находящейся в руде пустой породы (кремнезем, глина) в легкоплавкие соединения - шлаки. В нижней части домны, куда поступает воздух, предварительно нагретый до 600...800 °С, интенсивно сгорает кокс; образующийся диоксид углерода проходит через раскаленный кокс и превращается в оксид углерода (II):
С + О2 = СО2 и СО2 + С = 2СО
Восстановление оксида железа (III) до железа можно представить в виде схемы Fe2O3 Fe3O4 FeO Fe.
Выделяющееся из руды свободное железо постепенно опускается вниз и при температуре около 1200 °С плавится, растворяя уголь. Одновременно образуется карбид железа, или цементит, Fe3C, который также растворяется в расплавленном металле:
3Fe + 2СО = Fe3C + СО2 и 3Fe + С = Fe3C
Так происходит насыщение железа углеродом и образование чугуна.Находящиеся в руде соединения марганца, кремния и фосфора восстанавливаются раскаленным углем:
МnО + С = Мn + СО
SiO2 + 2С = Si + 2CO
Р2О5 + 5С = 2Р + 5СО
Часть марганца, кремния и серы (из золы) уходит в шлак, остальная часть этих элементов и почти весь фосфор растворяются в расплавленном чугуне.
В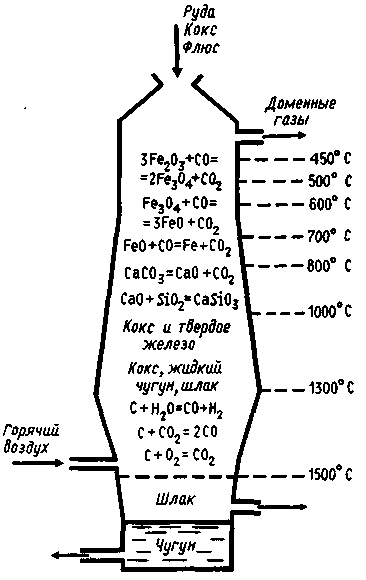 качестве флюса для удаления пустой
породы применяется известняк СаСО3,
который при высокой температуре
разлагается до СаО.
качестве флюса для удаления пустой
породы применяется известняк СаСО3,
который при высокой температуре
разлагается до СаО.
Взаимодействуя с пустой породой (SiO2, A12O3 и другие оксиды), оксид кальция образует шлак - смесь силикатов и алюминатов кальция.
Расплавленный чугун и шлак стекают в нижнюю часть домны. Состав: Fe 95%; C 4,5%; Si 3%; Mn 2,5%; вредных примесей : S до 0,08%; P до 2,5 %;
Шлак как более легкий собирается над чугуном, предохраняя его тем самым от окисления поступающим в домну кислородом.
Рис. 3.3. Схема доменного процесса
Чугун и шлак выпускают из доменной печи раздельно через расположенные на разных уровнях отверстия.
Различают следующие виды чугуна.
Литейный. Его применяют для отливки машинных станин, плит и т. д. Он содержит углерод в виде графита и на изломе имеет серый цвет. С этим связано его название серый чугун.
Передельный. Этот чугун идет для дальнейшей переработки в сталь. Углерод находится в нем в виде цементита Fe3C. Передельный чугун светлее серого и потому называется белым чугуном.
Специальный. Этот чугун используют в производстве высококачественной стали.
Получаемый в доменной печи шлак находит применение в производстве цемента и других строительных материалов.
Сплавы Fe с углеродом называются сталями.
Производство стали. В процессе переработки чугуна в сталь из чугуна удаляется избыток углерода, серы, фосфора, кремния, марганца и других элементов. Это осуществляется тремя способами: кислородно-конвертерным, мартеновским и электрометаллургическим.
При переработке чугунов кислородно-конвертерным способом в конвертер заливают жидкий чугун и продувают кислород под давлением (4...5)105 Па, при этом основная масса примесей окисляется. Летучие оксиды (СО, СО2 и SO2) уносятся газовым потоком, а оксиды металлов и фосфора переходят в шлак. Конвертерный способ отличается высокой производительностью, но этим способом можно получить только сравнительно низкосортную сталь, так как кратковременность процесса не позволяет регулировать состав стали во время плавки. Длительность цикла составляет 30 мин. Выход 300 т стали. Более дешевый способ.
В мартеновском способе используют твердые окислители - оксиды железа, содержащиеся в руде, окалине и скрапе (металлоломе). Мартеновский процесс проводят в специальных печах, которые нагреваются пламенем, получаемым при сжигании горючих газов над поверхностью нагреваемой массы.
В мартеновскую печь загружают чугун, руду и скрап в таком соотношении, чтобы кислорода оксидов железа было достаточно для окисления определенного количества примесей. Флюсы подбирают так, чтобы шлак был кислым или основным - в зависимости от характера выводимых примесей. В течение плавки периодически берут пробы расплавленной стали, определяют ее состав и вносят необходимые компоненты в виде ферросплавов (сплавов железа с различными металлами и неметаллами, такими, как никель, марганец, титан, молибден, вольфрам, хром, кремний и др.). Плавка протекает 10 час. (200-500т). Сталь более высокого качества.
Специальные стали выплавляют в электрометаллургических печах, отличающихся от пламенных тем, что источником тепла в них является электрический ток, что позволяет достичь более высокой температуры, поэтому в них выплавляют тугоплавкие стали.
Все стали классифицируются по химическому составу и назначению. По химическому составу стали делятся на углеродистые и специальные, содержащие кроме углерода, серы, фосфора, марганца и кремния, имеющихся в углеродистых сталях, легирующие элементы - никель, хром, ванадий, вольфрам, молибден. Они улучшают свойства стали. Так, хром повышает ее твердость, прочность и устойчивость к действию кислот; никель - механическую прочность и вязкость; вольфрам - твердость; ванадий - вязкость и упругость; титан - термостойкость; молибден, улучшает механические свойства.
По назначению стали делятся на инструментальные, строительные, или конструкционные, применяемые для изготовления машин и аппаратов, и стали специального назначения.
Качество стальных изделий можно улучшить термической обработкой, цементацией, азотированием, алитированием и нанесением других антикоррозионных покрытий.
При термической обработке стали используют ее свойство изменять структуру с изменением температуры. Если нагретую сталь охлаждать постепенно, то ее кристаллическая структура резко меняется. При низкой температуре сталь отличается низкой твердостью и прочностью. Если же нагретую до высокой температуры сталь охладить резко, то сохранится структура, характерная для высокой температуры. Этот процесс называется термической закалкой. Сталь, подвергнутая такой обработке, очень твердая и прочная. Для каждого сорта стали существуют свои условия термической закалки: скорость и температура нагрева, скорость охлаждения. Если сталь, прошедшую термическую закалку, снова нагреть до высокой температуры и медленно охладить, то она теряет приобретенные вследствие закалки механические свойства, становится мягкой. Такой процесс называется отпуском стали.
Цементация — процесс получения на поверхности изделия карбида железа, отличающегося высокой твердостью. Такое изделие имеет в середине мягкое железо, а на поверхности - очень твердый карбид. Процесс цементации осуществляют длительным нагреванием изделия в атмосфере монооксида углерода или в ящиках, наполненных древесными опилками.
Азотирование - процесс, аналогичный цементации: изделие подвергают длительному нагреванию в атмосфере аммиака.
Алитирование - процесс покрытия поверхности изделия алюминием.
Большая дороговизна коксующих углей заставляет искать другие способы получения Fe. Так, прямое восстановление руд смесью СО и Н2, получаемых конверсией природного газа или углей. Образуется губчатое железо, переплавкой которого в электропечах, минуя стадию получения чугуна, получают сталь.
В лабораторных условиях – железо можно получить электролизом растворов FeSO4 или FeCI3, а также восстановлением водородом оксидов и гидроксидов:
Fe2О3
+ Н2![]() 2
Fe + 3 Н2О или
2
Fe + 3 Н2О или
2Fe(ОН)3 + 3Н2![]() 2
Fe + 6Н2О
2
Fe + 6Н2О
Кобальт из мышьяковистых, никель из медно-никелевых сульфидных руд получают окислительной плавкой с последующим восстановлением их оксидов водородом:
Со2О3
+ 3 Н2
![]() СО
+ 3 Н2О , NiО + Н2
СО
+ 3 Н2О , NiО + Н2
![]() Ni + СО2
Ni + СО2
или электролизом раствора NiSO4.
Сверхчистые металлы получают восстановлением карбонилов Fe(СО)5 или Ni (СО)4 , при Р=250 атм, t=200 0С, например:
Fe (СО)5![]() Fe + 5СО
Fe + 5СО
