
- •660025, Г. Красноярск, ул. Вавилова, 66 а
- •1.1.Распространение в природе и получение
- •1.2 Физические свойства
- •Химические свойства
- •Соединения s – металлов
- •1.6.Применение
- •Элементы іііа – группы
- •Распространение в природе и получение
- •Физические свойства
- •Химические свойства
- •Соединения металлов
- •2.1.4. Применение
- •Глава 3. Химия переходных металлов
- •В периоде с ростом z восстановительные свойства металлов уменьшаются, достигая минимума у элементов iв группы (табл.3.1.). Тяжелые металлы viiiв и iв групп за свою инертность названы благородными.
- •3.1. Элементы iв группы
- •Химические свойства
- •Применение
- •3.2. Элементы подгруппы II в
- •3.2.1.Распространение в природе и получение
- •3.2.2.Физические свойства
- •3.2.3. Химические свойства По химическим свойствам Zn и его аналоги менее активны, чем подгруппа Са. В ряду от Zn к Hg-химическая активность металлов уменьшается (см. Табл.3.3.).
- •3.2.4. Соединения металлов
- •3.2.5. Применение
- •3.3. Элементы подгруппы iiia
- •3.3.1. Способы получения
- •3.3.2.Физические и химические свойства
- •3.3.3. Соединения металлов
- •3.3.4. Применение
- •3.4. Элементы подгруппы ivb
- •3.4.1.Распространение в природе и получение
- •3.4.2.Физические свойства
- •3.4.3. Химические свойства
- •3.4.4. Соединения металлов
- •3.4.5. Применение
- •3.5. Элементы подгруппы vb
- •3.5.1.Распространение в природе и получение
- •3.5.1.Физические свойства
- •3.5.2. Химические свойства
- •3.5.4. Cоединения металлов
- •3.5.5.Применение
- •3.6. Элементы подгруппы viв
- •3.6.1. Распространение в природе и получение
- •В промышленности чистый хром получают из хромистого железняка:
- •Вольфрам, молибден получают из соответствующих оксидов, например:
- •3.6.2.Физические свойства
- •3.6.3. Химические свойства
- •3.6.4. Соединения металлов
- •3.6.5. Применение
- •3.8. Элементы подгруппы VII b
- •3.8.1. Распространение в природе и получение
- •3.8.2.Физические свойства
- •3.8.4. Химические свойства
- •3.8.5.Соединения металлов
- •3.8.6. Применение
- •3.9.2. Физические свойства
- •3.9.3. Химические свойства
- •3.9.4.Соединения металлов
- •3.9.5. Применение
- •3.9. Элементы VIII в группы (платиновые металлы)
- •3.9.1. Распространение в природе и получение
- •В виде соединений находятся в Си- Ni сульфидных рудах.
- •3.9.2. Физические свойства
- •3.9.3. Химические свойства
- •3.9.4.Соединения металлов
- •3.9.5.Применение
- •Глава 4. Лантаноиды и актиноиды
- •4.1. Электронные конфигурации атомов лантаноидов и актиноидов и их свойства.
- •4. 1.1.Монотонно изменяющиеся
- •4.1.2.Периодически изменяющиеся свойства
- •4.2.Распространение f - элементов в природе и получение
- •4.3.Разделение смеси соединений лантаноидов (актиноидов)
- •4.3.1.Ионообменная хроматография
- •4. 3.2.Жидкостная экстракция
- •4.3.3.Разделение по изменению степени окисления
- •4.4.Физические свойства
- •4.5.Химические свойства
- •4.6.Соединения f-металлов
- •4.7.Применение
3.3.1. Способы получения
В земной коре элементы подгруппы скандия очень распылены и отдельных минералов не образуют. Получают их обычно электролизом расплавов хлоридов или чаще металлотермической обработкой хлоридов и оксидов:
Э2О3
+
3Mg
![]() 2Э +3MgO
2Э +3MgO
2ЭГ3+ЗСа
![]() 2Э + ЗСаF2
2Э + ЗСаF2
AcF3+3Li
![]() Ac
+ 3LiF
Ac
+ 3LiF
Ас также искусственным путем в ядерных реакторах:
![]()
3.3.2.Физические и химические свойства
В виде простых веществ элементы подгруппы скандия - белые металлы (см. табл.3.45)
Tаблица 3.5.
Некоторые свойства элементов подгруппы скандия
|
Металл |
Rат, нм |
Плотность, г/см3 |
Jион., эВ |
Стандартный элект-родный потенциал процесса: Э+3 +3е = Э, В |
Tпл.,0С |
Tкип.0C |
Содержание в земной коре, % |
|
Sc |
0,164 |
3,02 |
6,56 |
2,08 |
1541 |
2850 |
3·104 |
|
Y |
0,181 |
4,47 |
6,21 |
2,37 |
1528 |
3322 |
2,6·104 |
|
La |
0,187 |
6,17 |
5,57 |
2,52 |
920 |
3450 |
2,5·104 |
|
Ac |
0,203 |
10,1 |
5,12 |
2,6 |
1050 |
3590 |
5·1015 |
Это весьма активные металлы, уступая по химической активности только щелочным и щелочноземельным металлам. При более сильном нагревании они все реагируют с большинством неметаллов, а при сплавлении - с металлами. Эти реакции можно представить в виде схемы:
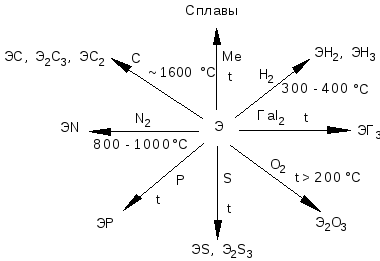
В ряду Sc Y La Ас активность заметно возрастает, о чем свидетельствует значения их электродных потенциалов (см. табл.3.4.).
Скандий вследствие пассивирования с водой не реагирует, а лантан уже при обычных условиях медленно разлагает воду:
2 La + 6 H2O = 2 La(OH)3 + 3H2
С основными кислотами (HF, H2SO4, HNO3, CH3COOH) металлы реагируют уже на холоде, медленно окисляются на воздухе,- резко увеличивают свою активность при нагревании.

Все металлы легко взаимодействуют с разбавленными кислотами (HCL, H2SO4, HNO3) причем в разбавленной азотной кислоте выделяется нитрат аммония:
8Sc + 30 HNO3 = 8 Sc (NO3)3 + 3 NH4NO3 + 9 H2O
Химически инертны в растворах щелочей.
3.3.3. Соединения металлов
Практически во всех своих соединениях элементы группы III B проявляют степень окисления +3. При этом устойчивость бинарных соединений от Sc к Ас растет. Соединения Э3+ чаще всего белые кристаллические вещества.
Соединения с неметаллами. Скандий и его аналоги образуют с бором, углеродом, кремнием, азотом, фосфором, серой тугоплавкие соединения, часто с металлическими свойствами, например ScN, LaC2, Sc5Si3, Sc3Si5, ScSi2,YB2, YB6,LaB6. Многие из них не обладают стехиометрическим составом.
Гидриды. Это в основном твердые соединения типа ЭН2 (при недостатке водорода) и ЭН3 (при избытке); электропроводны. Гидриды ЭН2 легко окисляются кислородом и реагируют с водой:
ЭН2 + 6Н2О = 2Э (ОН)3 + 5Н2
Галогениды. При обычных условиях это— твердые вещества, причем температура плавления фторидов (~1400°С) существенно выше, чем остальных галогенидов (от 700 до 1000 °С). Фториды в отличие от остальных соединений этого типа негигроскопичны и нерастворимы в воде. Устойчивость соединений в ряду ЭГ3, ЭСI 3, ЭВг3, ЭI3 убывает.
Галогениды ЭГ3 (Г = СI, Вг, I) гидролизуются обычно по схеме:
ЭГ3 + 3Н2О = Э(ОН)3 + 3НГ
При нагревании образуются оксогалогениды типа ЭОГ.
Оксиды. Все оксиды тугоплавкие белые кристаллические вещества, плохо растворимые в воде и щелочах и хорошо — в разбавленных кислотах, особенно при нагревании. Некоторые свойства оксидов приведены ниже:
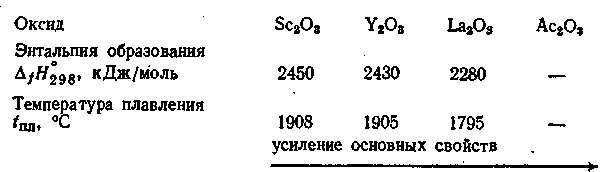
С водой оксиды взаимодействуют по схеме:
Э2О3 + 3Н2О = 2Э(ОН)3, H0
Это взаимодействие усиливается в ряду Sc2O3, Y2O3, La2O3, Ac2O3.
Гидроксиды. При обработке солей Э+3 растворами щелочей (или водным аммиаком) получаются белые студнеобразные осадки Э(ОН)3, трудно растворимые в воде, но растворимые в минеральных кислотах. При нагревании они постепенно теряют воду и превращаются в оксиды:
2Э(ОН)3
![]() 2ЭООН
2ЭООН
![]() Э2О3
Э2О3
2Н2О Н2О
Исключая амфотерный Sc(OH)3, гидроксиды являются довольно сильными основаниями, причем основные свойства усиливаются от Sc(OH)a до Ас(ОН)3.
При обработке оксидов и гидроксидов минеральными кислотами образуются соответствующие соли Э+3. Многие из них выделяются в виде различных кристаллогидратов.
