
- •660025, Г. Красноярск, ул. Вавилова, 66 а
- •1.1.Распространение в природе и получение
- •1.2 Физические свойства
- •Химические свойства
- •Соединения s – металлов
- •1.6.Применение
- •Элементы іііа – группы
- •Распространение в природе и получение
- •Физические свойства
- •Химические свойства
- •Соединения металлов
- •2.1.4. Применение
- •Глава 3. Химия переходных металлов
- •В периоде с ростом z восстановительные свойства металлов уменьшаются, достигая минимума у элементов iв группы (табл.3.1.). Тяжелые металлы viiiв и iв групп за свою инертность названы благородными.
- •3.1. Элементы iв группы
- •Химические свойства
- •Применение
- •3.2. Элементы подгруппы II в
- •3.2.1.Распространение в природе и получение
- •3.2.2.Физические свойства
- •3.2.3. Химические свойства По химическим свойствам Zn и его аналоги менее активны, чем подгруппа Са. В ряду от Zn к Hg-химическая активность металлов уменьшается (см. Табл.3.3.).
- •3.2.4. Соединения металлов
- •3.2.5. Применение
- •3.3. Элементы подгруппы iiia
- •3.3.1. Способы получения
- •3.3.2.Физические и химические свойства
- •3.3.3. Соединения металлов
- •3.3.4. Применение
- •3.4. Элементы подгруппы ivb
- •3.4.1.Распространение в природе и получение
- •3.4.2.Физические свойства
- •3.4.3. Химические свойства
- •3.4.4. Соединения металлов
- •3.4.5. Применение
- •3.5. Элементы подгруппы vb
- •3.5.1.Распространение в природе и получение
- •3.5.1.Физические свойства
- •3.5.2. Химические свойства
- •3.5.4. Cоединения металлов
- •3.5.5.Применение
- •3.6. Элементы подгруппы viв
- •3.6.1. Распространение в природе и получение
- •В промышленности чистый хром получают из хромистого железняка:
- •Вольфрам, молибден получают из соответствующих оксидов, например:
- •3.6.2.Физические свойства
- •3.6.3. Химические свойства
- •3.6.4. Соединения металлов
- •3.6.5. Применение
- •3.8. Элементы подгруппы VII b
- •3.8.1. Распространение в природе и получение
- •3.8.2.Физические свойства
- •3.8.4. Химические свойства
- •3.8.5.Соединения металлов
- •3.8.6. Применение
- •3.9.2. Физические свойства
- •3.9.3. Химические свойства
- •3.9.4.Соединения металлов
- •3.9.5. Применение
- •3.9. Элементы VIII в группы (платиновые металлы)
- •3.9.1. Распространение в природе и получение
- •В виде соединений находятся в Си- Ni сульфидных рудах.
- •3.9.2. Физические свойства
- •3.9.3. Химические свойства
- •3.9.4.Соединения металлов
- •3.9.5.Применение
- •Глава 4. Лантаноиды и актиноиды
- •4.1. Электронные конфигурации атомов лантаноидов и актиноидов и их свойства.
- •4. 1.1.Монотонно изменяющиеся
- •4.1.2.Периодически изменяющиеся свойства
- •4.2.Распространение f - элементов в природе и получение
- •4.3.Разделение смеси соединений лантаноидов (актиноидов)
- •4.3.1.Ионообменная хроматография
- •4. 3.2.Жидкостная экстракция
- •4.3.3.Разделение по изменению степени окисления
- •4.4.Физические свойства
- •4.5.Химические свойства
- •4.6.Соединения f-металлов
- •4.7.Применение
3.4.4. Соединения металлов
Стабильность соединений Э+4 в пределах группы растет. Поэтому титан легко восстанавливается до более низких степеней окисления, а для циркония и гафния наиболее характерна степень окисления +4.
Оксиды. При нагревании в атмосфере кислорода титан, цирконий и гафний сгорают с образованием диоксидов ЭО2. Это белые тугоплавкие вещества: TiO2 (18550С) - ZrO2(26870С) - HfO2(27900С). В целом, они амфотерны, но кислотные и основные свойства выражены слабо. В ряду TiO2 - ZrO2 - HfO2 - основные свойства увеличиваются. Химически довольно инертны. На холоду не растворяются в воде, в щелочах и разбавленных кислотах (кроме HF). При длительном нагреве ЭО2 медленно взаимодействуют с концентрированными кислотами, а при сплавлении – со щелочами:
 осн.
Ti+4,
TiO+2
(титанил)
осн.
Ti+4,
TiO+2
(титанил)
T iO2
TiO2
+ 2Н2SO4
= Ti(SO4)2
+H2O
iO2
TiO2
+ 2Н2SO4
= Ti(SO4)2
+H2O
Ti(OН)4 +2Н2SO4 = TiOSO4 + H2O
кисл. TiO32-
TiO2
+2 NaOH
![]() Na2TiO3
+ H2O
Na2TiO3
+ H2O
Для титана известны оксиды TiО и Ti2О3. Они получаются восстановлением TiO2 металлическим титаном. Связь в них преимущественно ионная. Это основные оксиды.
Гидроксиды подгруппы титана можно выразить формулой Э(ОН)4. Фактически это белые, студенистые осадки переменного состава ЭО2nН2О, склонны к образованию коллоидных растворов, плохо растворимые в воде, амфотерны. Получают их действием щелочей на водные растворы солей:
ЭC14 + 4КОН = Э(ОН)4 + 4КС1
Однако, для титана основные и кислотные свойства выражены очень слабо. При переходе к Zr(OH)4 и Hf(OH)4 основные свойства усиливаются.
Свежеосажденные осадки (форма Н4ЭО4) значительно реакционноспособны и хорошо растворяются в кислотах, например:
Ti(ОН)4 + 2HСI = TiОCI2 + 3H2O
При длительном стоянии или при нагревании они подвергается старению с образованием микроскристаллической формы, устойчивой по отношению к кислотам (кроме HF и концентрированной H2SO4). Старение характерно и для Zr(ОН)4.
Все они не взаимодействуют с концентрированными растворами щелочей, а кислотные свойства проявляют только при сплавлении со щелочами, с образованием титанатов, цирконатов и гафнатов.
Для титана известен Ti(ОН)3 , обладающий только основными свойствами, хорошо растворим в кислотах с образованием солей, например Ti2(SO4)3 , который в водном растворе существует в виде аквакомплексов: Ti(Н2О)62+ фиолетового цвета. Соединения титана +3 неустойчивы и в водных растворах окисляются кислородом воздуха:
2Ti(ОН)3 + О2 + 2Н2О = 2Ti(ОН)4 + Н2О2
Соли. Известны все галогениды подгруппы титана в степени окисления +4. Все они твердые бесцветные вещества, кроме TiС14, который является жидкостью. Молекулы ЭГ4 – устойчивы с преимущественно ковалентным типом связи. Все они легко гидролизуются.
Степень гидролиза солей от Ti4+ к Hf4+ уменьшается, что связано с возрастанием основных свойств. В разбавленном растворе гидролиз протекает полностью с образованием гидратированных оксидов:
ЭCI4 + (2+n)H2O = ЭО2nH2O + 4HСI
Этот процесс в действительности многостадиен и протекает через промежуточные стадии образования гидроксокомплексов с последующим возникновением многоядерных изополикомплексов, в которых атомы титана (и его аналогов) соединены через гидроксогруппы (оловые мостики), либо через атомы кислорода (оксоловые мостики) / 2/:
Н
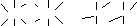 О
О
Ti Ti Ti О Ti
О
Н
Этому переходу соответствует повышение температуры, щелочная среда и длительное стояние раствора. При дальнейшей полимеризации полиядерные комплексы разрастаются до размеров коллоидных частиц. Возможно выделение свободных оксидов: ЭО2·nH2О.
На промежуточных стадиях гидролиза Э(+4) образуются устойчивые комплексные катионы ЭО2+:
Э4+ + Н2О = ЭО2+ +2Н+
Эти ионы: титанил (TiО2+), цирконил ZrО2+, гафнил HfО2+ устойчивы и существуют в твердом состоянии, например: TiОСI2 (хлорид титанила), TiОSO4 и др. Они образуются и при взаимодействии оксидов, гидроксидов с кислотами в водных растворах (см. выше).
Галогениды - координационно ненасыщенные соединения, поэтому взаимодействуют с галогенидами щелочных металлов:
TiC14 + 2КС1 = К2TiС16 + 4HС1
С увеличением степени окисления связь в галогенидах существенно изменяется: TiC12, TiC13 кристаллы с ионным характером, а TiC14 летучая жидкость, связь близка к ковалентной.
В ряду TiF4 – TiCI4 - TiBr4- TiI4 термическая устойчивость соединений уменьшается, а в ряду TiF4 – ZrF4 - HfF4- увеличивается.
Известны хлориды титана (II) и(III).Такие соединения не многочисленны.
Получены сульфиды TiS2 и ZrS2, кристаллы желтого и серо-фиолетового цвета. Устойчивы на воздухе, в воде и разбавленных кислотах. Они взаимодействуют с О2, конц. Н2SO4 и HNO3 кислотами:
ZrS2 + 3O2 = ZrO2 + 2SO2
3TiS2 + 8H2SO4(конц.) = 3Ti(SO4)2 +8S + 8H2O
3TiS2 + 4HNO3 = 3TiO2 +6S + 4NO +2H2O
В неводных средах можно получить соединения простого состава, например:
TiC14 + 4SO3 = Ti(SO4)2 + 2SO2C12
Окислительно-восстановительные свойства соединений. Соединения титана (IV) могут проявлять окислительные свойства: так при добавлении кусочка цинка в раствор соли сульфата титана (IV) раствор приобретает фиолетовый цвет, который характерен для ионовTi3+:
2Ti(SO4)2 + Zn = Ti2(SO4)3 +ZnSO4
Окислительные свойства соединений (IV) в подгруппе титана сверху вниз уменьшаются, так как усиливается устойчивость этих соединений.
Соединения титана в степени окисления (II) и (III) проявляют восстановительные свойства. Так, соединения Ti2+ восстанавливают воду, поэтому растворы их солей не существуют:
TiCI2 + 2H2O = TiO2 + H2 + 2HC1
Растворение TiО и Ti2О3 в кислотах сопровождается выделением оксидов азота:
3TiО+ 3HNO3(разб.) = 3Ti(NO3)3 + NO + 5H2O
3Ti2О3 + 2HNO3(разб.) = 6TiO2 + 2 NO + H2O
а в разбавленной серной кислоте с выделением водорода:
2TiО+ 3H2SO4(разб.) = Ti2(SO4)3 + H2 + 2H2O
В водных растворах
соли Ti3+ более
устойчивы, но проявляют восстановительные
свойства (![]() )
в присутствии окислителей MnO4,
Fe3+, Cu2+,
O2 воздуха, например:
)
в присутствии окислителей MnO4,
Fe3+, Cu2+,
O2 воздуха, например:
4TiCI3 + O2 + 2 H2O = 4TiОCI2 + 4 НCI
Протекание реакции:
TiCI3(крис.)
![]() TiCI2 + TiCI4
, Н0
TiCI2 + TiCI4
, Н0
говорит о способности этих соединений к диспропорционированию.
