- •660025, Г. Красноярск, ул. Вавилова, 66 а
- •1.1.Распространение в природе и получение
- •1.2 Физические свойства
- •Химические свойства
- •Соединения s – металлов
- •1.6.Применение
- •Элементы іііа – группы
- •Распространение в природе и получение
- •Физические свойства
- •Химические свойства
- •Соединения металлов
- •2.1.4. Применение
- •Глава 3. Химия переходных металлов
- •В периоде с ростом z восстановительные свойства металлов уменьшаются, достигая минимума у элементов iв группы (табл.3.1.). Тяжелые металлы viiiв и iв групп за свою инертность названы благородными.
- •3.1. Элементы iв группы
- •Химические свойства
- •Применение
- •3.2. Элементы подгруппы II в
- •3.2.1.Распространение в природе и получение
- •3.2.2.Физические свойства
- •3.2.3. Химические свойства По химическим свойствам Zn и его аналоги менее активны, чем подгруппа Са. В ряду от Zn к Hg-химическая активность металлов уменьшается (см. Табл.3.3.).
- •3.2.4. Соединения металлов
- •3.2.5. Применение
- •3.3. Элементы подгруппы iiia
- •3.3.1. Способы получения
- •3.3.2.Физические и химические свойства
- •3.3.3. Соединения металлов
- •3.3.4. Применение
- •3.4. Элементы подгруппы ivb
- •3.4.1.Распространение в природе и получение
- •3.4.2.Физические свойства
- •3.4.3. Химические свойства
- •3.4.4. Соединения металлов
- •3.4.5. Применение
- •3.5. Элементы подгруппы vb
- •3.5.1.Распространение в природе и получение
- •3.5.1.Физические свойства
- •3.5.2. Химические свойства
- •3.5.4. Cоединения металлов
- •3.5.5.Применение
- •3.6. Элементы подгруппы viв
- •3.6.1. Распространение в природе и получение
- •В промышленности чистый хром получают из хромистого железняка:
- •Вольфрам, молибден получают из соответствующих оксидов, например:
- •3.6.2.Физические свойства
- •3.6.3. Химические свойства
- •3.6.4. Соединения металлов
- •3.6.5. Применение
- •3.8. Элементы подгруппы VII b
- •3.8.1. Распространение в природе и получение
- •3.8.2.Физические свойства
- •3.8.4. Химические свойства
- •3.8.5.Соединения металлов
- •3.8.6. Применение
- •3.9.2. Физические свойства
- •3.9.3. Химические свойства
- •3.9.4.Соединения металлов
- •3.9.5. Применение
- •3.9. Элементы VIII в группы (платиновые металлы)
- •3.9.1. Распространение в природе и получение
- •В виде соединений находятся в Си- Ni сульфидных рудах.
- •3.9.2. Физические свойства
- •3.9.3. Химические свойства
- •3.9.4.Соединения металлов
- •3.9.5.Применение
- •Глава 4. Лантаноиды и актиноиды
- •4.1. Электронные конфигурации атомов лантаноидов и актиноидов и их свойства.
- •4. 1.1.Монотонно изменяющиеся
- •4.1.2.Периодически изменяющиеся свойства
- •4.2.Распространение f - элементов в природе и получение
- •4.3.Разделение смеси соединений лантаноидов (актиноидов)
- •4.3.1.Ионообменная хроматография
- •4. 3.2.Жидкостная экстракция
- •4.3.3.Разделение по изменению степени окисления
- •4.4.Физические свойства
- •4.5.Химические свойства
- •4.6.Соединения f-металлов
- •4.7.Применение
3.4.2.Физические свойства
Ti, Zr, Hf- тугоплавкие серебристо-белые металлы. Чистые металлы легко поддаются механической обработке: вытягиваются в нити, прокатываются в фольгу. Они стойки против коррозии, сплавы их имеют высокие Тпл., внешне в результате покрытия поверхности оксидными пленками они напоминают сталь. Титан относится к легким , а Zr и Hf к тяжелым металлам.
Атомные радиусы от Ti к Zr увеличиваются, а от Zr к Hf из-за «лантаноидного» сжатия почти одинаковые. Поэтому свойства Zr и Hf очень близки, их трудно разделять.
Tаблица 3.5.
Некоторые свойства элементов IV В подгруппы
|
Металл |
R ат, нм |
Плотность, г/см3 |
Jион., эВ |
Стандартный элект-родный потенциал процессов, В |
T пл., 0C |
T кип., 0C |
Содержание в земной коре, масс. % |
|
Ti |
0,1462 |
4,5 |
6,82 |
1,17 Э+4 /Э 1,628 Э+2 /Э 1,21 Э+3 /Э |
1677 |
3277 |
0,44 |
|
Zr |
0,160 |
6,5 |
6,84 |
1,56 Э+4 /Э |
1855 |
4474 |
2103 |
|
Hf |
0,159 |
13,2 |
7,5 |
1,70 Э+4 /Э |
2222 |
5280 |
3104 |
Увеличение потенциала ионизации в группе сопровождается уменьшением химической активности от Ti к Hf.
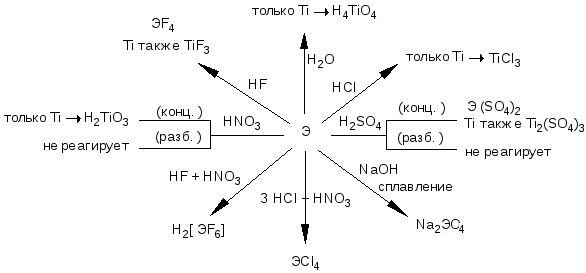
3.4.3. Химические свойства
При обычной температуре металлы коррозионно стойкие, но при нагревании их активность заметно возрастает. Характерной особенностью подгруппы титана является образование твердых растворов и фаз внедрения с неметаллами (Н, С, В,N,O)
Отношение к неметаллам можно выразить схемой:

При высоких температурах они образуют хлориды TiCI4 (150-400 0С), нитриды ZrN (800 0С), оксиды TiO2 (8000С), карбиды HfC (1 000 0С).
Титан и его аналоги способны сильно поглощать водород, при этом образуются гидриды нестехиометрического состава ЭН и ЭН2. Они занимают промежуточное положение между твердыми растворами и солеподобными (ионными) гидридами типа СаН2.
Отношение к кислотам. В ряду напряжений все металлы расположены до водорода. Однако они вполне устойчивы по отношению к воде и минеральным кислотам, за исключением НF. Интересно отметить, что при нагревании они реагируют со слабыми концентрированными органическими кислотами (уксусной СН3СООН, щавелевой Н2С2О4), хотя практически не реагируют с концентрированными Н2SO4 и HNO3:
3Ti + 4HNO3 (конц.) + H2О = 3Н2TiO3 + 4NO
Ti + 5Н2SO4 (конц.) = Н2Ti(SO4)3 + 2SO2 + 4H2О
Эта особенность обусловлена наличием на поверхности металлов плотной пленки оксидов ЭО2, уплотнение которой происходит в окислительной среде .Так, коррозиционная стойкость титана превышает стойкость нержавеющей стали.
Титан лишенный пленки при нагревании реагирует с водой:
Ti
+ H2O
![]() TiO2 + 2 H2
TiO2 + 2 H2
Эта реакция используется для очистки газов от паров воды.
Кроме того Ti растворяется в разбавленных НС1, Н2SO4:
Ti + 3Н2SO4 (разб) = Ti2(SO4)3 + 3H2
Все металлы растворяются в плавиковой кислоте HF, в смесях кислот: HF+HNO3 и HCI+HNO3, образуя комплексы:
2Ti + 12 HF = 2 H3TiF6 + 3H2
3Zr + 4HNO3+ 18HF= 3H2ZrF6 + 4NO + 8H2O
Отношение к щелочам. В некоторой степени Ti растворяется в разбавленных щелочах при нагревании:
Ti +
2NаОН + 4H2О
![]() Na2Ti(OH)6
+ 2H2
Na2Ti(OH)6
+ 2H2
Являясь типичными d- металлами с растворами щелочей они не реагируют, но сплавляются со щелочами в присутствии окислителей, например:
3Zr + 2КС1O3+ 6КОН= 3К2ZrО3 + 2КС1 + 3H2O
При этом образуются цирконаты, ниобаты, гафнаты.
Отношение металлов подгруппы титана к кислотам и щелочам можно представить в виде схемы: