
- •8.Современные представления о гемопоэзе. Доказательтства существования родоначальной гемопоэтической клетки (эксперименты j.Till McCullach).
- •9.Основные этапы созревания гранулоцитов и моноцитов, опишите морфологические и цитохимические признаки клеток миелопоэза. Клиническое значение цитологического исследования клеток миелопоэза.
- •10.Основные этапы созревания, цитологическая и иммунофенотипическая характеристика лимфоцитов. Клиническое значение иммунофенотипирования.
- •11.Красный кровяной росток, этапы созревания, функционирование эритропоэтического ростка.
- •12.Цитологическое исследование костного мозга: методика, клиническое значение. Нормальная миелограмма. Клетки костномозгового окружения, морфологическая оценка и клиническое значение.
- •13.Методология и клиническое значение цитогенетических методов исследования костного мозга.
- •14.Хронические миелопролиферативные заболевания. Патогенез, диагностика.
- •15.Синдром недостаточности костного мозга. Причины, патогенез, диагностика. Миелодиспластические синдромы. Патогенез, современная классификация, диагностические критерии, прогноз.
- •16.Острый миелолейкоз. Методы цитохимического анализа миелобластов.
- •17.Методология и клиническое значение иммунофенотипирования клеток. Классификация лимфом. Значение лабораторных методов диагностики.
- •20.Цитологические характеристики и клиническое значение исследования бластов в крови и препарате костного мозга.
- •21.Понятие анемии. Классификация анемий.
- •22.Железодефицитная анемия, показатели обмена железа.
- •24.Диагностика гемолитических состояний. Методы ищучения аномальных форм гемоглобина.
- •25.Анемия хронических заболеваний. Этиология, патогенез, диагностика.
- •26.Апластические анемии.
- •27.Лейкопении и лейкоцитозы. Причины, диагностика.
- •28.Тромбоцитопении. Причины, подходы к дифференциальной диагностики.
- •29.Тромбоцитозы. Причины, дифференциальный диагноз, значение лабораторных методов диагностики.
- •31.Стадии созревания мегакариоцитов, морфологические и иммунофенотипические характеристики. Структура и функция рецепторов тромбоцитов, роль арахидоновой кислоты, простациклин, тромбоксан.
- •32.Физиология образования мочи. Подготовка, хранение и транспортировка мочи для клинического исследования.
- •33.Клиническое исследование мочи. Возможности визуальной колориметрии мочи в сравнении со стандартным клиническим исследованием.
- •34.Лейкоцитурия. Методы диагностики, клиническое значение. Дифференциальный диагноз септической и асептической лейкоцитурии.
- •35.Эритроцитурия. Этиология и механизмы эритроцитурии. Методы диагностики, клиническое значение.
- •36.Клиническое значение и методы выявления протеинурии.
- •37.Диагностика протеинурии переполнения. Феномен Бенс-Джонса. Понятие о моноклональных гаммапатиях
- •38.Клиническое значение выявления микроальбуминурии.
- •39.Методика микроскопирования осадка мочи. Патологические изменения и клиническое значение.
- •40.Клиническое исследование транссудатов и экссудатов. Плевральный выпот. Спинномозговой ликвор.
- •41.Клиническое исследование мокроты. Бронхоальвеолярный лаваж.
- •42.Принципы и основные параметры копрологического исследования. Клиническое значение.
- •45.Современные подходы к стандартизации коагуляционных тестов. Технология определения международного нормализированного отношения (мно). Клиническое значение мно.
- •46.Диссеминированное внутрисосудистое свертывание.
- •47.Болезнь Виллебранда. Этиология, классификация, диагностика.
- •48.Гемофилии. Классификация, подходы к диагностике, значение лабораторных методов.
- •49.Определение волчаночных антикоагулянтов. Ингибиторные коагулопатии. Антифосфолипидный синдром. Клинические проявления, диагностика.
- •50.Буферные растворы, основные характеристики. Требования, предъявляемые к буферным растворам в биологических исследованиях. Буферные свойства белков и аминокислот, уравнение Гендерсона-Хассельбаха.
- •51.Ионометрия. Ионоселективные электроды. Кислотность среды и ее измерения. Индикаторы.
- •52.Нарушения кислотно-щелочного равновесия.
- •53.Нарушения обмена калия. Причины, методы диагностики.
- •54.Центрифугирование. Принцип метода, основные определения, конструктивные особенности центрифуг. Препаративное и аналитическое центрифугирование. Аналитические ультрацентрифуги и их применение.
- •55.Хроматографические методы разделения веществ, их применение в клинической диагностике.
- •56.Электрофоретические методы разделения биоматериалов. Примеры применения в клинической практике. Значение электрофореза в протеомном анализе.
- •57.Лимфоплазмоклеточные дискразии. Клинические формы, диагностические критерии, методы лабораторной диагностики.
- •58.Диагностика и клиническое значение наследственных и приобретенных гиперлипидемий.
- •60.Методы и единицы измерения активности ферментов плазмы крови. Лабораторная диагностика заболеваний печени. Алт и аст. Γ-Глютамилтранспептидаза. Щелочная фосфатаза. Гепатоцитолиз. Холестаз.
- •61.Биохимическая диагностика инфаркта миокарда. Креатинкиназа. Лактатдегидрогеназа. Другие биохимические показатели повреждения миокарда.
- •62.Наследственные гипербилирубинемии. Диагностика желтухи. Нарушения обменов порфиринов.
- •63.Диагностика сахарного диабета. Значение определения гликозилированного гемоглабина.
- •64.Гипоальбуминемия. Дифференциальная диагностика.
- •65.Методы оценки фильтрационной функции почек. Хбп, Клиническое значение креатинина в крови.
- •66.Нарушение обмена пуринов. Подагра, хронический уратный интерстициальный нефрит.
- •67.Нефелометрический и турбидиметрический анализ в клинической практике. Отличие от других методов фотометрии.
- •69.Методы лабораторной диагностики воспаления. Клетки, вовлеченные в воспалительные процессы (нейтрофилы, моноциты, макрофаги, эндотелиальные клетки). Цитокины. Аутовоспалительные заболевания.
- •71.Скв, классификация, критерии диагностики. Le-клеточный феномен, антинуклеарные ат и их разновидности. Принципы лечения. Системная склеродермия, клиническая картина, диагностика, принципы лечения.
- •72.Системные васкулиты. Клиническая характеристика, проблемы классификации. Anca-феномен.
- •73. Криоглобулинемия, причины, патогенез, клинические проявления, методы диагностики.
- •74.Паранеопластический синдром (дерматомиозит и другие паранеопластические реакции), роль иммунологических методов диагностики, определение онкогенов.
- •75.Иммуносерологические исследования. Биологические основы определения групп крови. Клиническое значение определения групп крови.
- •76.Полимеразная цепная реакция. Современные методы диагностики инфекции. Достижения в молекулярной диагностике наследственных заболеваний. Понятие о геномике и протеомике.
15.Синдром недостаточности костного мозга. Причины, патогенез, диагностика. Миелодиспластические синдромы. Патогенез, современная классификация, диагностические критерии, прогноз.
Апластические анемии являются главным проявлением синдрома костно-мозговой недостаточности. Для такого состояния характерны:
- уменьшение объема гемопоэтической ткани;
- замещение костного мозга жировой тканью и фиброзной тканью (миелофиброз);
- панцитопения в периферической крови (выраженная анемия, Нb-20-30 г/л; нормохромия, макроцитоз, сниженное количество ретикулоцитов, повышенное содержание HbF, лейкопения, абсолютная нейтропения, относительный лимфоцитоз, тромбоцитопения, повышенная СОЭ);
- общеанемический синдром (бледность, вялость, одышка и др);
- иммунодефицитный синдром (инфекции, сепсис);
- геморрагический синдром (петехии, кровоподтеки, кровотечения);
- гемолитический синдром (короткоживущие эритроциты);
- увеличение содержания железа в сыворотке крови, как следствие нарушения включения железа в гемоглобин (насыщение им трансферрина достигает 100 %);
- высокий уровнь эритропоэтина в крови при сниженной эффективности его действия на костный мозг.
В таких случаях повреждаются клетки-предшественницы миелопоэза. Иногда формируются антитела к клеткам красного ряда, что дает основание предполагать аутоиммунный механизм развития такого рода анемий
Миелодиспластический синдром (МДС) — группа гетерогенных клональных заболеваний, характеризующаяся наличием цитопении в периферической крови, дисплазии в костном мозге и риском трансформации в острый лейкоз.
Этиология и патогенез:
Этиология миелодиспластических синдромов не установлена. Полагают, что генез их связан с изменениями гемопоэтической стволовой клетки и ее окружения. Вследствие этого выявляются морфологические дефекты клеток эритроцитарной, гранулоцитарной, лимфоцитарной и мегакариоцитарной линии гемопоэза, увеличение количества бластных клеток в периферической крови и костном мозге. Эти изменения встречаются с различной частотой и в разных сочетаниях. Наиболее постоянными являются дизгемопоэз, рефрактерная анемия, цитопения (1 -, 2-, 3-ростковая) и/или гипоплазия кроветворной ткани. Миелодиспластические синдромы обычно протекают в две фазы: гемодепрессии и клиники острого лейкоза (реже — хронического лейкоза или другой формы гемобластозов). Имеются сведения о кариологических, иммунологических нарушениях, изменениях антигенной структуры клеток, как правило, носящих мозаичный и неспецифический характер.
В основе патогенеза МДС лежит воздействие повреждающих факторов на полипотентную стволовую клетку, приводящее к появлению в ней генетических аномалий, а также феномена гиперметилирования ДНК. Указанные нарушения приводят к нарушению продукции клеток миелоидного ростка и появлению миелобластов в костном мозге и периферической крови, вследствие чего появляются диспластические изменения в зрелых клетках и их функциональная недостаточность, приводящие к описанным клиническим проявлениям. Феномен гиперклеточности костного мозга на фоне периферической цитопении объясняется ускоренным апоптозом аномально пролиферирующих клеток костного мозга.
Клиническая картина:
МДС отличает отсутствие типичной клинической картины. Симптоматику МДС составляют последствия дисмиелопоэза, то есть цитопении: анемия, нейтропения и тромбоцитопения (анемия Hb меньше 110 г/л, нейтрофилы меньше 1,800 на 1 микролитр крови; гематокрит меньше 36 % эритроцитов в общем объёме крови в организме; тромбоциты меньше 100,000 на 1 микролитр крови).
ФАБ-классификация:
Разработка этой системы классификации франко-американо-британской группой была начата в 1976 году и позже, в 1982 году, она приняла свой окончательный вид.
В основе классификации лежит ключевой для МДС синдром — рефрактерная, то есть устойчивая к лечению препаратами витамина В12 и фолиевой кислоты, анемия (РА). Четыре типа РА являются последовательными стадиями, с нарастанием тяжести МДС, что имеет своё отражение в прогнозе выживаемости. В этой связи появление в КМ бластов резко меняет прогноз выживаемости в худшую сторону.

Классификация ВОЗ:
В 2002 году Всемирная организация здравоохранения предложила новую классификацию миелодиспластических синдромов в 2008 году были сделаны предложения по её пересмотру.
Подгруппы, выделяемые в классификации ВОЗ включают: рефрактерную анемию и рефрактерную анемию с кольцевыми сидеробластами, рефрактерную цитопению с множественной дисплазией, рефрактерную анемию с избыточным количеством бластов-1 (содержание бластов в костном мозге составляет менее 10 %), рефрактерную анемию с избыточным количеством бластов-2 (содержание бластов в костном мозге превышает 10 %), синдром делеции 5q и миелодиспластический синдром неклассифицированный (с наличием или отсутствием кольцевых сидеробластов).
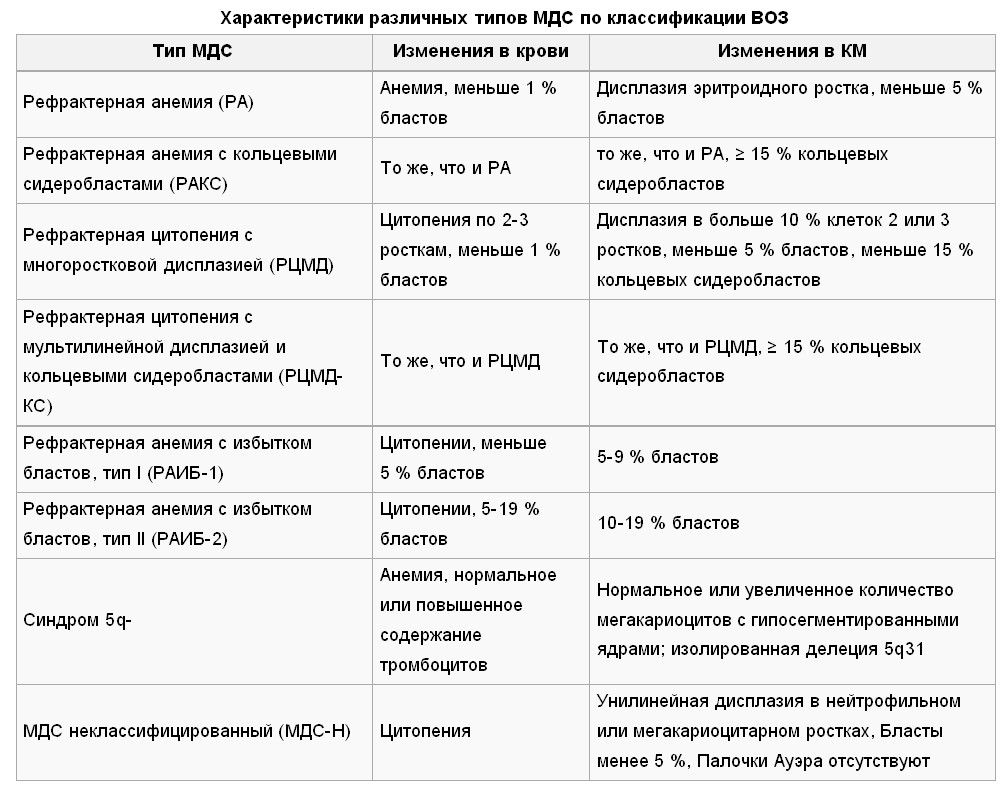
Минимальные диагностические критерии:
Минимальные диагностические критерии МДС включают обязательные диагностические условия — стабильная цитопения не менее 6 месяцев, (за исключением случаев, когда цитопения сопровождается специфическим кариотипом или дисплазией двух ростков кроветворения — в этих случаях длительность стабильной цитопении должна составлять не менее 2 месяцев), исключение других заболеваний, которые могут стать причиной развития дисплазии или/и цитопении.
В дополнение к этим двум диагностическим условиям для установления диагноза МДС необходимо соответствие хотя бы одному из трёх основных критериев:
дисплазия (≥ 10 % клеток одного или более из трёх основных ростков кроветворения в костном мозге).
содержание бластов в костном мозге 5-19 %.
специфический кариотип, например делеция (5q), делеция (20q), +8 или −7/делеция (7q).
Кроме того, для диагностики МДС используются дополнительные критерии, в том числе результаты проточной цитометрии, гистологического и иммуногистохимического исследования костного мозга, выявления молекулярных маркеров.
Морфологическое исследование биоптатов, полученных путём билатеральной трепанобиопсии, является полезным, помимо верификации диагноза самого МДС, с точки зрения дифференциальной диагностики с лимфопролиферативными и другими миелопролиферативными заболеваниями
При диагностике хромосомные аномалии обнаруживаются у 40-70 % пациентов с первичным MDS и у 95 % пациентов, MDS которых связан с терапией (вторичный).
К наиболее часто встречающимся при MDS цитогенетическим аномалиям относятся del(5q), −7 и +8
