
- •8.Современные представления о гемопоэзе. Доказательтства существования родоначальной гемопоэтической клетки (эксперименты j.Till McCullach).
- •9.Основные этапы созревания гранулоцитов и моноцитов, опишите морфологические и цитохимические признаки клеток миелопоэза. Клиническое значение цитологического исследования клеток миелопоэза.
- •10.Основные этапы созревания, цитологическая и иммунофенотипическая характеристика лимфоцитов. Клиническое значение иммунофенотипирования.
- •11.Красный кровяной росток, этапы созревания, функционирование эритропоэтического ростка.
- •12.Цитологическое исследование костного мозга: методика, клиническое значение. Нормальная миелограмма. Клетки костномозгового окружения, морфологическая оценка и клиническое значение.
- •13.Методология и клиническое значение цитогенетических методов исследования костного мозга.
- •14.Хронические миелопролиферативные заболевания. Патогенез, диагностика.
- •15.Синдром недостаточности костного мозга. Причины, патогенез, диагностика. Миелодиспластические синдромы. Патогенез, современная классификация, диагностические критерии, прогноз.
- •16.Острый миелолейкоз. Методы цитохимического анализа миелобластов.
- •17.Методология и клиническое значение иммунофенотипирования клеток. Классификация лимфом. Значение лабораторных методов диагностики.
- •20.Цитологические характеристики и клиническое значение исследования бластов в крови и препарате костного мозга.
- •21.Понятие анемии. Классификация анемий.
- •22.Железодефицитная анемия, показатели обмена железа.
- •24.Диагностика гемолитических состояний. Методы ищучения аномальных форм гемоглобина.
- •25.Анемия хронических заболеваний. Этиология, патогенез, диагностика.
- •26.Апластические анемии.
- •27.Лейкопении и лейкоцитозы. Причины, диагностика.
- •28.Тромбоцитопении. Причины, подходы к дифференциальной диагностики.
- •29.Тромбоцитозы. Причины, дифференциальный диагноз, значение лабораторных методов диагностики.
- •31.Стадии созревания мегакариоцитов, морфологические и иммунофенотипические характеристики. Структура и функция рецепторов тромбоцитов, роль арахидоновой кислоты, простациклин, тромбоксан.
- •32.Физиология образования мочи. Подготовка, хранение и транспортировка мочи для клинического исследования.
- •33.Клиническое исследование мочи. Возможности визуальной колориметрии мочи в сравнении со стандартным клиническим исследованием.
- •34.Лейкоцитурия. Методы диагностики, клиническое значение. Дифференциальный диагноз септической и асептической лейкоцитурии.
- •35.Эритроцитурия. Этиология и механизмы эритроцитурии. Методы диагностики, клиническое значение.
- •36.Клиническое значение и методы выявления протеинурии.
- •37.Диагностика протеинурии переполнения. Феномен Бенс-Джонса. Понятие о моноклональных гаммапатиях
- •38.Клиническое значение выявления микроальбуминурии.
- •39.Методика микроскопирования осадка мочи. Патологические изменения и клиническое значение.
- •40.Клиническое исследование транссудатов и экссудатов. Плевральный выпот. Спинномозговой ликвор.
- •41.Клиническое исследование мокроты. Бронхоальвеолярный лаваж.
- •42.Принципы и основные параметры копрологического исследования. Клиническое значение.
- •45.Современные подходы к стандартизации коагуляционных тестов. Технология определения международного нормализированного отношения (мно). Клиническое значение мно.
- •46.Диссеминированное внутрисосудистое свертывание.
- •47.Болезнь Виллебранда. Этиология, классификация, диагностика.
- •48.Гемофилии. Классификация, подходы к диагностике, значение лабораторных методов.
- •49.Определение волчаночных антикоагулянтов. Ингибиторные коагулопатии. Антифосфолипидный синдром. Клинические проявления, диагностика.
- •50.Буферные растворы, основные характеристики. Требования, предъявляемые к буферным растворам в биологических исследованиях. Буферные свойства белков и аминокислот, уравнение Гендерсона-Хассельбаха.
- •51.Ионометрия. Ионоселективные электроды. Кислотность среды и ее измерения. Индикаторы.
- •52.Нарушения кислотно-щелочного равновесия.
- •53.Нарушения обмена калия. Причины, методы диагностики.
- •54.Центрифугирование. Принцип метода, основные определения, конструктивные особенности центрифуг. Препаративное и аналитическое центрифугирование. Аналитические ультрацентрифуги и их применение.
- •55.Хроматографические методы разделения веществ, их применение в клинической диагностике.
- •56.Электрофоретические методы разделения биоматериалов. Примеры применения в клинической практике. Значение электрофореза в протеомном анализе.
- •57.Лимфоплазмоклеточные дискразии. Клинические формы, диагностические критерии, методы лабораторной диагностики.
- •58.Диагностика и клиническое значение наследственных и приобретенных гиперлипидемий.
- •60.Методы и единицы измерения активности ферментов плазмы крови. Лабораторная диагностика заболеваний печени. Алт и аст. Γ-Глютамилтранспептидаза. Щелочная фосфатаза. Гепатоцитолиз. Холестаз.
- •61.Биохимическая диагностика инфаркта миокарда. Креатинкиназа. Лактатдегидрогеназа. Другие биохимические показатели повреждения миокарда.
- •62.Наследственные гипербилирубинемии. Диагностика желтухи. Нарушения обменов порфиринов.
- •63.Диагностика сахарного диабета. Значение определения гликозилированного гемоглабина.
- •64.Гипоальбуминемия. Дифференциальная диагностика.
- •65.Методы оценки фильтрационной функции почек. Хбп, Клиническое значение креатинина в крови.
- •66.Нарушение обмена пуринов. Подагра, хронический уратный интерстициальный нефрит.
- •67.Нефелометрический и турбидиметрический анализ в клинической практике. Отличие от других методов фотометрии.
- •69.Методы лабораторной диагностики воспаления. Клетки, вовлеченные в воспалительные процессы (нейтрофилы, моноциты, макрофаги, эндотелиальные клетки). Цитокины. Аутовоспалительные заболевания.
- •71.Скв, классификация, критерии диагностики. Le-клеточный феномен, антинуклеарные ат и их разновидности. Принципы лечения. Системная склеродермия, клиническая картина, диагностика, принципы лечения.
- •72.Системные васкулиты. Клиническая характеристика, проблемы классификации. Anca-феномен.
- •73. Криоглобулинемия, причины, патогенез, клинические проявления, методы диагностики.
- •74.Паранеопластический синдром (дерматомиозит и другие паранеопластические реакции), роль иммунологических методов диагностики, определение онкогенов.
- •75.Иммуносерологические исследования. Биологические основы определения групп крови. Клиническое значение определения групп крови.
- •76.Полимеразная цепная реакция. Современные методы диагностики инфекции. Достижения в молекулярной диагностике наследственных заболеваний. Понятие о геномике и протеомике.
51.Ионометрия. Ионоселективные электроды. Кислотность среды и ее измерения. Индикаторы.
Введение в потенциометрию:
Потенциометрический метод анализа основан на использовании зависимости электрического сигнала (потенциала) специального датчика, называемого измерительным электродом, от состава анализируемого раствора. В идеальном случае измерительный электрод избирательно (селективно) реагирует на определенный ион (или группу ионов), а его потенциал зависит от содержания этих ионов в растворе.
Измерительные электроды обычно подразделяют на две группы: рН-электроды. т.е. электроды селективные к иону водорода и электроды селективные к прочим ионам, которые называют ионоселективными электродами. Абсолютную величину потенциала в настоящее время измерить невозможно, однако можно измерить потенциал относительно другого электрода, потенциал которого не зависит от состава раствора и условно принимается равным нулю. Такой электрод называется электродом сравнения. Датчик, объединяющий в одном корпусе измерительный электрод и электрод сравнения, называется комбинированным электродом.
Потенциометрический анализ распространяется только на вещества, находящиеся в ионном состоянии, т.е. основной объект исследований это растворы, однако при этом растворы могут содержать взвеси твердых частиц, эмульсии, быть гелеобразными и т.д.
Потенциометрический метод анализа существует в нескольких вариантах:
- Прямая потенциометрия. Метод основан на установлении зависимости потенциала измерительного электрода от концентрации раствора и последующим ее использовании для анализа растворов неизвестной концентрации. Метод достаточно прост и экспрессен. Наиболее широко применяется для измерения рН. Точность метода зависит, в первую очередь, от типа измерительного электрода.
Достоинством и недостатком метода одновременно является то, что измеряемый потенциал зависит от активности. Это единственный метод прямого определения активности ионов в растворах.
- Потенциометрическое титрование. Он основан на проведении специфической химической реакции под контролем ионоселективного или редокс-электрода. Могут применяться следующие реакции: нейтрализации, осаждения, комплексообразования или окисления-восстановления. Расчет концентрации анализируемого вещества производится на основании объемов и концентраций, участвующих в реакции растворов.
Метод более сложный и трудоемкий по сравнению с предыдущим, но имеет ряд преимуществ. Результаты, полученные этим методом, обычно более точны и воспроизводимы (< 1 %). Титрование позволяет определять вещества, на которые не существует ионоселективных электродов (косвенное определение).
Ионометрия:
Ионометрия имеет ограниченную область применения в лабораторной практике из-за не высокой избирательности (селективности).
Стеклянные ионоселективные электроды из всех обладают наилучшими эксплуатационными характеристиками. Применение стеклянных электродов невозможно в растворах, содержащих плавиковую кислоту или ее соли.
Na – селективные. Предназначены для лабораторного анализа растворов, содержащих достаточно высокие концентрации ионов Na+. Основным мешающим ионом являются ион водорода (Н+), поэтому при измерении должно соблюдаться соотношение pH-pNa > 3,5.
Электроды с кристаллической мембраной. Не допускается эксплуатация этих электродов в растворах, разрушающие или растворяющие материал корпуса (ПВХ).
F-селективный электрод является одним из самых высокоселективных электродов – единственным мешающим ионом является ион ОН-, поэтому измерения рекомендуется проводить при рН 5,5...6,5. Материал чувствительной мембраны – монокристалл LaF3 обладает высокой химической стойкостью и долговечностью.
CI-, Br-, I-селективные электроды выполнены по стандартной технологии. Материалом мембраны является прессованный порошок Ag2S с добавлением соответствующего галогенида серебра.
Мешающим действием обладают все ионы, которые могут взаимодействовать с материалом мембраны с образованием менее растворимых солей, в частности это ионы Hg2+ и S2-. Селективность электродов возрастает в ряду CI-Br-I.
Cd-, Pb-, Cu- селективные электроды также выполнены по общепринятой технологии. Материал мембраны – прессованный порошок Ag2S с добавлением сульфида соответствующего металла.
Мешающим действием обладают все ионы, которые могут взаимодействовать с материалом мембраны с образованием менее растворимых солей.
Для Ag-селективного электрода материалом мембраны служит прессованный порошок Ag2S. Мешающий ион Hg2+. При определении серебра следует применять двухключевой электрод сравнения, заправленный раствором KNO3 вместо KCl, т.к. малорастворимая соль AgCl может забивать электролитический ключ.
Электроды с ПВХ-мембраной. Материал мембраны ПВХ с добавлением специальных веществ-переносчиков. При работе с этими электродами не допускается присутствие веществ растворяющих или разрушающих ПВХ.
К-селективный электрод. При определении К+ должен применяться двухключевой электрод сравнения, заправленный раствором NH4NO3 или NH4Cl вместо KCl.
NO3-селективный электрод
Ca-, NH4-селективные электроды
Для комфортной работы с ионоселективными электродами, особенно при прямой потенциометрии, в качестве измерительного прибора нужен иономер.
рН-метрия:
Потенциометрическое определение кислотности растворов – рН-метрия, один из самых распространен видов анализа. По материалу рабочей мембраны серийные рН-электроды подразделяются на стеклянные, металлоксидные и пленочные с ПВХ-мембраной. Металлоксидные и пленочные электроды имеют ограниченную область применения, т.к. проигрывают стеклянным по всем основным параметрам. Наибольшее распространение получили стеклянные рН-электроды.
Электроды сравнения:
Основная задача электрода сравнения – создание стабильного опорного потенциала. Конструктивно электрод сравнения представляет собой ионоселективный электрод (например, на ионы Cl-) погруженный в электролит постоянного состава, контакт с анализируемым раствором осуществляется через специальный барьер, препятствующий смешиванию этих двух жидкостей. Для заполнения электродов сравнения должны применяться строго определенные электролиты. Например, для описанной выше конструкции одноключевого электрода сравнения электролит должен содержать, во-первых, ионы необходимые для работы потенциалопределяющего полуэлемента (для хлорсеребряных электродов это ионы Cl-), а во-вторых, он должен быть "равнопереносящим". Это означает, что ионы, входящие в состав электролита, должны иметь равные (близкие) подвижности. К равнопереносящим электролитам относятся следующие: растворы KCl, KNO3, NH4NO3, NH4Cl и некоторые другие. Чаще всего для заполнения электродов сравнения используют растворы KCl различной концентрации. Однако в некоторых случаях попадание KCl в анализируемый раствор мешает проведению измерений, например, при анализе ионов К+ или Cl-. В этом случае должны применяться двухключевые электроды сравнения. В этих электродах между рабочим объемом электрода сравнения, заполненным KCl, и анализируемой средой размещается дополнительная емкость для электролита, снабженная вторым электролитическим ключом.
Кислотно-основные индикаторы — органические соединения, способные изменять цвет в растворе при изменении кислотности (pH). Их преимуществом является дешевизна, быстрота и наглядность исследования. Однако из-за субъективности определения цвета и невысокой точности индикаторы pH не всегда удобны; поэтому для точного измерения pH используют pH-метры с цифровой индикацией.
Кислотно-основные индикаторы (водные растворы):
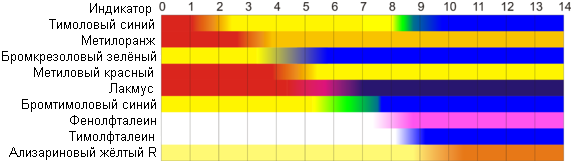
Универсальный индикатор:
Широко применяются смеси индикаторов, позволяющие определить значение рН растворов в большом диапазоне концентраций (1-10; 0-12). Растворами таких смесей - «универсальных индикаторов» обычно пропитывают полоски «индикаторной бумаги», с помощью которых можно быстро (с точностью до единиц рН, или даже десятых долей рН) определить кислотность исследуемых водных растворов. Для более точного определения сравнивают с эталонной цветовой шкалой.
