
- •8.Современные представления о гемопоэзе. Доказательтства существования родоначальной гемопоэтической клетки (эксперименты j.Till McCullach).
- •9.Основные этапы созревания гранулоцитов и моноцитов, опишите морфологические и цитохимические признаки клеток миелопоэза. Клиническое значение цитологического исследования клеток миелопоэза.
- •10.Основные этапы созревания, цитологическая и иммунофенотипическая характеристика лимфоцитов. Клиническое значение иммунофенотипирования.
- •11.Красный кровяной росток, этапы созревания, функционирование эритропоэтического ростка.
- •12.Цитологическое исследование костного мозга: методика, клиническое значение. Нормальная миелограмма. Клетки костномозгового окружения, морфологическая оценка и клиническое значение.
- •13.Методология и клиническое значение цитогенетических методов исследования костного мозга.
- •14.Хронические миелопролиферативные заболевания. Патогенез, диагностика.
- •15.Синдром недостаточности костного мозга. Причины, патогенез, диагностика. Миелодиспластические синдромы. Патогенез, современная классификация, диагностические критерии, прогноз.
- •16.Острый миелолейкоз. Методы цитохимического анализа миелобластов.
- •17.Методология и клиническое значение иммунофенотипирования клеток. Классификация лимфом. Значение лабораторных методов диагностики.
- •20.Цитологические характеристики и клиническое значение исследования бластов в крови и препарате костного мозга.
- •21.Понятие анемии. Классификация анемий.
- •22.Железодефицитная анемия, показатели обмена железа.
- •24.Диагностика гемолитических состояний. Методы ищучения аномальных форм гемоглобина.
- •25.Анемия хронических заболеваний. Этиология, патогенез, диагностика.
- •26.Апластические анемии.
- •27.Лейкопении и лейкоцитозы. Причины, диагностика.
- •28.Тромбоцитопении. Причины, подходы к дифференциальной диагностики.
- •29.Тромбоцитозы. Причины, дифференциальный диагноз, значение лабораторных методов диагностики.
- •31.Стадии созревания мегакариоцитов, морфологические и иммунофенотипические характеристики. Структура и функция рецепторов тромбоцитов, роль арахидоновой кислоты, простациклин, тромбоксан.
- •32.Физиология образования мочи. Подготовка, хранение и транспортировка мочи для клинического исследования.
- •33.Клиническое исследование мочи. Возможности визуальной колориметрии мочи в сравнении со стандартным клиническим исследованием.
- •34.Лейкоцитурия. Методы диагностики, клиническое значение. Дифференциальный диагноз септической и асептической лейкоцитурии.
- •35.Эритроцитурия. Этиология и механизмы эритроцитурии. Методы диагностики, клиническое значение.
- •36.Клиническое значение и методы выявления протеинурии.
- •37.Диагностика протеинурии переполнения. Феномен Бенс-Джонса. Понятие о моноклональных гаммапатиях
- •38.Клиническое значение выявления микроальбуминурии.
- •39.Методика микроскопирования осадка мочи. Патологические изменения и клиническое значение.
- •40.Клиническое исследование транссудатов и экссудатов. Плевральный выпот. Спинномозговой ликвор.
- •41.Клиническое исследование мокроты. Бронхоальвеолярный лаваж.
- •42.Принципы и основные параметры копрологического исследования. Клиническое значение.
- •45.Современные подходы к стандартизации коагуляционных тестов. Технология определения международного нормализированного отношения (мно). Клиническое значение мно.
- •46.Диссеминированное внутрисосудистое свертывание.
- •47.Болезнь Виллебранда. Этиология, классификация, диагностика.
- •48.Гемофилии. Классификация, подходы к диагностике, значение лабораторных методов.
- •49.Определение волчаночных антикоагулянтов. Ингибиторные коагулопатии. Антифосфолипидный синдром. Клинические проявления, диагностика.
- •50.Буферные растворы, основные характеристики. Требования, предъявляемые к буферным растворам в биологических исследованиях. Буферные свойства белков и аминокислот, уравнение Гендерсона-Хассельбаха.
- •51.Ионометрия. Ионоселективные электроды. Кислотность среды и ее измерения. Индикаторы.
- •52.Нарушения кислотно-щелочного равновесия.
- •53.Нарушения обмена калия. Причины, методы диагностики.
- •54.Центрифугирование. Принцип метода, основные определения, конструктивные особенности центрифуг. Препаративное и аналитическое центрифугирование. Аналитические ультрацентрифуги и их применение.
- •55.Хроматографические методы разделения веществ, их применение в клинической диагностике.
- •56.Электрофоретические методы разделения биоматериалов. Примеры применения в клинической практике. Значение электрофореза в протеомном анализе.
- •57.Лимфоплазмоклеточные дискразии. Клинические формы, диагностические критерии, методы лабораторной диагностики.
- •58.Диагностика и клиническое значение наследственных и приобретенных гиперлипидемий.
- •60.Методы и единицы измерения активности ферментов плазмы крови. Лабораторная диагностика заболеваний печени. Алт и аст. Γ-Глютамилтранспептидаза. Щелочная фосфатаза. Гепатоцитолиз. Холестаз.
- •61.Биохимическая диагностика инфаркта миокарда. Креатинкиназа. Лактатдегидрогеназа. Другие биохимические показатели повреждения миокарда.
- •62.Наследственные гипербилирубинемии. Диагностика желтухи. Нарушения обменов порфиринов.
- •63.Диагностика сахарного диабета. Значение определения гликозилированного гемоглабина.
- •64.Гипоальбуминемия. Дифференциальная диагностика.
- •65.Методы оценки фильтрационной функции почек. Хбп, Клиническое значение креатинина в крови.
- •66.Нарушение обмена пуринов. Подагра, хронический уратный интерстициальный нефрит.
- •67.Нефелометрический и турбидиметрический анализ в клинической практике. Отличие от других методов фотометрии.
- •69.Методы лабораторной диагностики воспаления. Клетки, вовлеченные в воспалительные процессы (нейтрофилы, моноциты, макрофаги, эндотелиальные клетки). Цитокины. Аутовоспалительные заболевания.
- •71.Скв, классификация, критерии диагностики. Le-клеточный феномен, антинуклеарные ат и их разновидности. Принципы лечения. Системная склеродермия, клиническая картина, диагностика, принципы лечения.
- •72.Системные васкулиты. Клиническая характеристика, проблемы классификации. Anca-феномен.
- •73. Криоглобулинемия, причины, патогенез, клинические проявления, методы диагностики.
- •74.Паранеопластический синдром (дерматомиозит и другие паранеопластические реакции), роль иммунологических методов диагностики, определение онкогенов.
- •75.Иммуносерологические исследования. Биологические основы определения групп крови. Клиническое значение определения групп крови.
- •76.Полимеразная цепная реакция. Современные методы диагностики инфекции. Достижения в молекулярной диагностике наследственных заболеваний. Понятие о геномике и протеомике.
76.Полимеразная цепная реакция. Современные методы диагностики инфекции. Достижения в молекулярной диагностике наследственных заболеваний. Понятие о геномике и протеомике.
ПЦР — один из методов ДНК-диагностики, позволяющий увеличить количество копий детектируемого участка генома (ДНК) бактерий или вирусов в миллионы раз с использованием фермента ДНК-полимеразы.
Тестируемый специфический для данного генома отрезок нуклеиновой кислоты многократно умножается, что позволяет его идентифицировать. Сначала молекула ДНК бактерий или вирусов нагреванием разделяется на две цепи, затем в присутствии синтезированных ДНК-праймеров происходит связывание их с комплементарными участками ДНК, синтезируется вторая цепь нуклеиновой кислоты вслед за каждым праймером в присутствии термостабильной ДНК-полимеразы. Получается две молекулы ДНК. Процесс многократно повторяется. Для диагностики достаточно одной молекулы ДНК, то есть одной бактерии или вирусной частицы.
Введение в реакцию дополнительного этапа — синтеза ДНК на молекуле РНК при помощи фермента обратной транскриптазы — позволило тестировать РНК-вирусы, например вирус ВГС. ПЦР — трёхступенчатый процесс, повторяющийся циклично: денатурация, отжиг праймеров, синтез ДНК (полимеризация). Синтезированное количество ДНК идентифицируют методом ИФА или электрофореза.
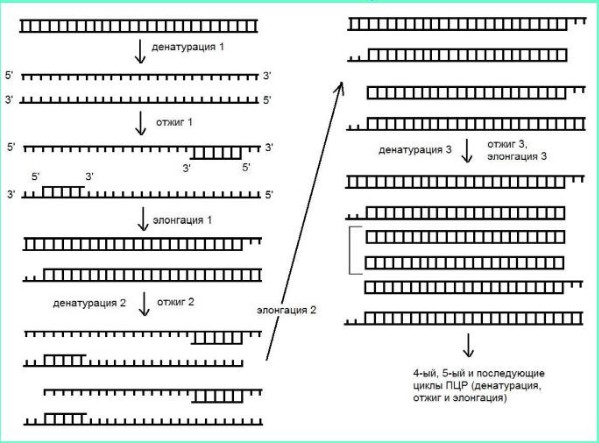
В ПЦР можно использовать различный биологический материал — сыворотку или плазму крови, соскоб из уретры, биоптат, плевральную жидкость, ликвор и т.д. В первую очередь ПЦР применяют для диагностики инфекционных болезней, таких как ВГВ, ВГС, ВГD, ЦМВ-инфекция, инфекционные заболевания, передающиеся половым путём (гонорея, хламидийная, микоплазменная, уреаплазменная инфекции), туберкулёз, ВИЧ-инфекция и т.д.
Преимущество ПЦР перед другими методами исследований:
■ возбудитель инфекции можно обнаружить в любой биологической среде организма, в том числе и материале, получаемом при биопсии;
■ возможна диагностика инфекционных болезней на самых ранних стадиях заболевания;
■ возможна количественная оценка результатов исследований (сколько вирусов или бактерий содержится в исследуемом материале);
■ высокая чувствительность метода.
Современные методы диагностики инфекции - это ПЦР и ИФА.
Иммуноферментный анализ (ИФА) — лабораторный иммунологический метод качественного или количественного определения различных соединений, макромолекул, вирусов и пр., в основе которого лежит специфическая реакция антиген-антитело. Выявление образовавшегося комплекса проводят с использованием фермента в качестве метки для регистрации сигнала.
Методы диагностики наследственных заболеваний:
Диагностическая чувствительность и специфичность методов различна — одни позволяют только предположить наличие заболевания, другие с большой точностью выявляют мутации, лежащие в основе болезни или определяющие особенности её течения.
Цитогенетические методы применяют для диагностики хромосомных болезней. Они включают:
■ исследования полового хроматина — определение Х- и Y-хроматина (скрининговый метод, метод экспресс-диагностики пола, исследуют клетки слизистой оболочки ротовой полости, вагинального эпителия или волосяной луковицы. По наличию/отсутствию инактивированной хромосомы –тельца Барра судят о наличии синдрома Кляйнфельтера 47 ХХY у мужчин и синдроме Шерешевского−Тернера 45Х0 у женщин)
■ кариотипирование (кариотип — совокупность хромосом клетки) — определение количества и структуры хромосом с целью диагностики хромосомных болезней (геномных мутаций и хромосомных аберраций).
(используют препараты кратковременной культуры крови, а также клетки костного мозга и культуры фибробластов. кровь с антикоагулянтом подвергают центрифугированию для осаждения эритроцитов, а лейкоциты инкубируют в культуральной среде 2−3 дня. К образцу крови добавляют фитогемагглютинин, т.к. он ускоряет агглютинацию эритроцитов и стимулирует деление лимфоцитов. Каждая хромосома реплицируется и после соответствующей окраски видна в виде двух хроматид, прикреплённых к центромере, или центральной перетяжке. Затем клетки обрабатывают гипотоническим раствором хлорида натрия, фиксируют и окрашивают. (краситель Романовского−Гимзы, 2% ацеткармин или 2% ацетарсеин). Диагноз хромосомной болезни ставят только после исследования кариотипа. Метафазные пластинки отдельных клеток фотографируют. Из фотографий вырезают индивидуальные хромосомы и наклеивают их по порядку на лист бумаги; такая картина хромосом называется кариотипом.
Для описания кариотипа человека разработана специальная номенклатура. Нормальный кариотип мужчины и женщины обозначают как 46, ХY и 46, ХХ соответственно. При наличии структурной аномалии хромосомы необходимо указать изменённое длинное или короткое плечо: p- короткое плечо, q - длинное плечо, t - транслокацию.)
Понятие о геномике и протеомике:
С тех пор как в конце XX в. генетиками было сформулировано понятие «геном», генетику как науку стали именовать геномикой. В результате ее развития в 1995 г. появилось еще одно новое название - протеомика. Современное определение клинической геномики и протеомики можно сформулировать так: учение о молекулярной структуре и функционировании генетического материала, контролирующего происхождение, развитие, воспроизводство и наследование индивидуальных особенностей организма, проявляющихся на доклиническом и клиническом уровнях у больного человека, его больных и здоровых родственников.
Протеомика — наука, основным предметом изучения которой являются белки, их функции и взаимодействия в живых организмах, в том числе — в человеческом. Основная задача протеомики — количественный анализ экспрессии белков в клетках в зависимости от их типа, состояния или влияния внешних условий. Протеомика осуществляет сравнительный анализ больших групп белков — от всех белков, вовлеченных в тот или иной биологический процесс до полного протеома.
Преимуществом протеомики перед геномикой является тот факт, что наличие какого-либо гена в геноме не означает, что с него производится транскрипция, а наличие транскрипта не означает, что с него происходит трансляция, а даже если происходит, то транскрипт не позволяет однозначно говорить о структуре белка, его созревании и локализации.
Применения в медицине:
Сравнение протеомов здорового и больного пациентов позволяет выявить конкретные белки, потенциально вовлеченные в развитие болезни, которые в дальнейшем могут стать мишенями для новых лекарственных препаратов. Кроме того, если такие белки уже известны, анализ протеома может использоваться как метод ранней диагностики. Анализ протеома дает больше информации, чем сравнение уровня экспресии по мРНК, так как учитывает еще и посттрансляционные модификации и альтернативный сплайсинг.
Одним из важнейших инструментов протеомики является масс-спектрометрия белков — метод, позволяющий установить количественный и качественный состав в исследуемом образце, будь то очищенный и выделенный белок или клеточный лизат.
Масс-спектрометрия — метод исследования вещества, основанный на определении отношения массы к заряду ионов, образующихся при ионизации представляющих интерес компонентов пробы. Один из мощнейших способов качественной идентификации веществ, допускающий также и количественное определение
