
- •Часть I
- •Оглавление
- •Соединения кислорода и серы
- •Лекарственные средства группы водорода пероксида
- •Гидроперит Hydroperitum
- •Химические свойства водорода пероксида
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •1 Молекула МgO2 → 1 молекула h2o2
- •Определение стабилизатора натрия бензоата в растворе водорода пероксида
- •Хранение
- •Вода для инъекций Aqua pro injectionibus
- •Анализ воды очищенной и воды для инъекций в условиях аптек
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Формы выпуска
- •Галогены и их соединения со щелочными металлами Общая характеристика
- •Распространение в природе
- •Биологическое значение
- •Медицинское значение
- •Галогены
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Соли галогенводородных кислот
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определене
- •Хранение
- •Применение
- •Получение
- •Описание и растворимость
- •Подлинность
- •Количественное определение
- •Описание и растворимость
- •Физические и химические свойства
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Распространение в природе
- •Биологическая роль
- •Соединения магния
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Соединения кальция
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Распространение в природе
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Формы выпуска
- •Соединения алюминия
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Соединения цинка
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Количественное определение
- •Количественное определение
- •Хранение
- •Применение
- •Формы выпуска
Описание и растворимость
Раствор водорода пероксида – бесцветная прозрачная жидкость без запаха слабокислой реакции среды.
Магния пероксид – белый порошок без запаха. Практически нерастворим в воде, растворим в разведенных минеральных кислотах и кипящей кислоте уксусной разведенной с выделением водорода пероксида:
МgO2 + MgO + 2H2SO4 → 2MgSO4 + H2O2 + H2O
Гидроперит – белый кристаллический порошок. Легко растворим в воде, растворим в этаноле.
Подлинность
1. Общая реакция – реакция образования надхромовых кислот. Основана на окислительных свойствах водорода пероксида. Калия дихромат в кислой среде окисляется водорода пероксидом до перекисных соединений. Образуются надхромовая кислота и хрома пентаоксид, неустойчивые в водной среде. Продукты окисления извлекают в слой эфира, который окрашивается в синий цвет.
K2Cr2O7 + H2SO4 H2Cr2O7 + K2SO4
Двухромовая кислота
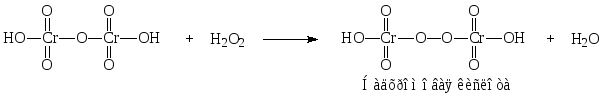
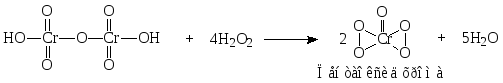
Магния пероксид для проведения этой реакции растворяют в кислоте серной разведенной.
2. Специфические реакции.
2.1. Магния пероксид. Доказывают катион магния (после растворения ЛВ в кислоте серной разведенной) по реакции осаждения с натрия гидрофосфатом в присутствии аммония гидроксида и аммония хлорида:
NH4Cl
MgSO4 + Na2HPO4 + NH4OH → MgNH4PO4↓ + Na2SO4 + H2O
Образуется белый кристаллический осадок магния аммония фосфата, растворимый в разведенных минеральных кислотах и в кислоте уксусной.
2.2. Гидроперит. Доказывают присутствие мочевины биуретовой реакцией. При медленном нагревании мочевины до 150-160 0С образуется биурет, который в щелочной среде с солями меди (II) образует комплексные соединения, окрашенные в фиолетовый цвет:
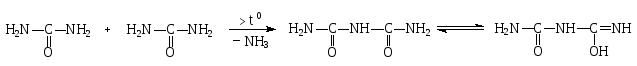
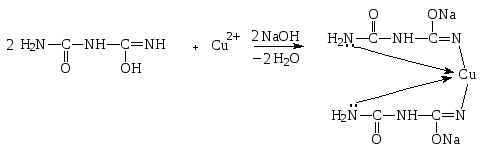
Фиолетовое окрашивание
Чистота
У раствора водорода пероксида определяют рН потенциометрическим методом (рН должно быть 3,8-5,6).
В магния пероксиде и гидроперите определяют:
1. Допустимые общие примеси – хлориды, сульфаты, кальций, железо.
2. Потерю в массе при высушивании.
Количественное определение
1. Перманганатометрический метод. Основан на восстановительных свойствах водорода пероксида, который окисляется до кислорода и восстанавливает Mn (+7) до Mn (+2). Титрование проводят в присутствии кислоты серной разведенной без индикатора до появления устойчивого розового окрашивания:
5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 + 2MnSO4 + K2SO4 + 8H2О
H2O2 –2ē → 2H+ + O2
fэкв.(водорода пероксида) = 1/2
Магния пероксид предварительно растворяют в кислоте серной разведенной и затем титруют выделившийся водорода пероксид.
1 Молекула МgO2 → 1 молекула h2o2
fэкв.(магния пероксида) = 1/2
2. Йодометрический метод. Основан на окислительных свойствах водорода пероксида, который окисляет калия йодид до йода в кислой среде. Выделившийся йод титруют раствором натрия тиосульфата (титрование по заместителю). Индикатор – крахмал.
H2O2 + 2KI + H2SO4 → I2 + K2SO4 + 2H2O
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
H2O2 + 2H+ +2ē → 2H2O
fэкв.(водорода пероксида) = 1/2
