
- •Часть I
- •Оглавление
- •Соединения кислорода и серы
- •Лекарственные средства группы водорода пероксида
- •Гидроперит Hydroperitum
- •Химические свойства водорода пероксида
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •1 Молекула МgO2 → 1 молекула h2o2
- •Определение стабилизатора натрия бензоата в растворе водорода пероксида
- •Хранение
- •Вода для инъекций Aqua pro injectionibus
- •Анализ воды очищенной и воды для инъекций в условиях аптек
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Формы выпуска
- •Галогены и их соединения со щелочными металлами Общая характеристика
- •Распространение в природе
- •Биологическое значение
- •Медицинское значение
- •Галогены
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Соли галогенводородных кислот
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определене
- •Хранение
- •Применение
- •Получение
- •Описание и растворимость
- •Подлинность
- •Количественное определение
- •Описание и растворимость
- •Физические и химические свойства
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Распространение в природе
- •Биологическая роль
- •Соединения магния
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Соединения кальция
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Распространение в природе
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Формы выпуска
- •Соединения алюминия
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Соединения цинка
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Количественное определение
- •Количественное определение
- •Хранение
- •Применение
- •Формы выпуска
Количественное определение
Гравиметрический метод. Точную навеску бария сульфата кипятят с кислотой хлороводородной разведенной, фильтруют. На фильтре остается бария сульфат, т.к. он в кислотах нерастворим. Осадок на фильтре промывают водой, затем сжигают вместе с фильтром и прокаливают до постоянной массы при 800 0С. Охлаждают и взвешивают.
Хранение
В сухом месте, в заводской двойной упаковке. Внутренняя упаковка должна быть из пергаментной бумаги. Не допускается хранение рядом с карбонатами.
Применение
Рентгеноконтрастное средство.
Формы выпуска
Субстанция в упаковке по 100 г.
СОЕДИНЕНИЯ ВИСМУТА, АЛЮМИНИЯ, ЦИНКА, МЕДИ,
СЕРЕБРА, ЖЕЛЕЗА
Общая характеристика
Висмут – элемент V группы главной подгруппы периодической системы. Является р-элементом. На внешнем электронном слое имеет 5 электронов. В соединениях наиболее характерны степени окисления –3, +3, +5.
Алюминий – элемент III группы главной подгруппы. Также является р-элементом. На внешнем электронном слое содержит 3 электрона. В соединениях проявляет степень окисления +3.
Цинк – элемент II группы побочной подгруппы. Является d-элементом. На внешнем электронном слое имеет 2 электрона. Характерна степень окисления +2.
Серебро и медь – элементы I группы побочной подгруппы. Являются d-элементами. На внешнем электронном слое имеют 1 электрон. В соединениях наиболее характерны степени окисления: серебро – +1, медь – +1 и +2.
Железо – элемент VIII группы. Является d-элементом. На внешнем и предвнешнем электронном слое имеет 8 электронов. Наиболее характерны степени окисления +2 и +3.
Данные элементы обладают восстановительными свойствами. Наиболее сильными восстановителями являются алюминий, цинк, железо. В ряду стандартных электродных потенциалов они располагаются до водорода, поэтому переходят в катионы под действием всех кислот. Серебро, медь и висмут – более слабые восстановители. В ряду стандартных электродных потенциалов находятся после водорода. Эти металлы окисляются кислотами, проявляющими окислительные свойства (например, HNO3).
Катионы данных металлов проявляют свойства окислителей, у Al+3, Zn+2, Fe2+ и Bi+3 они выражены очень слабо.
Соединения элементов способны вступать в реакции осаждения, комплексообразования.
Алюминий, цинк, медь, железо и их соединения обладают амфотерными свойствами. Более сильно амфотерные свойства выражены у соединений алюминия и цинка.
Распространение в природе
В природе чаще всего встречаются в виде сульфидов: ZnS – цинковая обманка; Bi2S3 – висмутовый блеск; Ag2S – серебряный блеск; CuFeS2 – медный колчедан, и в виде ряда других соединений, например, Bi2О3 – висмутовая охра, Al2O3 – корунд, Al2O3 n H2O – боксит, ZnCO3 – цинковый шпат и др.
Медицинское значение
ЛС данной группы соединений обладают широкой терапевтической активностью. Применяются в качестве антисептических, подсушивающих, вяжущих, прижигающих, противовоспалительных и антианемических средств.
Многие металлы являются необходимыми микроэлементами для жизнедеятельности организма и входят в состав ферментов. Железо и медь участвуют в окислительно-восстановительных реакциях в организме. Они необходимы для синтеза гемоглобина. Цинк регулирует иммунные и метаболические процессы.
СОЕДИНЕНИЯ ВИСМУТА
Висмута нитрат основной
Bismuthi subnitras
Химический состав висмута нитрата основного непостоянен. Представляет собой смесь основных солей висмута и небольших количеств висмута нитрата и висмута гидроксида.
Получение
Висмута нитрат основной получают окислением металлического висмута концентрированной азотной кислотой:
Bi + 4HNO3 Bi(NO3)3 + NO + 2H2O
Висмута нитрат гидролизуется с образованием смеси основных солей висмута:
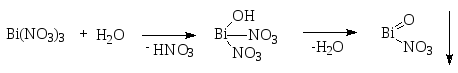
Висмутила нитрат
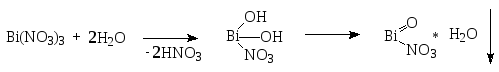
Висмутила нитрата гидрат

Висмутила гидроксид
Основные соли адсорбируют висмута нитрат Bi(NO3)3 и висмута гидроксид Bi(OH)3.
Описание и растворимость
Белый аморфный или мелкокристаллический порошок, без запаха. Практически нерастворим в воде и спирте. Легко растворим в разведенных минеральных кислотах – азотной, хлороводородной, серной. Порошок, смоченный водой, окрашивает синюю лакмусовую бумагу в красный цвет, так как при гидролизе вещества выделяется кислота азотная:
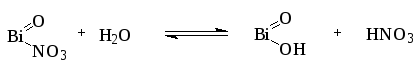
Подлинность
Для проведения реакций подлинности ЛВ растворяют в разбавленной кислоте хлороводородной или серной:
ЛВ + 3HCl BiCl3 + 3H+
1. Реакция осаждения раствором натрия гидроксида или раствором аммиака:
Bi3+ + 3NaOH Bi(OH)3 + 3Na+
Образуется белый осадок висмута гидроксида, нерастворимый в избытке реактива и растворимый в минеральных кислотах.
2. Реакция осаждения раствором натрия сульфида:
2Bi3+ + 3Na2S Bi2S3 + 6Na+
Коричнево-черный
осадок
Осадок висмута сульфида нерастворим в минеральных кислотах.
3. Реакция осаждения и комплексообразования с раствором калия йодида.
Ион висмута с раствором калия йодида образует черный осадок висмута йодида:
Bi3+ + 3KI BiI3 + 3K+
2 капли Черный осадок
Осадок растворяется в избытке реактива с образованием желто-оранжевого раствора комплексного соединения – калия тетрайодвисмутата (III):
BiI3 + KI K[BiI4]
Избыток Желто-оранжевое окрашивание
4. При прокаливании ЛВ образуется остаток ярко-желтого цвета и выделяются бурые пары азота (IV) оксида:
t 0
4BiO(NO3) 2Bi2O3 + 4NO2 + O2
Ярко-желтый Бурые
остаток пары
5. Доказательство нитрат-иона. Реакция с раствором дифениламина в кислоте серной концентрированной. Дифениламин окисляется нитратами до дифенилдифенохинондиимина гидросульфата, окрашенного в синий цвет (см. с. 10).
