
- •Часть I
- •Оглавление
- •Соединения кислорода и серы
- •Лекарственные средства группы водорода пероксида
- •Гидроперит Hydroperitum
- •Химические свойства водорода пероксида
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •1 Молекула МgO2 → 1 молекула h2o2
- •Определение стабилизатора натрия бензоата в растворе водорода пероксида
- •Хранение
- •Вода для инъекций Aqua pro injectionibus
- •Анализ воды очищенной и воды для инъекций в условиях аптек
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Формы выпуска
- •Галогены и их соединения со щелочными металлами Общая характеристика
- •Распространение в природе
- •Биологическое значение
- •Медицинское значение
- •Галогены
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Соли галогенводородных кислот
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определене
- •Хранение
- •Применение
- •Получение
- •Описание и растворимость
- •Подлинность
- •Количественное определение
- •Описание и растворимость
- •Физические и химические свойства
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Распространение в природе
- •Биологическая роль
- •Соединения магния
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Соединения кальция
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Распространение в природе
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Формы выпуска
- •Соединения алюминия
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Соединения цинка
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Количественное определение
- •Количественное определение
- •Хранение
- •Применение
- •Формы выпуска
Количественное определение
Кислота борная определяется алкалиметрическим методом нейтрализации в присутствии глицерина (нейтрализованного по фенолфталеину). Метод основан на кислотных свойствах кислоты глицеринборной. Индикатор – фенолфталеин.
Уравнение метода:

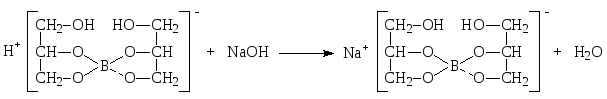
f экв.(кислоты борной) = 1,
так как из одной молекулы кислоты борной образуется одна молекула одноосновной кислоты глицеринборной.
Образующаяся при титровании натриевая соль кислоты глицеринборной частично может гидролизоваться. В этом случае розовое окрашивание по фенолфталеину может появиться раньше точки эквивалентности. Поэтому после появления розового окрашивания добавляют еще порцию глицерина и, если окраска исчезла, продолжают титровать.
Оттитровать кислоту борную раствором натрия гидроксида без добавления глицерина невозможно, так как при этом будут образовываться сильно гидролизующиеся соли.
Натрия тетраборат определяют ацидиметрическим методом вытеснения. Метод основан на вытеснении слабой борной кислоты из соли при действии сильной минеральной кислоты. Проводят прямое титрование раствором кислоты хлороводородной, индикатор – метиловый оранжевый.
Na2B4O7 • 10H2O + 2HCl → 4H3BO3 + 2NaCl + 5H2O
f экв.(натрия тетрабората) = 1/2
Хранение
В хорошо укупоренной таре. Кислота борная устойчива при хранении, натрия тетраборат может выветриваться.
Применение
Наружно как антисептические средства в виде водных, спиртовых и глицериновых растворов, мазей, присыпок
Формы выпуска
Кислота борная – субстанция; 1-2-3% спиртовые растворы, 10% раствор в глицерине, 5% мазь.
Натрия тетраборат – субстанция.
СОЕДИНЕНИЯ УГЛЕРОДА
Углерод – элемент главной подгруппы четвертой группы периодической системы. В качестве лекарственных средств, содержащих углерод, применяются соли угольной кислоты и щелочных металлов.
Угольная кислота образует два типа солей:
- карбонаты – средние соли;
- гидрокарбонаты – кислые соли.
В качестве лекарственных средств применяются:
|
Натрия гидрокарбонат NaHCO3
|
|
Sodium hydrocarbonate (МНН) Natrii hydrocarbonas (ЛН) |
|
Лития карбонат Li2CO3 |
|
Lithium carbonate (МНН) Lithii carbonas (ЛН) |
Получение
Натрия гидрокарбонат. Концентрированный раствор натрия хлорида насыщают аммиаком при охлаждении и пропускают через этот раствор диоксид углерода (под давлением):
NaCl + NH3 + CO2 +H2O → NH4Cl + NaHCO3
Образующийся натрия гидрокарбонат растворяется в воде хуже, чем аммония хлорид, поэтому осаждается, и его отфильтровывают.
Для очистки натрия гидрокарбонат прокаливают, при этом образуется натрия карбонат и удаляется примесь аммония хлорида:
t o
2NaHCO3 → Na2CO3 + CO2 + H2O
t o
NH4Cl NH3 + HCl
Раствор очищенного натрия карбоната насыщают диоксидом углерода (под давлением) и получают натрия гидрокарбонат:
Na2CO3 + CO2 + H2O → 2NaHCO3
Лития карбонат.
1. Получают из водорастворимых солей лития при действии натрия карбоната:
2LiCl + Na2CO3 → 2NaCl + Li2CO3
2. Пропусканием диоксида углерода через раствор лития гидроксида:
2LiOH + CO2 → Li2CO3 + H2O
