
- •Часть I
- •Оглавление
- •Соединения кислорода и серы
- •Лекарственные средства группы водорода пероксида
- •Гидроперит Hydroperitum
- •Химические свойства водорода пероксида
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •1 Молекула МgO2 → 1 молекула h2o2
- •Определение стабилизатора натрия бензоата в растворе водорода пероксида
- •Хранение
- •Вода для инъекций Aqua pro injectionibus
- •Анализ воды очищенной и воды для инъекций в условиях аптек
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Формы выпуска
- •Галогены и их соединения со щелочными металлами Общая характеристика
- •Распространение в природе
- •Биологическое значение
- •Медицинское значение
- •Галогены
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Соли галогенводородных кислот
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определене
- •Хранение
- •Применение
- •Получение
- •Описание и растворимость
- •Подлинность
- •Количественное определение
- •Описание и растворимость
- •Физические и химические свойства
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Распространение в природе
- •Биологическая роль
- •Соединения магния
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Соединения кальция
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Распространение в природе
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Формы выпуска
- •Соединения алюминия
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Соединения цинка
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Количественное определение
- •Количественное определение
- •Хранение
- •Применение
- •Формы выпуска
Подлинность
Для проведения реакций подлинности магния оксид растворяют в кислоте хлороводородной разведенной, магния сульфат – в воде.
MgO + 2HCl → MgСI2 + H2O
1. Доказательство катиона магния (Mg2+).
1.1. Реакция осаждения натрия гидрофосфатом в присутствии аммония гидроксида и аммония хлорида:
Mg2+ + Na2HPO4 + NH4OH → MgNH4PO4↓ + 2Na+ + H2O
Образуется белый кристаллический осадок магния аммония фосфата, растворимый в минеральных кислотах и кислоте уксусной.
1.2. Реакция комплексообразования с 8-оксихинолином:
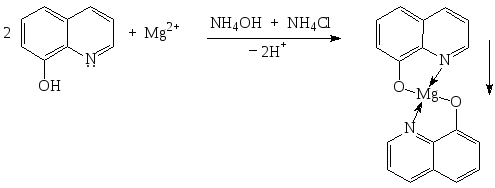
Желто-зеленый осадок
2. Доказательство сульфат-иона в магния сульфате. Реакция осаждения раствором бария хлорида:
MgSO4 + ВаСI2 → ВаSO4↓ + MgСI2
Образуется белый осадок бария сульфата, нерастворимый в разведенных кислотах.
Чистота
1. Прозрачность и цветность водного раствора магния сульфата и раствора магния оксида в кислоте уксусной.
2. Потеря в массе при высушивании.
3. Предельное содержание примеси карбонатов щелочных металлов, растворимых солей, общих примесей; солей марганца и др.
Количественное определение
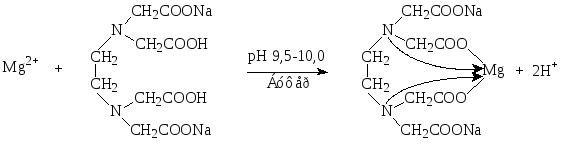
1. Комплексонометрический метод. Вариант прямого титрования. Метод основан на свойстве ионов магния количественно вступать в реакцию с комплексоном (трилоном Б) с образованием прочных, растворимых в воде, бесцветных внутрикомплексных соединений.
Титрант: раствор трилона Б – динатриевая соль этилендиаминотетрауксусной кислоты (сокращенно – Na2H2ТrБ).
Индикаторы: металлоиндикаторы – органические красители, имеющие различную окраску в свободном виде и виде комплекса с металлом, который менее прочный, чем комплекс трилона Б с металлом. Изменение окраски металлоиндикаторов зависит от pH среды.
Определение солей магния проводят в среде аммиачного буфера при рН 9,5-10,0. Индикатор – кислотный хром черный специальный (эриохром черный Т). Переход окраски от красно-фиолетовой к синей.
Магния оксид предварительно растворяют в кислоте хлороводородной разведенной.
Mg2+ + H2Ind MgInd + 2H+
Окраска раствора за счет
комплекса металла с индикатором
В точке эквивалентности:
MgInd + Na2H2ТrБ MgNa2ТrБ + H2Ind
Окраска раствора за счет
свободного индикатора
fэкв (ЛВ) = 1
2. Ацидиметрический метод нейтрализации (вариант обратного титрования). Используется для количественного определения магния оксида. Метод основан на свойстве магния оксида количественно взаимодействовать с кислотой хлороводородной с образованием соли:
MgO + 2HCI → MgCI2 + 2H2O
Избыток
HCI + NaOH → NaCI + H2O
Остаток
fэкв (магния оксида) = Ѕ
Хранение
По общему списку, в хорошо укупоренной таре. Магния сульфат при нарушении условий хранения постепенно теряет кристаллизационную воду (выветривается); магния оксид взаимодействует с углекислым газом и влагой, содержащимися в воздухе, образуя примесь карбоната и магния гидроксида:
MgO + CO2 → MgCO3
MgO + H2O → Mg(OH)2
