
- •Часть I
- •Оглавление
- •Соединения кислорода и серы
- •Лекарственные средства группы водорода пероксида
- •Гидроперит Hydroperitum
- •Химические свойства водорода пероксида
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •1 Молекула МgO2 → 1 молекула h2o2
- •Определение стабилизатора натрия бензоата в растворе водорода пероксида
- •Хранение
- •Вода для инъекций Aqua pro injectionibus
- •Анализ воды очищенной и воды для инъекций в условиях аптек
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Формы выпуска
- •Галогены и их соединения со щелочными металлами Общая характеристика
- •Распространение в природе
- •Биологическое значение
- •Медицинское значение
- •Галогены
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Соли галогенводородных кислот
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определене
- •Хранение
- •Применение
- •Получение
- •Описание и растворимость
- •Подлинность
- •Количественное определение
- •Описание и растворимость
- •Физические и химические свойства
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Распространение в природе
- •Биологическая роль
- •Соединения магния
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Соединения кальция
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Распространение в природе
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Формы выпуска
- •Соединения алюминия
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Соединения цинка
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Количественное определение
- •Количественное определение
- •Хранение
- •Применение
- •Формы выпуска
Чистота
1. Отсутствие солей железа, меди, алюминия. При добавлении к раствору ЛВ избытка раствора аммиака раствор должен оставаться прозрачным и бесцветным. Соли цинка взаимодействуют с избытком раствора аммиака, образуя растворимые, бесцветные комплексные соединения:
Zn2+ + 4NH4OH Zn[(NH3)4]2+ + 4H2O
Бесцветный раствор
При наличии примесей протекают реакции:
Fe 3+ + 3NH4OH Fe(OH)3 + 3NH4+
Красно-коричневый
Al 3+ + 3NH4OH Al(OH)3 + 3NH4+
Белый
Cu 2+ + 4NH4OH [Cu(NH3)4] 2+ + 4H2O
Синее окрашивание
Образование гидроксидов железа и алюминия вызывает помутнение раствора; образование аммиаката меди приводит к появлению окраски в испытуемом растворе.
3. Отсутствие солей магния и кальция. Определяют по реакции с раствором натрия фосфата. Не должно быть помутнения раствора.
3. В цинка оксиде – отсутствие карбонатов (ЛВ при хранении способно поглощать углекислый газ) по реакции с кислотой хлороводородной. Не должны выделяться пузырьки газа. При наличии примеси протекает реакция:
ZnCO3 + 2HCl ZnCl2 + CO2 + H2O
4. Потеря в массе при высушивании.
Количественное определение
Комплексонометрический метод. Основан на свойстве ионов цинка образовывать с трилоном Б прочные, бесцветные, растворимые в воде комплексные соединения. Способ прямого титрования. Цинка оксид предварительно растворяют в кислоте хлороводородной.
Химизм метода см. с. 44.
Используют 2 способа индикации:
1. Титрование проводят в присутствии индикатора ксиленолового оранжевого при рН 5-6. Необходимую реакцию среды создают добавлением раствора гексаметилентетрамина.
2. Титрование проводят в среде аммиачного буфера (рН=9-10) в присутствии индикатора – кислотного хром черного специального.
fэкв (ЛВ) = 1
Хранение
В хорошо укупоренной таре. Цинка оксид поглощает из воздуха углекислый газ:
ZnO + CO2 ZnCO3
Цинка сульфат является кристаллогидратом и на воздухе теряет кристаллизационную воду (выветривается).
Применение
Цинка оксид применяют наружно в качестве вяжущего, подсушивающего и дезинфицирующего средства при кожных заболеваниях.
Цинка сульфат – в качестве вяжущего и антисептического средства в офтальмологии, оториноларингологии, урологии.
СОЕДИНЕНИЯ МЕДИ
Меди сульфат Cupri sulfas
CuSO4 5H2O
Меди (II) сульфат
Получение
1. Из металлической меди действием кислоты серной в присутствии окислителей:
2Cu + 2H2SO4 + O2 2CuSO4 + H2O
3Cu + 3H2SO4 + 2HNO3 3CuSO4 + 4H2O + 2NO
2. Растворением меди (II) оксида в кислоте серной:
CuO + H2SO4 CuSO4 + H2O
Раствор упаривают до кристаллизации CuSO4 5H2O.
Описание и растворимость
Синие кристаллы или синий кристаллический порошок без запаха. Легко растворим в воде, практически нерастворим в спирте. Водные растворы имеют слабо-кислую реакцию среды, т.к. в водных растворах меди (II) сульфат подвергается гидролизу с выделением кислоты серной:
2CuSO4 + 2H2O Cu2(OH)2SO4 + H2SO4
Подлинность
1. Реакция восстановления меди (II) до металлической меди:
CuSO4 + Fe Cu + FeSO4
Железная пластинка покрывается красным налетом металлической меди.
2. Реакция осаждения раствором аммиака:
2CuSO4 + 2NH4OH Cu2(OH)2SO4 + (NH4)2SO4
Эквив. Голубой осадок
Осадок основной соли меди растворяется в избытке раствора аммиака с образованием комплексного соединения синего цвета:
Cu2(OH)2SO4 + 6NH4OH + (NH4)2SO4 2[Cu(NH3)4]SO4 + 8H2O
Избыток Синий раствор
3. Реакция осаждения раствором натрия гидроксида:
СuSO4 + 2NaOH Сu(OH)2 + Na2SO4
Эквив. Синий осадок
Образуется синий осадок, растворимый в избытке реактива (при рН 15) и в минеральных кислотах [меди (II) гидроксид проявляет слабые амфотерные свойства]:
Сu(OH)2 + 2NaOH Na2[Cu(OH)4]
Избыток Синий раствор
Сu(OH)2 + 2HCl СuCl2 + 2H2O
4. Реакция осаждения натрия сульфидом:
СuSO4 + Na2S СuS + Na2SO4
Черный осадок
Осадок меди (II) сульфида нерастворим в кислоте хлороводородной разведенной.
5. Реакция осаждения калия гексацианоферратом (II):
2СuSO4 + K4[Fe(CN)6] Сu2[Fe(CN)6] + 2K2SO4
Красно-коричневый осадок
Осадок меди (II) гексацианоферрат (II) нерастворим в разведенных кислотах, растворим в растворе аммиака.
6. Реакция комплексообразования с глицерином. Протекает в щелочной среде:
CuSO4 + 2NaOH Cu(OH)2 + Na2SO4
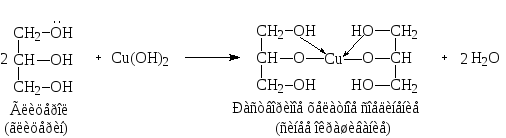
7. Реакция на сульфат-ион см. с. 44.
