
- •Часть I
- •Оглавление
- •Соединения кислорода и серы
- •Лекарственные средства группы водорода пероксида
- •Гидроперит Hydroperitum
- •Химические свойства водорода пероксида
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •1 Молекула МgO2 → 1 молекула h2o2
- •Определение стабилизатора натрия бензоата в растворе водорода пероксида
- •Хранение
- •Вода для инъекций Aqua pro injectionibus
- •Анализ воды очищенной и воды для инъекций в условиях аптек
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Формы выпуска
- •Галогены и их соединения со щелочными металлами Общая характеристика
- •Распространение в природе
- •Биологическое значение
- •Медицинское значение
- •Галогены
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Соли галогенводородных кислот
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определене
- •Хранение
- •Применение
- •Получение
- •Описание и растворимость
- •Подлинность
- •Количественное определение
- •Описание и растворимость
- •Физические и химические свойства
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Распространение в природе
- •Биологическая роль
- •Соединения магния
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Соединения кальция
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Распространение в природе
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Формы выпуска
- •Соединения алюминия
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Соединения цинка
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Количественное определение
- •Количественное определение
- •Хранение
- •Применение
- •Формы выпуска
Получение
1. Натрия хлорид получают из каменной соли, а также из подземных рассолов, воды озер и морей выпариванием. При этом остаются примеси. Очистку от них производят последовательно. Вначале осаждают сульфаты и фосфаты бария хлоридом:
Na2SO4 + BaCI2 BaSO4 + 2NaCl
Na2HPO4 + BaCI2 BaHPO4 + 2NaCl
Раствор натрия хлорида отделяют от осадка, нагревают и обрабатывают избытком натрия карбоната для осаждения примесей Mg2+, Ca2+ и Ba2+:
MgCl2 + Na2CO3 MgCO3 + 2NaCl
CaCl2 + Na2CO3 CaCO3 + 2NaCl
BaCl2 + Na2CO3 BaCO3 + 2NaCl
Раствор вновь отделяют от осадка и нейтрализуют кислотой хлороводородной для удаления карбонатов:
Na2CO3 + HCI 2NaCI + CO2↑ + H2O
Затем раствор, содержащий только натрия хлорид, упаривают до начала кристаллизации. Кристаллы отфильтровывают и высушивают.
2. Калия хлорид получают из сильвинита (KCl NaCl) или карналлита (KCl MgCl2 6H2O). Используют метод флотации (способ разделения мелких твердых частиц, основанный на различной смачиваемости и накопления на поверхности раздела фаз). Очищают, как и натрия хлорид.
3. Бромиды и йодиды получают из галогенидов железа. Железные стружки обрабатывают водой и добавляют бром или йод; протекают реакции окисления-восстановления:
3Fe + 4Br2 → FeBr2 2FeBr3 или (Fe3Br8)
Бромид железа (II) и (III)
3Fe + 4I2 → FeI2 2FeI3 или (Fe3I8)
Йодид железа (II) и (III)
Затем реакционную смесь нагревают до кипения и прибавляют раствор натрия карбоната:
Fe3Br8 + 4Na2CO3 + 4H2O → 8NaBr + 4CO2↑ + Fe(ОН)2↓ + 2Fe(ОН)3↓
Fe3I8 + 4Na2CO3 + 4H2O → 8NaI + 4CO2↑ + Fe(ОН)2↓ + 2Fe(ОН)3↓
Для получения калиевых солей используют раствор калия карбоната (К2CO3).
Раствор галогенида отделяют от гидроксидов железа (II) и (III), фильтрат подкисляют соответственно кислотой бромоводородной или йодоводородной для удаления избытка карбоната и упаривают до кристаллизации.
Описание и растворимость
Бесцветные или белые кристаллические порошки без запаха, соленого вкуса. Натрия бромид, натрия и калия йодиды гигроскопичны. Все ЛВ легко растворимы в воде. Йодиды легко растворимы в этаноле и глицерине.
Подлинность
Выполняют качественные реакции на соответствующие катионы и анионы.
Реакции на катионы:
Na+
1. Реакция осаждения цинка уранилацетатом в среде кислоты уксусной:
NaHal + Zn[(UO2)3(CH3COO)8] + CH3COOH + 9H2O →
NaZn[(UO2)3(CH3COO)9] 9H2O + НHal
Желтый кристаллический осадок
2. Соли натрия окрашивают бесцветное пламя в желтый цвет.
3. Микрокристаллическая реакция с кислотой пикриновой:
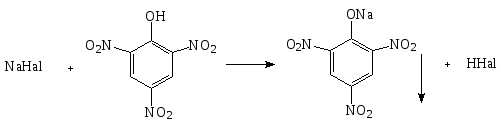
Образуется осадок натрия пикрата желтого цвета в виде игольчатых кристаллов, выходящих из одной точки.
К+
1. Реакция осаждения кислотой виннокаменной. Условия проведения реакции: охлаждение и потирание стеклянной палочкой.
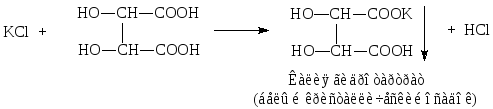
Осадок калия гидротартрата растворим в разведенных минеральных кислотах и в растворах натрия или калия гидроксида. Для связывания выделяющейся галогенводородной кислоты добавляют натрия ацетат:
HCI + CH3COONa NaCI + CH3COOH
2. Реакция осаждения натрия гексанитрокобальтатом (III) в уксуснокислой среде. Образуется желтый кристаллический осадок:
2KHal + Na3[Co(NO2)6] → K2Na[Co(NO2)6] + 2NaHal
Калия, натрия (2:1)
гексанитрокобальтат (III)
3 Соли калия окрашивают бесцветное пламя в фиолетовый цвет или при рассматривании через синее стекло – в пурпурно-красный.
Реакции на анионы:
1. Реакция осаждения серебра нитратом; проводится в азотнокислой среде:
(HNO3)
MeHal + AgNO3 AgHal + MeNO3
AgCI↓ – белый творожистый осадок, нерастворимый в кислоте азотной разведенной и растворимый в растворе аммиака:
AgCI↓ + 2NH4OH → [Ag(NH3)2]CI + 2H2O
AgBr↓ – желтоватый творожистый осадок, нерастворимый в кислоте азотной разведенной и трудно растворимый в растворе аммиака.
AgI↓ – желтый творожистый осадок, нерастворимый в кислоте азотной разведенной и в растворе аммиака.
2. Реакции окисления галогенид-ионов (бромидов и йодидов) до свободных галогенов. Основаны на восстановительных свойствах галогенид-ионов:
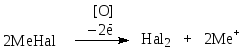
Образующиеся галогены извлекают в хлороформ и наблюдают окраску хлороформного слоя.
Галогениды отличаются по силе восстановительных свойств.
Хлориды являются очень слабыми восстановителями (Ео Cl2/2Cl– +1,36 В). Окисляются лишь сильными окислителями, при нагревании; образующийся хлор доказать трудно. Поэтому для доказательства хлоридов реакция окисления обычно не используется
Бромиды обладают более выраженными восстановительными свойствами (Ео Br2/2Br– +1,09 В); окисляются только сильными окислителями (KMnO4, Cl2).
Йодиды являются сильными восстановителями (Ео I2/2I– +0,54 В); окисляются и сильными, и слабыми окислителями.
2.1. Для доказательства бромид-иона в качестве окислителя используют раствор хлорамина в присутствии кислоты хлороводородной разведенной:
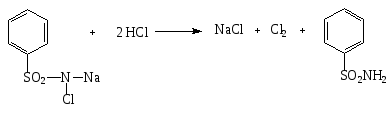
2KBr + CI2 → Br2 + 2KCI
Слой хлороформа окрашивается в желто-оранжевый цвет.
2.2. Для подтверждения подлинности йодид-ионов в качестве реагента используют слабые окислители, которые окисляют йодиды, но не окисляют бромид-ионы и хлорид-ионы (т.е. избирательные окислители).
2.2.1. Раствор железа (III) хлорида или раствор натрия нитрита:
2NaI + 2FeCI3 → I2 + 2FeCI2 + 2NaCI
2KI + 2NaNO2 + 2H2SO4 → I2 + K2 SO4 + Na2SO4 + 2NO↑ + 2H2O
Слой хлороформа окрашивается в фиолетовый цвет.
2.2.2. Кислота серная концентрированная:
2NaI + H2SO4 → Na2SO3 + I2 + H2O
Наблюдают выделение фиолетовых паров йода.
