
- •Часть I
- •Оглавление
- •Соединения кислорода и серы
- •Лекарственные средства группы водорода пероксида
- •Гидроперит Hydroperitum
- •Химические свойства водорода пероксида
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •1 Молекула МgO2 → 1 молекула h2o2
- •Определение стабилизатора натрия бензоата в растворе водорода пероксида
- •Хранение
- •Вода для инъекций Aqua pro injectionibus
- •Анализ воды очищенной и воды для инъекций в условиях аптек
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Формы выпуска
- •Галогены и их соединения со щелочными металлами Общая характеристика
- •Распространение в природе
- •Биологическое значение
- •Медицинское значение
- •Галогены
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Соли галогенводородных кислот
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определене
- •Хранение
- •Применение
- •Получение
- •Описание и растворимость
- •Подлинность
- •Количественное определение
- •Описание и растворимость
- •Физические и химические свойства
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Распространение в природе
- •Биологическая роль
- •Соединения магния
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Соединения кальция
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Распространение в природе
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Формы выпуска
- •Соединения алюминия
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Соединения цинка
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Количественное определение
- •Количественное определение
- •Хранение
- •Применение
- •Формы выпуска
Описание и растворимость
Белые рыхлые аморфные порошки. Практически нерастворимы в воде, растворимы при нагревании в разведенных минеральных кислотах и растворах щелочей с образованием прозрачных или слабо-мутных растворов (ЛВ являются амфотерными соединениями):
Al(OH)3 + 3HCl AlCl3 + 3H2O
Al(OH)3 + NaOH Na[Al(OH)4]
Подлинность
1. Общие реакции подлинности.
1.1. При прокаливании с раствором кобальта нитрата образуется кобальта алюминат синего цвета – «тенарова синь»:
4Al3+ + 2Co(NO3)2 2Co(AlO2)2 + 4NO
1.2. Реакции комплексообразования:
- с морином. Наблюдается желтое окрашивание, после добавления кислоты уксусной – зелено-желтая флуоресценция;
- с ализарином – ярко-красное окрашивание;
- с 8-оксихинолином – белый осадок.
1.3. Реакция осаждения раствором натрия гидроксида или раствором аммиака после растворения ЛВ в кислоте хлороводородной:
Al(OH)3 + 3HCl AlCl3 + 3H2O
AlPO4 + 3HCl AlCl3 + H3PO4
AlCl3 + 3NaOH Al(OH)3 + 3NaCl
AlCl3 + 3NH4OН Al(OH)3 + 3NH4Cl
Образуется белый желатинообразный гель алюминия гидроксида, растворимый в избытке раствора натрия гидроксида и в минеральных кислотах (амфотерные свойства), нерастворимый в избытке раствора аммиака.
Al(OH)3 + NaOH Na[Al(OH)4]
Избыток
2. Специфическая реакция на алюминия фосфат.
Реакция осаждения фосфат-иона магния сульфатом в присутствии раствора аммиака и аммония хлорида. Предварительно ЛВ растворяют в кислоте хлороводородной:
AlPO4 + 3HCl AlCl3 + H3PO4
NH4Cl
H3PO4 + MgSO4 + NH4OН MgNH4PO4 + H2SO4 + H2O
Белый осадок
Образуется белый кристаллический осадок магния аммония фосфата, растворимый в разведенных минеральных кислотах и кислоте уксусной.
Чистота
Определяют предельное содержание общих примесей: хлоридов, сульфатов, тяжелых металлов, мышьяка.
Количественное определение
Комплексонометрический метод, вариант обратного титрования. Избыток трилона Б титруют раствором свинца нитрата в присутствии гексаметилентетрамина при рН 6. Индикатор – ксиленоловый оранжевый.
ЛВ предварительно растворяют в кислоте хлороводородной:
Al(OH)3 + 3HCl AlCl3 + 3H2O
AlPO4 + 3HCl AlCl3 + H3PO4

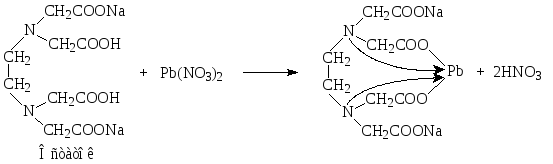
В точке эквивалентности: H2Ind + Pb2+ PbInd + 2H+
Окраска раствора Окраска раствора за счет
за счет свободного комплекса металла с индикатором
индикатора
fэкв (ЛВ) = 1
Хранение
В хорошо укупоренной таре по общему списку.
Применение
Антацидные, адсорбирующие и обволакивающие средства.
Соединения цинка
|
Лекарственное вещество. Химическая формула
|
МНН и латинское название |
Формы выпуска |
|
Цинка окись, цинка оксид ZnO
|
Zinc oxide* Zinci oxydum
|
Субстанция, мази, пасты, линименты
|
|
Цинка сульфат ZnSO4 7H2O
|
Zinc sulfаte* Zinci sulfas
|
Субстанция, глазные капли 0,25% и 0,5%
|
