
Часть 2
.PDF
478 ГЛАВА 11. Сердце
A |
Б |
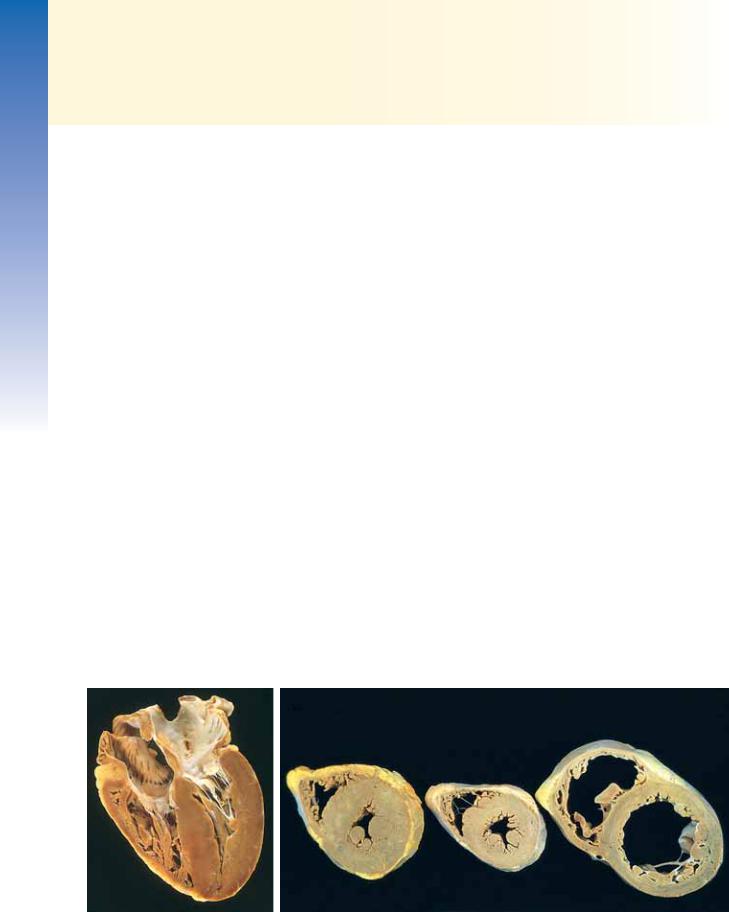
Рис. 11.11. Последствия ишемии миокарда с последующей реперфузией. А и Б — макроскопическая и микроскопическая картина миокарда после реперфузии. А — крупный геморрагический инфаркт миокарда передней стенки у пациента, получавшего стрептокиназу (окраска хлоридом трифенилтетразолия; поперечное сечение, задняя стенка расположена сверху). Б — некроз миокарда с геморрагиями и сократительными полосками, которые визуализируются как гиперэозинофильные соединения, связывающие мышечные волокна (стрелка)
восстановит нормальную функцию, нарушения биохимических процессов в клетках могут сохраняться
втечение нескольких дней после ишемии и приводить к отсутствию сократимости (оглушенный миокард). Подобное патологическое состояние может привести к временной, обратимой сердечной недостаточности, нередко требующей вспомогательного кровообращения для поддержания жизнедеятельности пациента на время восстановления функций сердца.
Клинические проявления. ИМ обычно описывают как острую сжимающую боль за грудиной или как дискомфорт, иррадиирующий в шею, нижнюю челюсть, эпигастральную область или левую руку. В отличие от боли при стенокардии, боль при ИМ длится от 20 мин до нескольких часов и значительно не облегчается
впокое или при применении нитроглицерина. У меньшего (но достаточного) количества пациентов (10–15%) ИМ может быть бессимптомным. Подобные «немые» инфаркты особенно часто происходят при сахарном диабете (с периферической диабетической нейропатией) и в пожилом возрасте.
Для ИМ обычно характерны частый и слабый пульс, у пациента иногда возникают тошнота и рвота, особенно при ИМ задней стенки. Часто развивается одышка, связанная со снижением сократимости миокарда и дисфункцией митрального клапана; это может приводить к застою и отеку легких. При массивном ИМ (поражающем более 40% левого желудочка) развивается кардиогенный шок.
Электрокардиографические нарушения — важный признак ИМ; к ним относят следующие изменения: появление зубцов Q (указывают на трансмуральный инфаркт), изменение сегмента ST и инверсию зубца Т (отражают нарушения реполяризации миокарда). Часто регистрируют аритмии, вызванные электрическими нарушениями в ишемизированном миокарде, нарушения проводимости; на самом деле ВСС, вызванная летальной аритмией, служит причиной подавляющего количества смертей на догоспитальном этапе при ИМ.
Лабораторное подтверждение ИМ основано на измерении в крови уровня внутриклеточных молекул, покидающих клетки через поврежденную клеточную мембрану. К таким молекулам относят миоглобин, сердечные тропонины T и I (TnI и TnT), креатинкиназу
(КФК) и особенно специфичную для миокарда изоформу МВ-КФК, лактатдегидрогеназу (ЛДГ) и многие другие. Для поражения миокарда высокоспецифичны и чувствительны тропонины и МВ-КФК.
TnI и TnT в норме не определяются в циркулирующей крови, но после острого ИМ тропонины становятся доступными для определения через 2–4 ч с пиком концентрации через 48 ч; их уровень остается повышенным в течение 7–10 сут. МВ-КФК — второй характерный маркер после кардиоспецифичных тропонинов. Так как обнаружено множество форм КФК в мозге, миокарде и скелетных мышцах, общую активность КФК не следует считать надежным индикатором поражения сердца (может указывать, например, на поражение скелетной мускулатуры). Только МВ-КФК — изоформа, которая в основном высвобождается из миокарда, но также присутствует в небольшом количестве в скелетной мускулатуре, — более специфичный индикатор поражения сердца. Активность МВ-КФК начинает повышаться через 2–4 ч после ИМ с пиком через 24–48 ч и возвращается к нормальному уровню примерно через 72 ч. Хотя сердечные тропонины и МВ-КФК в одинаковой степени чувствительны на ранних стадиях ИМ, повышенные уровни тропонинов в течение 10 дней после ИМ позволяют устанавливать диагноз инфаркта миокарда в более поздние сроки (значения МВ-КФК в этот период уже возвращаются к норме). При реперфузии пики концентраций как тропонинов, так и МВ-КФК регистрируют раньше (за счет вымывания ферментов из некротизированных тканей).
Последствия и осложнения ИМ. В настоящее время исходы острого ИМ более благоприятны; по сравнению с 1960-ми годами внутрибольничная смертность
снизилась примерно с 30 до 10–13% (и приблизительно

ГЛАВА 11. Сердце 479
A |
Б |
В |
Г |
Д |
Е |
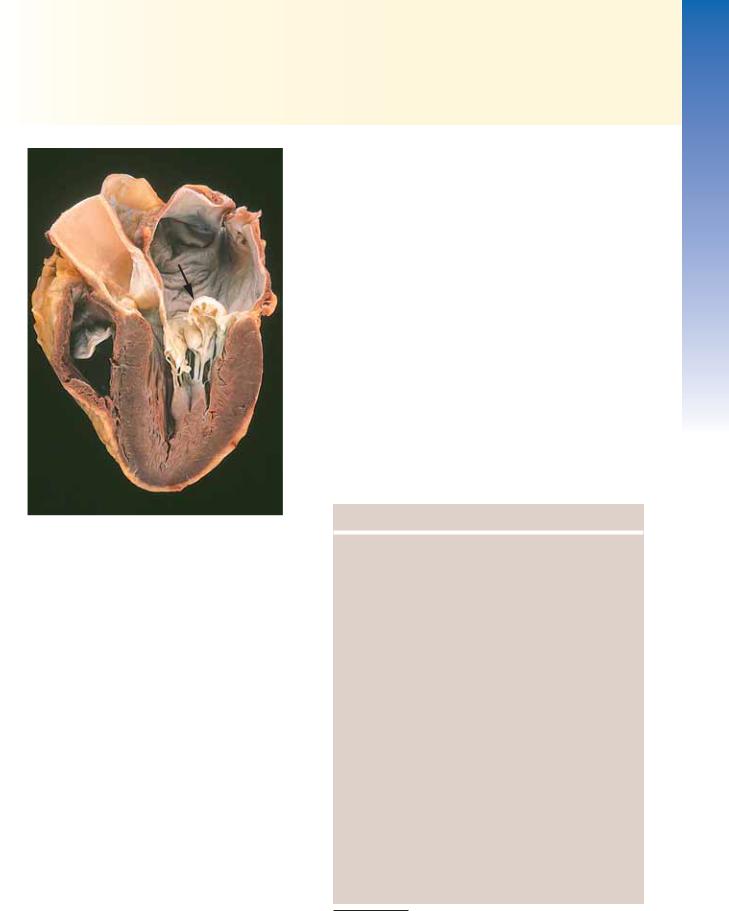
Рис. 11.12. Осложнения инфаркта миокарда. А — В — разрывы сердца. А — разрыв передней стенки миокарда при остром инфаркте (стрелка); Б — разрыв межжелудочковой перегородки (стрелка); В — полный отрыв некротизированной сосочковой мышцы; Г — фиброзный перикардит, представленный как темная, огрубевшая поверхность эпикарда над зоной инфаркта; Д — раннее распространение передневерхушечного инфаркта с истончением стенки (стрелка) и образованием пристеночного тромба; Е — большая аневризма верхушки левого желудочка (стрелка). [A–E, из Schoen FJ: Interventional and Surgical Cardiovascular Pathology: Clinical Correlations and Basic Principles. Philadelphia, WB Saunders, 1989. F, Dr. William D. Edwards, Mayo Clinic, Rochester, Minnesota.]
до 7% у пациентов, получающих агрессивную репер- |
составляет около 70%, с этим осложнением связаны |
фузионную терапию). К сожалению, половина смертей |
60–65% внутрибольничных смертей при ИМ. |
при ИМ происходит у пациентов, которых еще не при- |
• Аритмии. У многих пациентов после ИМ развивают- |
везли в больницу; обычно эти пациенты умирают |
ся аритмии, которые, без сомнения, обусловливают |
в течение часа после появления симптомов, как пра- |
большое количество внезапных смертей. Аритмии, |
вило, в результате аритмий. К неблагоприятным про- |
ассоциированные с ИМ, включают синусовую бра- |
гностическим факторам относят преклонный возраст, |
дикардию, блокады сердца, тахикардию, желудоч- |
женский пол, сахарный диабет и повторный ИМ. |
ковые экстрасистолии, желудочковую тахикардию |
У около 75% пациентов после острого ИМ развива- |
и фибрилляцию. |
ются осложнения (некоторые из них представлены |
• Разрыв миокарда. Разрывы осложняют от 1 до 5% |
на рис. 11.12). |
ИМ, но представляют распространенную причину |
• Сократительная дисфункция. ИМ нарушает насо- |
(7–25% случаев) гибели больных, связанной с ИМ. |
сную функцию левого желудочка в соответствии |
Осложнения включают разрыв свободной стенки |
со своим размером. Обычно отмечают некоторую |
желудочка с развитием гемоперикарда и тампонады |
степень левожелудочковой недостаточности с гипо- |
сердца, обычно смертельной (рис. 11.12 А); разрыв |
тонией, застоем в легочных сосудах, застоем и транс- |
межжелудочковой перегородки, приводящий к обра- |
судацией жидкости в легочный интерстиций и аль- |
зованию ДМЖП со сбросом крови слева направо |
веолярное пространство. У 10–15% пациентов после |
(рис. 11.12 Б); разрыв сосочковой мышцы, обуслов- |
острого ИМ развивается тяжелая «насосная недо- |
ливающий тяжелую митральную регургитацию |
статочность» (кардиогенный шок), обычно при боль- |
(рис. 11.12 В). Разрыв может произойти практически |
шом инфаркте (часто поражающем более 40% лево- |
на любой стадии ИМ, но наиболее часто возникает |
го желудочка). Смертность при кардиогенном шоке |
на 3–7-й день после ИМ; на этом этапе заживления |

480 ГЛАВА 11. Сердце
миокарда максимально выражен лизис соединительной ткани, а грануляционная ткань еще не образовала достаточного количества коллагенового матрикса для укрепления стенки. К факторам риска разрыва свободной стенки относят возраст более 60 лет, женский пол, фоновую артериальную гипертензию, отсутствие гипертрофии левого желудочка и первый ИМ (уже существующий рубец предотвращает разрыв миокарда).
•Перикардиты. Фибринозный или геморрагический перикардит обычно развивается через 2–3 дня после трансмурального ИМ и со временем самостоятельно проходит (рис. 11.12 Г); это эпикардиальное проявление лежащего в основе воспаления миокарда.
•Распространение инфаркта. За счет податливости некротизированной мышцы может произойти непропорциональное растяжение, истончение и дилатация участка инфаркта (особенно при переднеперегородочных инфарктах); этот процесс часто сопровождается пристеночным тромбозом (рис. 11.12 Д).
•Пристеночный тромбоз. При любом инфаркте сочетание локальной потери сократимости (вызывающей стаз) с поражением эндокарда (то есть формированием поверхности для образования тромба) может благоприятствовать развитию пристеночного тромбоза (см. главу 4) и, возможно, приводить к тромбоэмболии (рис. 11.12 Д).
•Аневризма желудочка. Представляя позднее осложнение, аневризма левого желудочка наиболее часто формируется после переднеперегородочного трансмурального инфаркта, который заживает с образованием тонкой рубцовой ткани (рис. 11.12 Е). Осложнения аневризмы желудочка включают пристеночный тромбоз, аритмии и сердечную недостаточность, однако разрыва фиброзной стенки не происходит.
•Дисфункция сосочковых мышц. Как указано выше, дисфункция сосочковых мышц редко происходит в результате их разрыва. Чаще митральная регургитация после инфаркта вызвана ишемической дисфункцией сосочковой мышцы и подлежащего миокарда, а в более поздние сроки — фиброзом и укорочением папиллярной мышцы или дилатацией желудочка.
•Прогрессирующая поздняя сердечная недостаточность
обсуждается как хроническая ИБС (см. далее).
Риск развития осложнений и прогноз после ИМ зависят от размера инфаркта, его локализации и толщины пораженной стенки миокарда (субэндокардиальный или трансмуральный инфаркт). При больших трансмуральных инфарктах выше вероятность развития кардиогенного шока, аритмии и поздней ЗСН. У пациентов с передними трансмуральными инфарктами выше риск разрыва свободной стенки, расширения зоны инфаркта, пристеночного тромбоза и аневризмы. С другой стороны, задние трансмуральные инфаркты чаще осложняются тяжелыми расстройствами проводимости, вовлечением в патологический процесс правого желудочка или сочетанием этих нарушений; острые разрывы межжелудочковой перегородки этой локализации хуже поддаются лечению. Таким образом,
у пациентов с передними инфарктами клиническое течение заболевания хуже, чем при задних инфарктах. При субэндокардиальных инфарктах могут возникнуть тромбы на поверхности миокарда, но разрывы, аневризмы и перикардиты диагностируют редко.
Долгосрочный прогноз после ИМ зависит от многих составляющих, к наиболее важным из них относят качество сократительной функции левого желудочка и наличие обструкций в сосудах, кровоснабжающих оставшийся жизнеспособный миокард. Общая смертность в течение первого года составляет около 30%, включая смертность на догоспитальном этапе. В дальнейшем смертность составляет 3–4% в год.
Хроническая ишемическая болезнь сердца
Хроническая ИБС, также называемая ишемической кардиомиопатией, — прогрессирующая сердечная недостаточность, возникающая в результате ишемического поражения миокарда. В большинстве случаев больные имеют ИМ в анамнезе. Хроническая ИБС обычно возникает в результате постинфарктной декомпенсации сердца, которая следует за истощением гипертрофии жизнеспособного миокарда. В других случаях возможна диффузная дисфункция миокарда без перенесенных ИМ (за счет тяжелой обструктивной коронарной болезни сердца).
Морфология
Размеры и масса сердца больных хронической ИБС обычно увеличены за счет дилатации и гипертрофии левого желудочка. Во всех случаях диагностируют умеренный или тяжелый атеросклероз коронарных артерий, иногда с полной окклюзией. Обычно обнаруживают дискретные серо-белые рубцы после заживших инфарктов. Часто эндокард испещрен
ифиброзно утолщен, могут присутствовать пристеночные тромбы. Основные микроскопические проявления включают гипертрофию миокарда, диффузную вакуолизацию миоцитов под эндокардом
ифиброз после перенесенных инфарктов.
Клинические проявления. Хроническая ИБС характеризуется развитием тяжелой, прогрессирующей сердечной недостаточности, иногда перемежающейся приступами стенокардии или ИМ. Часто развиваются аритмии, которые, кроме ЗСН и интеркуррентных ИМ, служат причиной многих смертей.
Внезапная сердечная смерть
Ежегодно в США внезапную сердечную смерть (ВСС) регистрируют у 300–400 тыс. пациентов, наиболее часто ее определяют как необъяснимую смерть от сердечных причин без симптомов и в течение 1–24 ч после появления симптомов (многие авторы используют различные временные границы). Коронарная болезнь сердца — наиболее распространенная причина, и у многих взрослых ВСС служит первым клиническим проявле-

нием ИБС. У более молодых жертв зачастую существуют и другие (неатеросклеротические) причины.
•Врожденные аномалии коронарных артерий.
•Стеноз аортального клапана.
•Пролапс митрального клапана.
•Миокардит или саркоидоз.
•Дилатационная или гипертрофическая кардиомиопатия.
•Легочная гипертензия.
•Врожденные или приобретенные нарушения проводящей системы сердца. Среди них наиболее важной причиной считают аутосомно-доминантный синдром удлиненного интервала QT, вызванный многими мутациями различных ионных каналов сердца.
•Изолированная гипертрофия миокарда гипертонической или неизвестной этиологии. Увеличение массы миокарда — независимый фактор риска ВСС; также у некоторых молодых пациентов, умирающих внезапно (включая спортсменов), часто выявляют не предполагаемые ранее гипертрофическую кардиомиопатию, миокардиты или врожденные аномалии
коронарных артерий.
Наиболее частый непосредственный механизм ВСС — смертельная аритмия, например, фибрилляция желудочков. Хотя ишемическое поражение, как и другие патологии, могут непосредственно влиять на проводящую систему сердца, большинство случаев смертельных аритмий запускаются электрической раздражимостью миокарда вне проводящей системы. Прогноз у пациентов, переживших ВСС, в особенности при хронической ИБС, значительно улучшился вследствие установки автоматических кардиовертеров — дефибрилляторов, которые фиксируют и прерывают эпизоды фибрилляции желудочков.
Морфология
У 80–90% жертв ВСС обнаруживают тяжелый атеросклероз коронарных артерий с критическим стенозом (75% просвета сосуда или более) одного или более из трех основных сосудов; нестабильные бляшки выявляют только у 10–20% из них. Заживший ИМ диагностируют примерно у 40%. Повторный ИМ развивается примерно у 25% пациентов (или менее), успешно реанимированных при внезапной остановке сердца. Часто отмечают вакуолизацию субэндокардиальных миоцитов, свидетельствующую о тяжелой хронической ишемии. Неатеросклеротическую причину определяют у меньшинства пациентов с ВСС (10–20%).
ЗАКЛЮЧЕНИЕ
Ишемическая болезнь сердца
• В подавляющем большинстве случаев ишемическая болезнь сердца (ИБС) возникает в результате атеросклероза коронарных артерий, к менее распространенным причинам относят
вазоспазм, васкулит или эмболизацию.
ГЛАВА 11. Сердце 481
•Ишемия сердца представляет несогласованность между коронарной доставкой крови и потребностями миокарда и представлена различными синдромами.
–Стенокардия — боль в груди, вызванная неадекватным кровоснабжением, обычно развивается вследствие атеросклеротического поражения с фиксированным стенозом более 75% просвета сосуда (так
называемый критический стеноз).
– Нестабильная стенокардия возникает в результате небольшого растрескивания или разрыва атеросклеротической бляшки; это запускает агрегацию тромбоцитов, спазм сосуда и процесс образования пристеночного тромба (может не окклюзировать просвет сосуда).
–Острый инфаркт миокарда обычно развивается в результате острого тромбоза, следующего за разрушением атеросклеротической бляшки.
–Внезапная сердечная смерть происходит
из-за фатальной аритмии (наиболее часто диагностируют у пациентов с тяжелой коронарной болезнью сердца).
–Хроническая ишемическая болезнь сердца —
прогрессирующая сердечная недостаточность, возникающая вследствие ишемического поражения, как после перенесенных инфарктов, так и значительной хронической ишемии.
•Ишемия миокарда быстро (в течение минут) приводит к потере функции и последующему развитию некроза через 20–40 мин. Диагноз ИМ устанавливают на основании симптомов, электрокардиографических изменений, а также уровней тропонинов и активности МВ-КФК, измеренных в сыворотке крови. Требуются часы и дни после инфаркта для формирования макроскопических и гистологических изменений ткани миокарда.
•К осложнениям инфаркта миокарда относят разрыв желудочка (свободной стенки, перегородки или сосочковой мышцы), формирование аневризмы, пристеночный тромбоз, аритмии, перикардиты и застойную сердечную недостаточность (ЗСН).
ГИПЕРТОНИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА1
Как указано в главе 10, хроническая артериальная гипертензия — распространенное расстройство, ассо-
1В англоязычной литературе изменения, происходящие
всердце при артериальной гипертензии, часто называют
гипертонической болезнью сердца. В русскоязычной литературе гипертоническая болезнь — это эссенциальная гипертензия. — Прим. пер.
482 ГЛАВА 11. Сердце
циированное со значительной заболеваемостью, поражающее множество органов, включая головной мозг, сердце и почки. Прежде всего следует рассмотреть патофизиологию гипертрофии миокарда, даже если в развитии этого нарушения участвуют многие различные факторы в дополнение к гипертонии. Затем будут описаны осложнения со стороны сердца, возникающие как при системной, так и при изолированной легочной гипертензии (легочное сердце).
Патофизиология гипертрофии сердца
Кардиомиоциты — окончательно дифференцированные клетки, не способные к делению; впоследствии, в ответ на продолжительный стресс, их число не может увеличиваться (гиперплазия). Увеличение работы при перегрузке давлением или объемом или за счет трофических сигналов (например, гипертиреоз) вызывает увеличение массы миоцитов и вследствие этого размеров сердца (гипертрофия).
Степень гипертрофии зависит от лежащей в ее основе причины. Так, обычно вес сердца варьирует от 350 до 600 г (приблизительно в 2 раза больше нормального) при легочной гипертензии и ИБС, от 400 до 800 г (в 2–3 раза больше нормы) — при системной гипертензии, аортальном стенозе, митральной регургитации или дилатационной кардиомиопатии, от 600 до 1000 г при аортальной регургитации или гипертрофической кардиомиопатии.
Вид гипертрофии отражает природу инициирующих стимулов (рис. 11.13). При перегрузке желудочка давлением (то есть при артериальной гипертензии или аортальном стенозе) развивается концентрическая гипертрофия, при которой увеличивается толщина стенок; увеличенная толщина миокарда левого желудочка может даже уменьшить размер полости. С другой стороны, при перегрузке объемом (то есть при недостаточ-
ности аортального клапана) возникает гипертрофия, сочетанная с дилатацией желудочка. При перегрузке объемом мышечная масса увеличивается пропорционально размеру камеры; такие выраженно дилатированные сердца могут иметь значительную гипертрофию без увеличения толщины стенок. Таким образом, гипертрофию при перегрузке объемом невозможно определить только по толщине стенок.
Первоначально служащая компенсаторной, длительная или чрезмерная гипертрофия может привести к сократительной недостаточности миоцитов. В то же время структурные, биохимические и молекулярные основы этойнедостаточностиостаютсянепонятными.Известно, что гипертрофию сердца сопровождают некоторые изменения экспрессии генов, обычно с изменением паттерна синтеза белков, повторяющим фетальное развитие сердца. Эти фетальные изоформы белков характеризуются меньшей функциональностью, чем взрослые, или экспрессируются недостаточно. С другой стороны, различное внутриклеточное содержание ионов кальция может непосредственно приводить к нарушению сокращения и расслабления. Обычно гипертрофия миоцитов не сопровождается соответствующим увеличением сосудистого ложа. Таким образом, существует относительное снижение плотности капилляров. В результате хронической ишемии происходит отложение фиброзной ткани, которая ограничивает диастоличекое расслабление. В то же время у утолщенной мышцы увеличены метаболические потребности, повышающие потребление кислорода. Эта последовательность со временем приводит к декомпенсации сердца.
Сердце при системной (артериальной) гипертензии
Гипертоническую болезнь сердца диагностируют при гипертрофии левого желудочка (обычно концентри-
A |
Б |
Рис. 11.13. Гипертрофия левого желудочка. А — гипертрофия от давления при обструкции выносящего тракта левого желудочка. Левый желудочек на четырехкамерном срезе — внизу и справа. Б — изменение конфигурации сердца на поперечных срезах при гипертрофии левого желудочка с дилатацией и без нее. По сравнению с нормальным сердцем (в центре) при гипертрофии от давления (слева и А) увеличивается масса и толщина стенок левого желудочка, но при гипертрофии и дилатации сердца (справа) прирост массы происходит при нормальной толщине стенок. [Из Edwards WD: Cardiac anatomy and examination of cardiac specimens. In Emmanouilides GC, Riemenschneider TA, Allen HD, Gutgesell HP (eds): Moss and Adams Heart Diseaese in Infants, Children, and Adolescents: Including the Fetus and Young Adults, 5th ed. Philadelphia, Williams & Wilkins, 1995, p. 86]

ческой) при отсутствии другой возможной сердечнососудистой патологии (например, стеноза клапана) и указаний на гипертонию в анамнезе или патологических признаков гипертонии. По данным фремингемского исследования сердца, даже легкая гипертония (давление немного выше нормального — 140/90 мм рт. ст.) при достаточно длительном течении может привести к гипертрофии левого желудочка. Около 25% популяции США страдают от гипертонии, хотя бы легкой.
Морфология
Необходимый признак гипертонической болезни сердца — гипертрофия левого желудочка, обычно без дилатации полости (рис. 11.14). Толщина стенок левого желудочка может превышать 2 см, а вес сердца — 500 г. Со временем увеличенная толщина стенки левого желудочка нарушает диастолическое наполнение; это часто приводит к увеличению левого предсердия.
Микроскопически наблюдают увеличение диаметра миоцитов, обычно сочетанное с выраженным, иногда нерегулярным увеличением ядер и гиперхромией («box-car nuclei»), и интерстициальный фиброз.
Рис. 11.14. Гипертоническая болезнь сердца со значительным концентрическим утолщением стенок левого желудочка, приводящим к уменьшению просвета камеры. Левый желудочек — справа на апикальном четырехкамерном срезе сердца. Иногда в правом желудочке можно обнаружить электрод искусственного водителя ритма (стрелка). Обратите внимание также на дилатацию левого предсердия (звездочка), вызванную относительным повышением жесткости левого желудочка, которая приводит к нарушению диастолического расслабления и последующей перегрузке предсердия объемом
ГЛАВА 11. Сердце 483
Клинические проявления. Компенсированная гипертоническая болезнь сердца иногда не вызывает симптомов; ее можно заподозрить на основании признаков гипертрофии левого желудочка на электрокардиограмме или при эхокардиографии. У части пациентов заболевание проявляется только после развития фибрилляции предсердий (в результате увеличения левого предсердия) и/или ЗСН. В зависимости от длительности, тяжести и лежащей в основе заболевания причины, а также от адекватности терапевтического контроля пациенты могут жить обычной жизнью и погибнуть при различных обстоятельствах (не связанных с гипертонией), страдать от прогрессирующего поражения почек или цереброваскулярного инсульта, переживать прогрессирующую сердечную недостаточность, а также может развиться прогрессирующая ИБС за счет потенцирования атеросклероза коронарных артерий. Как указано выше, увеличение массы сердца — независимый фактор риска внезапной сердечной смерти. Эффективный контроль артериальной гипертензии может предотвратить развитие или привести к регрессии гипертрофии сердца и связанных с ней рисков.
Сердце при легочной гипертензии (легочное сердце)
Легочное сердце представляет собой гипертрофию и дилатацию правого желудочка, вызванные легочной гипертензией, которая связана с первичным заболеванием паренхимы легких или легочных сосудов (табл. 11.3). Как правило, дилатацию и гипертрофию правого желудочка при врожденных пороках сердца или левожелудочковой недостаточности исключают из этого определения.
В зависимости от скорости развития легочной гипертензии выделяют острое или хроническое легочное сердце. Острое легочное сердце наиболее часто сопровождает массивную эмболию легочной артерии с обструкцией более 50% легочного сосудистого русла. Хроническое легочное сердце возникает вторично к обструкции легочных сосудов или компрессии, или облитерации септальных капилляров (в результате эмфиземы, интерстициального фиброза легкого или при первичной легочной гипертензии).
Морфология
При остром легочном сердце обычно обнаруживают дилатацию правого желудочка, но без признаков гипертрофии; если эмболия вызвала внезапную смерть, сердце может иметь даже нормальные размеры. Хроническое легочное сердце характеризуется гипертрофией правого желудочка (и часто правого предсердия). В крайних случаях толщина стенок правого желудочка сопоставима или даже превосходит толщину стенок левого желудочка. При развитии недостаточности желудочка иногда наблюдают дилатацию правого желудочка и предсердия. За подобной дилатацией может скрываться и гипертрофия правого желудочка. Так как хроническое легочное сердце развивается при хроническом повы-

484 ГЛАВА 11. Сердце
шении давления в легочной артерии, легочные артерии часто содержат атероматозные бляшки и другие повреждения, отражающие длительно существующую легочную гипертензию (см. главу 13).
Таблица 11.3. Заболевания, предрасполагающие к развитию легочного сердца
Болезни легочной паренхимы
Хроническая обструктивная болезнь легких Диффузный интерстициальный легочный фиброз Пневмокониозы Кистозный фиброз (муковисцидоз) Бронхоэктазия
Болезни легочных сосудов
Рецидивирующая тромбоэмболия Первичная легочная гипертензия
Выраженный артериит легочных артерий (например, гранулематоз Вегенера)
Обструкция сосудов, вызванная лекарствами, токсинами или радиацией
Микроэмболия из опухолей легких
Заболевания, нарушающие движения грудной клетки
Кифосколиоз Значительное ожирение (пиквикский синдром)
Нервно-мышечные заболевания
Заболевания, вызывающие спазм легочной артерии
Метаболический ацидоз Гипоксия
Хроническая высотная болезнь Обструкция основных воздушных путей
Идиопатическая альвеолярная гиповентиляция
Рис. 11.15. Хроническое легочное сердце. Характерны значительная дилатация и гипертрофия правого желудочка, утолщение его свободной стенки и гипертрофия трабекул (апикальный четырехкамерный срез, правый желудочек расположен слева). Конфигурация левого желудочка (справа) изменена увеличенным правым желудочком. (Сравните с рис. 11.14)
ЗАКЛЮЧЕНИЕ |
Гипертоническая болезнь сердца |
• Гипертоническая болезнь сердца может вовле- |
кать как правый (легочное сердце), так и левый |
желудочек. В результате увеличения давления |
развивается гипертрофия миоцитов. |
• При хронической перегрузке давлением (как при |
артериальной гипертензии или аортальном |
стенозе) развивается концентрическая гипер- |
трофия пораженного желудочка. При перегруз- |
ке объемом (например, при недостаточности |
клапанов) гипертрофия желудочка сопрово- |
ждается дилатацией полости. |
• Механизмы, приводящие к сердечной недо- |
статочности, вызванной гипертензией, недо- |
статочно изучены; возможно, они включают |
синтез белков миоцитов с меньшей функцио- |
нальностью или недостаточной экспрессией, |
а также снижение кровоснабжения, необходи- |
мого увеличенной массе миоцитов. |
• Формирование легочного сердца, возникающего |
при легочной гипертензии, обусловлено пер- |
вичными нарушениями паренхимы (например, |
эмфиземой) или сосудов легких. |
ПРИОБРЕТЕННЫЕ ПОРОКИ СЕРДЦА (БОЛЕЗНИ КЛАПАНОВ СЕРДЦА)
При поражении клапанов сердца возникает стеноз, недостаточность или сочетание этих нарушений.
•Стеноз — неспособность клапана полностью открываться, создающая препятствие для продвижения потока крови вперед. Как правило, стеноз — хронический процесс, вызванный первичным поражением створок клапана (например, кальцификацией или рубцеванием).
•Недостаточность развивается при неспособности клапана полностью закрываться, таким образом, возникает обратный ток крови. Недостаточность клапана может развиться как в результате первичной патологии створок клапана, так и вследствие растяжения поддерживающих структур (например, аорты, митрального кольца, сосочковых мышц, свободной стенки желудочка) без первичных изменений створок. Недостаточность клапана может возникать остро
(как при разрыве хорды) или развиваться как хронический процесс (из-за рубцевания и сжатия створок).
Диагностируют изолированный стеноз или регургитацию, а также сочетание этих нарушений. Клапанный порок может вовлекать один клапан (наиболее часто регистрируют поражение митрального клапана) или более. Исход клапанного порока зависит от вовлеченного в патологический процесс клапана, степени нарушения, скорости его развития и состоятельности компенсаторных механизмов. Например, внезапное разрушение структур аортального клапана в результате

|
|
ГЛАВА 11. Сердце 485 |
|
|
|
Таблица 11.4. |
Этиология приобретенных пороков сердечных клапанов |
|
|
|
|
Пороки митрального клапана |
Пороки аортального клапана |
|
Митральный стеноз |
Аортальный стеноз |
|
Рубцевание в исходе воспаления (ревматическая |
Рубцевание в исходе воспаления (ревматическая |
|
болезнь сердца) |
болезнь сердца) |
|
|
|
Старческий стеноз-кальциноз аортального клапана |
|
|
Кальцификация врожденно деформированного |
|
|
клапана |
Митральная регургитация
Нарушения створок и комиссур: рубцевание в исходе воспаления (ревматическая болезнь сердца); инфекционный эндокардит; пролапс митрального клапана; «fen-phen» (фен-фен) индуцированный фиброз клапана Нарушения сухожильного аппарата: разрыв
сосочковой мышцы; дисфункция сосочковой мышцы (фиброз); разрыв сухожильной хорды Нарушения полости левого желудочка и /или митрального кольца: увеличение левого
желудочка (миокардиты, дилатационная кардиомиопатия); кальцификация митрального кольца
Аортальная регургитация
Первичное нарушение клапана: рубцевание в исходе воспаления (ревматическая болезнь сердца); инфекционный эндокардит Болезни аорты: дегенеративная дилатация аорты;
сифилитический аортит; анкилозирующий спондилит; ревматоидный артрит; синдром Марфана
инфекционного процесса может привести к быстрому возникновению сердечной недостаточности. С другой стороны, ревматический митральный стеноз обычно формируется годами и его клинические последствия пациенты переносят значительно лучше. Нарушения потока крови через клапаны обычно вызывают изменения аускультативной картины сердца и приводят к появлению шумов.
Патология клапанов возникает как результат врожденных нарушений, а также вследствие различных приобретенных заболеваний. Наиболее важные причины приобретенных поражений клапанов приведены в табл. 11.4; две трети всех клапанных пороков составляют приобретенные стенозы аортального и митрального клапанов.
Дегенеративный аортальный стеноз (с кальцификацией)
Дегенеративные изменения клапанов сердца — неизбежная составляющая процесса старения — возникают в результате постоянного механического стресса, которому они подвержены (сердце сокращается более 40 млн раз в год, и во время каждого цикла происходят незначительные деформации аортального клапана). Можно предположить, что фиброз створок и кальцификация — клапанная составляющая возрастного артериосклероза.
Стеноз-кальциноз аортального клапана — наиболее распространенный дегенеративный порок клапанов сердца. Это наиболее частая причина аортального стеноза в США, возникающая обычно как следствие кальциноза изнашиваемого со временем анатомически неизмененного аортального клапана или врожденного двухстворчатого клапана (рис. 11.16). Врожденный
двухстворчатый клапан (у которого сформированы только две функциональные створки) обнаруживают приблизительно у 1,4% всех живорожденных. Обычно при этом нарушении наблюдают две неравные створки, а на большей створке обычно определяют серединную борозду — шов, образованный в результате неполного разделения створок во время эмбрионального развития. На ранних этапах жизни двухстворчатый аортальный клапан обычно не вызывает ни стеноза, ни клинических симптомов. В то же время такой клапан более подвержен прогрессирующей дегенеративной кальцификации (рис. 11.16 Б). Кальциноз митрального клапана в основном поражает только кольцо клапана и, как правило, не вызывает симптомов, кроме тех случаев, когда кальцификация достигает проводящей системы (рис. 11.16 В и рис. 11.16 Г).
Заболеваемость стенозом-кальционозом аортального клапана повышается с увеличением среднего возраста населения США. При анатомически неизмененных клапанах данное нарушение обычно начинает проявляться при достижении 70–80 лет; при двухстворчатом аортальном клапане клинические симптомы обнаруживают намного раньше (в 40–50 лет).
Морфология
Отличительный признак кальцифицирующего аортального стеноза (как трехстворчатого, так и двухстворчатого клапана) — накопление кальцифицированных масс на внешней стороне створок; они могут достигать синуса Вальсальвы и механически нарушать раскрытие клапана (см. рис. 11.16 А); обычно при дегенеративном стенозе и слиянии комиссур створки вторично фиброзируются и утолщаются.

486 ГЛАВА 11. Сердце
A |
Б |
В |
Г |
Рис. 11.16. Кальцинозная дегенерация клапана. А — стенозкальциноз аортального клапана с тремя створками (вид со стороны аорты). Нодулярные массы кальция прикреплены со стороны синуса Вальсальвы (стрелка). Обратите внимание на отсутствие слияния комиссур, характерного для ревматического аортального стеноза (см. рис. 11.18 E). Б — стеноз-кальци- ноз двухстворчатого аортального клапана. На одной из створок визуализируется частичное слияние в центре — шов (стрелка). В — Г — кальциноз митрального клапана с узелками кальция у основания (краевое наложение) передней створки (стрелка). В— вид со стороны левого предсердия; Г — разрез миокарда. (Стрелки указывают на кальциноз створок и кольца клапана.)
Ранняя стадия процесса, не приводящая к нарушениям гемодинамики, носит название склероза аортального клапана. При стенозе-кальцинозе аортального клапана значительная обструкция выносящего тракта приводит к перегрузке левого желудочка давлением с развитием концентрической гипертрофии миокарда.
Клинические проявления. При тяжелом кальцифицирующем стенозе аорты иногда отмечают поражение до 70–80% кольца клапана. Возникающая в результате обструкция выносящего тракта приводит к увеличению давления в левом желудочке до 200 мм рт. ст. и более; сердечный выброс поддерживается только за счет мощности концентрической гипертрофии левого желудочка. Гипертрофированный миокард оказывается относительно ишемизированым (см. выше обсуждение гипертонической болезни сердца) и может развиться стенокардия. Низкая перфузия головного мозга может вызвать синкопальные состояния. Сочетание систолической и диастолической дисфункции приводит к ЗСН, и в конечном счете происходит декомпенсация сердца. Появление клинических симптомов (стенокардии, синкопальных состояний, ЗСН) — отличительный признак аортального стеноза, свидетельствующий
об истощении компенсаторной гиперфункции сердца и, следовательно, о плохом при отсутствии хирургического лечения прогнозе (при возникновении ЗСН 2-летняя смертность достигает 50%).
Миксоматозное перерождение митрального клапана
При миксоматозной дегенерации митрального клапана
одна или обе створки «болтаются» и пролабируют, при этом они «попадают» в левое предсердие во время диастолы. Основная форма миксоматозной дегенерации митрального клапана — пролапс митрального клапана, диагностируемый у 3–5% взрослого населения США (у женщин регистрируют в 7 раз чаще, чем у мужчин); таким образом, пролапс представляет одну из наиболее распространенных форм клапанной патологии в индустриальных странах. Вторичная миксоматозная дегенерация может возникать в любой ситуации, при которой существует митральная регургитация (например, при ИБС).
Морфология
Миксоматозная дегенерация митрального клапана характеризуется раздуванием митральных створок (рис. 11.17). Пораженные створки увеличиваются, чрезмерно утолщаются и напоминают по консистенции резину; сухожильные хорды удлиняются, истончаются и иногда разрываются. Зачастую при пролапсе митрального клапана одновременно изменяется и трикуспидальный клапан (в 20–40% случаев), также регистрируют нарушения аортального клапана и клапана легочной артерии. Основные гистологические изменения при указанной патологии — истончение фиброзного слоя клапана, от которого зависит структурная целостность створки, сопровождаемое увеличением срединного спонгиозного слоя с увеличением отложения миксоматозного материала. Подобные изменения происходят как при первичном дефекте, так и при регургитация другой этиологии (например, при ИБС).
Патогенез. Основа миксоматозной дегенерации митрального клапана неизвестна. В то же время почти всегда отмечают первичный дефект соединительной ткани (возможно системный) — нарушение как синтеза, так и ремоделирования. Например, миксоматозную дегенерацию митрального клапана часто обнаруживают при синдроме Марфана, вызванном мутацией фибриллина-1 (см. главу 7), реже при других нарушениях соединительной ткани. У некоторых пациентов выявляют дополнительные признаки системного нарушения структуры соединительной ткани, такие как сколиоз и высокое нёбо. Внутренние дефекты структурных белков или клеток, из которых состоят соединительные ткани, могут предрасполагать к их гемодинамическому напряжению (например, клапаны сердца), к нарушению синтеза или ката-
ГЛАВА 11. Сердце 487
Рис. 11.17. Миксоматозная дегенерация митрального клапана. По длинной оси левого желудочка показано прогибание с пролабированием задней створки митрального клапана в левое предсердие (стрелка). На этом апикальном четырехкамерном срезе левый желудочек расположен справа. [Dr. William D. Edwards, Mayo Clinic, Rochester, Minnesota.]
болизма экстрацеллюлярного матрикса. Вторичные миксоматозные нарушения возникают из-за «дегенеративных» изменений миофибробластов клапана, отвечающих на хронически измененные гемодинамические силы.
Клинические проявления. У большинства пациентов с пролапсом митрального клапана не обнаруживают симптомов, и обычно клапанные нарушения случайно диагностируют при обследовании. Меньшее число пациентов отмечают сердцебиения, одышку или атипичную боль в груди. При аускультации отмечают среднесистолический щелчок (клик), вызванный резким натяжением чрезмерной створки клапана и сухожильной хорды при попытке клапана закрыться (иногда сопровождается шумом митральной недостаточности). Хотя у основного числа пациентов течение пролапса митрального клапана относительно доброкачественное, у 3% развиваются осложнения, в том числе гемодинамически значимая митральная регургитация и ЗСН (особенно при разрыве хорды или створки клапана). У больных с митральным пролапсом и недостаточностью клапана также увеличен риск развития инфекционного эндокардита (см. ниже) и внезапной смерти, вызванной желудочковыми аритмиями. Эмболия тромбом, образованным в левом предсердии, может привести к инсульту или другим системным эмболиям.
Ревматический эндокардит (поражение сердца при ревматизме)1
Ревматическая лихорадка2 (РЛ) — острое, иммунологически опосредованное мультисистемное воспалительное заболевание, которое развивается через несколько недель после вызванного β-гемолитическим стрептококком группы А фарингита; реже причиной болезни служат стрептококковые инфекции другой локализации (например, кожи). Острая ревматическая болезнь сердца (РБС) — сердечное проявление РЛ, связанное с воспалением клапанов, миокарда или перикарда.
Хроническая деформация клапанов — наиболее важное последствие РБС — характеризуется диффузным и плотным рубцеванием клапанов, приводящим к постоянной дисфункции (наиболее часто к митральному стенозу). Заболеваемость РЛ и, таким образом, РБС снизилась во многих индустриальных странах за последние 30 лет; это связано с улучшением социально-экономических условий, быстрой диагностикой и лечением стрептококкового фарингита, а также со случайным (и необъяснимым) снижением вирулентности стрептококков группы А. Тем не менее в экономически неразвитых городских районах или развивающихся странах РЛ и РБС остаются важной проблемой общественного здоровья.
Морфология
Проявления острой РЛ и РБС в сердце представлены на рис. 11.18. Во время острой РЛ дискретные воспалительные изменения обнаруживают в различных тканях организма. Эти изменения в сердце носят названия гранулем или телец Ашоффа3, их считают патогномоничными для РЛ (рис. 11.18 А). Тельца Ашоффа состоят из центральной зоны распадающегося, гиперэозинофильного фибриноидного некроза, инфильтрированного лимфоцитами (преимущественно Т-клетками), плазмоцитами и активированными макрофагами, называемыми клетками Аничкова. В клетках Аничкова чрезмерно выражена цитоплазма и центральное ядро со скудным хроматином и волнистой полоской (так называемые гусеничные клетки); эти активированные клетки также могут сливаться, образуя гигантские клетки. Тельца Ашоффа можно обнаружить в любом из трех слоев сердца — перикарде, миокарде и эндокарде (включая клапаны, — так называемый панкардит). В перикарде отмечают фибринозный или серозно-фибринозный экссудат (обычно разрешается без последствий). Поражение миокарда (миокардит) представляет тельца Ашоффа, разбросанные в интерстициальной соединительной ткани. Поражение клапанов приводит к фибриноидному некрозу по линии закрытия
1 В русскоязычной литературе ревматизм описывается в виде 4 форм: кардиоваскулярной, суставонй, нодозной и с поражением ЦНС. В данном издании разбирается фактически только кардиоваскулярная форма. — Прим. пер.
2 В отечественной литературе используют термин «ревматизм». — Прим. пер.
3 В русскоязычной литературе — гранулемы Амоффа— Талалаева. — Прим. пер.
