
Часть 2
.PDF
588 ГЛАВА 13. Легкие
тоже способствуют ремоделированию воздушных путей путем секреции факторов роста, вызывающих пролиферацию гладкомышечных клеток.
Атопическая астма. Этот самый распространенный вариант астмы обычно начинается в детстве. Характерна позитивная семейная история атопии. В таком случае астматическим приступам часто предшествуют аллергический ринит, крапивница или экзема. Болезнь запускается антигенами внешней среды, такими как пыль, пыльца, шерсть животных и продукты питания, но потенциально подразумевается любой возможный антиген. Кожный тест с антигеном приводит к немедленной реакции «волдыря-и-вспышки» — классическому примеру IgEстимулированной реакции гиперчувствительности I типа (см. главу 5). В воздушных путях уже есть начальная гиперчувствительность к раздражающим антигенам, которая стимулирует активацию TH2-клеток
ивыброс интерлeйкинов ИЛ-4 и ИЛ-5 (рис. 13.11 А). Это приводит к синтезу IgE, который «садится» на тучные клетки. Последующая IgE-опосредованная реакция на попавшие в дыхательные пути аллергены вызывает мгновенный ответ и наступление последней фазы реакции (рис. 13.11 Б). Контакт IgE-покрытых тучных клеток с тем же самым антигеном вызывает перекрестное связывание с IgE и выброс химических медиаторов. Тучные клетки на поверхности респираторной слизистой оболочки уже активированы. Последующий выброс медиаторов открывает межклеточные соединения слизистой оболочки, позволяя антигену проникнуть к большему количеству тучных клеток слизистой. Кроме того, прямое воздействие на субэпителиальные (парасимпатические) нервные окончания блуждающего нерва вызывает рефлекторную бронхоконстрикцию как через центральные, так
ичерез локальные рефлекторные дуги. Этот процесс происходит в течение нескольких минут после возбуждения и поэтому называется острым или немедленным ответом, который состоит из бронхоконстрикции, отека (из-за повышенной сосудистой проницаемости)
исекреции слизи. Множество медиаторов воспаления вовлечено в реакции острой фазы, хотя их фактическая значимость в развитии астматического приступа различна. Тем не менее неполный список включает
следующие медиаторы.
• Лейкотриены C4, D4 и E4. Чрезвычайно мощные медиаторы, вызывающие пролонгированную бронхоконстрикцию, увеличивают сосудистую прони-
цаемость и секрецию слизи.
• Ацетилхолин. Выделяется внутрилегочными мотонейронами, приводит к сокращению гладкомышечных клеток дыхательных путей путем прямого воз-
буждения мускариновых рецепторов.
• Гистамин. Вызывает бронхоспазм и увеличивает сосудистую проницаемость, однако не относится
к наиболее значимым медиаторам, поскольку антигистаминные препараты не всегда помогают пациентам.
•Простагландин D2. Вызывает бронхоконстрикцию и вазодилатацию.
•Фактор, активирующий тромбоциты. Индуцирует агрегацию тромбоцитов и высвобождение гистамина
из их гранул.
Тучные клетки дополнительно выделяют цитокины, вызывающие хемотаксис других лейкоцитов, таких как нейтрофилы, мононуклеарные клетки и особенно эозинофилы. Эти воспалительные клетки опосредуют реакции поздней фазы, которые начинаются спустя 4–8 ч и могут продолжаться в течение 12–24 ч или более (рис. 13.11 В). Эозинофилы особенно важны
впоздней фазе. Как упомянуто выше, их накопление
вучастках аллергического воспаления стимулируется несколькими хемотаксическими факторами тучноклеточного происхождения, а также хемокинами (например, эотоксином), непосредственно секретируемыми бронхиальным эпителием. Эозинофилы инфильтрата оказывают множество эффектов. Они содержат воспалительные медиаторы (примерно столько же, как и в тучных клетках), включая главный основной белок и катионный белок эозинофилов, оказывающие токсические эффекты на эпителий воздухопроводящих путей. Пероксидаза эозинофильных лейкоцитов
вызывает повреждение ткани путем оксидантного стресса. Активированные эозинофилы служат также источником лейкотриенов (особенно лейкотриена
C4), которые индуцируют бронхоконстрикцию. Таким образом, эозинофильные лейкоциты могут усиливать и поддерживать воспалительный ответ без дополнительной антигенной стимуляции. Оценка важности клеток воспаления и выделяемых ими медиаторов
впатогенезе бронхиальной астмы привела к обоснованию усиления акцента на противовоспалительную терапию астмы в клинической практике.
Неатопическая астма. Механизмы бронхиального воспаления и гиперчувствительности менее изучены у людей, страдающих неатопической астмой. Причиной астмы в таких случаях служат вирусные инфекции дыхательных путей (самые распространенные и обычные) и вдыхаемые поллютанты, такие как двуокись серы, озон и диоксид азота. Эти агенты увеличивают гиперреактивность воздухоносных путей как у здоровых людей, так и страдающих астмой лиц. В последнем случае возникает бронхоспазм — намного более серьезное состояние (продолжается длительное время). Семейный анамнез в таких случаях не является обязательным, уровни IgE в сыворотке нормальные, сопутствующие аллергические реакции отсутствуют.
Считают, что вызванное вирусом воспаление слизистой оболочки дыхательных путей понижает порог чувствительности подэпителиальных рецепторов блуждающего нерва к раздражителям. Хотя патогенез до конца не изучен, однако установлено наличие в воздухоносных путях гуморальных и клеточных элементов, вызывающих обструкцию дыхательных путей (например, эозинофилы), как и в случаях атопической астмы, что позволяет осуществлять их лечение аналогичным способом.
Астма, вызванная приемом лекарственных средств.
Некоторые препараты способны вызвать бронхиальную астму, например, аспирин♠. Люди с повышенной
ГЛАВА 13. Легкие 589
А.ПОВЫШЕННАЯ
ЧУВСТВИТЕЛЬНОСТЬ К АЛЛЕРГЕНУ
НОРМАЛЬНЫЕ
ВОЗДУХОПРОВОДЯЩИЕ
ПУТИ
Б. БРОНХИАЛЬНАЯ АСТМА
СПАЗМ
ВОЗДУХОПРОВОДЯЩИХ ПУТЕЙ ПРИ АСТМЕ
TH2 |
Рецепторы |
Пыльца |
Т<клеток |
||
клетки |
|
|
IgE,
продуцируемый Интерлейкин<4
В$клетками
Интерлейкин<5
IgE<антитела 





 Антиген
Антиген 
 (аллерген)
(аллерген)
Дендритная
клетка
Fc<рецепторы, связывающиеIgE |
Интерлейкин<5 |
Эотаксин |
|
|
|
|
|||
|
|
|
||
|
|
|
|
Барьер |
|
|
Рекрутмент эозинофилов |
из слизи |
|
Тучная клетка |
|
Активация |
|
|
|
|
|
|
|
|
|
|
Дегрануляция |
|
|
|
и высвобождение медиаторов |
|
|
|
|
Тучная |
|
|
Антиген |
|
клетка |
|
|
|
Медиаторы |
|
||
|
|
|
||
IgE |
|
|
Слизь |
|
|
|
|
|
|
Барьер из слизи |
|
|
Слизь |
|
|
|
|
|
|
|
|
Главный основной |
|
|
|
протеин |
|
|
|
Катионный |
|
Афферентная веточка |
|
белок |
TH2 |
блуждающего нерва |
|
эозинофилов |
|
|
|
|
TH2 |
Эозинофилы |
Повышение |
Базофилы Эозинофилы |
|
Эфферентная веточка |
сосудистой |
TH2 |
|
блуждающего нерва |
проницаемости |
|
|
|
|
|
|
|
Гладкомышечные |
Нейтрофилы |
|
|
клетки |
||
|
|
||
НЕМЕДЛЕННАЯ ФАЗА (МИНУТЫ) |
В. ПОЗДНЯЯ ФАЗА (ЧАСЫ) |
||
Рис. 13.11. Схема патогенеза аллергической астмы. A — повышение чувствительности к аллергену. Вдыхаемые аллергены (антигены) вызывают TH2-доминантный ответ, потенцирующий синтез IgE и рекрутмент эозинофильных лейкоцитов (примирование, или повышение чувствительности). Б — индуцированная аллергеном астма. При повторной экспозиции антигена возникает реакция гиперчувствительности немедленного типа в ответ на соединение антигена с IgE, связанным с рецепторами IgE на тучных клетках, расположенных в ткани дыхательных путей. Эти клетки выделяют медиаторы, открывающие плотные контакты между эпителиальными клетками. После этого антиген может проникнуть в подлежащие ткани слизистой оболочки и активировать локализованные в них тучные клетки и эозинофилы, которые, в свою очередь, высвобождают дополнительные медиаторы. Все вместе, непосредственно или через нервные окончания, медиаторы вызывают бронхоспазм, увеличивают сосудистую проницаемость, секрецию слизи, а также рекрутмент из кровотока дополнительных клеток, способных вырабатывать медиаторы. В — поздняя фаза (часы). Приход в очаг воспаления рекрутируемых лейкоцитов (нейтрофилов, эозинофилов, базофилов и TH2-клеток) сигнализирует инициацию поздней фазы астмы и выброс новых медиаторов лейкоцитами, эндотелием и эпителиальными клетками. Факторы, особенно эозинофильного происхождения (например, главный основной белок, катионный белок эозинофилов), также вызывают повреждение эпителиальных клеток

590 ГЛАВА 13. Легкие
чувствительностью к аспирину♠ страдают рецидивирующим ринитом, у них возникают носовые полипы, крапивница и бронхоспазм. Точный механизм неизвестен, но как предполагают, аспирин♠ блокирует циклооксигеназный путь метаболизма арахидоновой кислоты (не затрагивая при этом липоксигеназный путь), перемещая таким образом баланс к продукции вызывающих бронхоспазм лейкотриенов.
Профессиональная астма. Эта форма астмы развивается в результате действия паров и дымов (эпоксидной смолы, пластмассы), вдыхании органической и неорганической химической пыли (древесной, хлопковой, платины), газов (толуола) и других химикатов. Приступы астмы обычно возникают после повторного воздействия инициирующих антигенов.
Морфология
Морфологические изменения при астме были описаны у людей, умерших в результате длительных серьезных приступов удушья (астматический статус), а также на основании изучения биопсий слизистой оболочки бронхов людей, страдающих аллергией. В фатальных случаях макроскопическая картина выглядит следующим образом: легкие имеют повышенную воздушность из-за увеличения накопления в них воздуха (в связи с затрудненным выдохом в сочетании с маленькими участками ателектаза). Самое поразительное макроскопическое изменение — обструкция бронхов и бронхиол толстыми, вязкими пробками слизи. Гистологически пробки слизи содержат спирали из слущенного эпителия (спирали Куршманна). Обнаруживают также многочисленные эозинофилы и кристаллы Шарко—Лейдена
(скопления кристаллоида, состоящего из продуцируе-
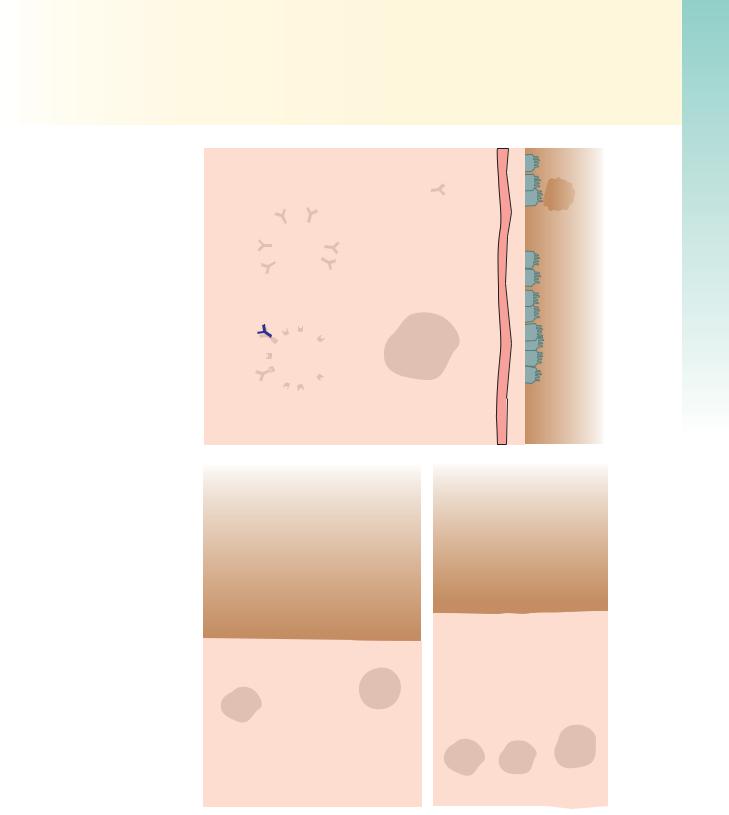
мых эозинофилами белков). Другие характерные изменения при астме (определяют общим термином «ремоделирование воздухоносных путей») включают следующие параметры (рис. 13.12).
•Утолщение базальной мембраны бронхиального эпителия.
•Отек и воспалительный инфильтрат в стенках бронхов (с примесью эозинофилов и тучных клеток).
•Увеличение размера желез подслизистого слоя.
•Гипертрофия гладкомышечных клеток бронхиальных стенок.
Клинические проявления. Приступ астмы сопровождается тяжелой одышкой с хрипами и затрудненным выдохом. Пациенты вдыхают воздух в легкие, но затем не могут его выдохнуть, вследствие чего возникает прогрессирующая гиперинфляция легких из-за накопления его в дистальных отделах легких (накапливается в результате бронхоспазма и облитерации бронхов слизью и слущенным погибшим эпителием). Обычно приступ длится от одного до нескольких часов и разрешается спонтанно или под влиянием терапии (обычно используют бронходилятаторы и глюкокортикоиды). Интервалы между приступами характеризуются свободным дыханием, но при этом с помощью спирометрических методов диагностируют хронические негрубые нарушения дыхания. Иногда может развиться длительный приступ бронхоспазма, который не отвечает на терапию и сохраняется в течение многих дней и даже недель (астматический статус). Возникающие гиперкапния, ацидоз и серьезная гипоксия могут стать фатальными, хотя в большинстве случаев болезнь чаще приводит к инвалидизации больного, нежели к летальному исходу.
НОРМА |
Слизь |
|
Эпителий |
|
Базальная |
|
мембрана |
|
Собственная пластинка слизистой оболочки |
|
Гладкомышечные клетки |
|
Железы |
|
Хрящевая пластинка |
БРОНХИАЛЬНАЯ АСТМА |
Эозинофилы |
|
|
|
Слизь |
|
Бокаловидные клетки |
|
Базальная мембрана |













 Макрофаги
Макрофаги

















 Гладкомышечные клетки
Гладкомышечные клетки 










 Железа
Железа
Лимфоциты |
Нейтрофилы Эозинофилы Тучные |
(CD4+ ,TH2) |
клетки |
Рис. 13.12. Сравнение строения нормального бронха и бронха пациента, страдающего бронхиальной астмой. Обратите внимание на накопление слизи в просвете бронхиолы, происходящее в результате увеличения количества секретирующих слизь бокаловидных клеток в слизистой оболочке, а также гипертрофии слизистых желез подслизистого слоя. Кроме того, отмечается интенсивное хроническое воспаление с накоплением эозинофилов, макрофагов, TH2-лимфоцитов и других воспалительных клеток. Базальная мембрана эпителия утолщена, визуализируется гипертрофия и гиперплазия гладкомышечных клеток

ЗАКЛЮЧЕНИЕ
Бронхиальная астма
•Астма характеризуется обратимой бронхоконстрикцией, вызванной гиперреактивностью воздухоносных путей к множеству различных стимулов.
•Атопическая астма вызвана TH2- и IgEустановленной иммунологической реакцией на экологические аллергены и характеризуется развитием реакций острой (немедленной)
ипоздней фазы. Цитокины ИЛ-4, ИЛ-5 и ИЛ-13,
вырабатываемые TH2-клетками, — важные медиаторы данного типа астмы.
•Пусковые механизмы неатопической астмы
менее изучены, включают вирусные инфекции
ивдыхаемые воздушные поллютанты.
•Эозинофилы — ключевые воспалительные клетки, обнаруживаемые при любом варианте бронхиальной астмы; продукты эозинофилов (например, главный основной белок) ответственны за повреждение бронхиального эпителия.
•Ремоделирование воздухопроводящих путей
(утолщение базальной мембраны и гипертрофия гладкомышечных клеток бронхиальной стенки) служит дополнительным признаком обструктивных заболеваний легких.
Бронхоэктазы
Бронхоэктазы1 — постоянное расширение бронхов
ибронхиол, вызванное разрушением гладкомышечного
иэластического каркаса их стенок, которое происходит вследствие хронических некротизирующих инфекций (или связано с ними). Это скорее не первичная болезнь, а вторичное заболевание, возникающее в результате персистенции инфекции или обструкции, вызванной множеством причин. Заболевание характеризуется комплексом признаков, среди которых доминирующим считают кашель с отхождением большого количества гнойной мокроты. Диагноз ставят на основании соответствующего анамнеза и обнаружения бронходилатаций при радиографическом исследовании. Условия, обычно предрасполагающие к развитию бронхоэкта-
зов, включают следующие факторы.
• Обструкция бронха. К наиболее распространенным причинам относят опухоли, инородные тела и иногда слизистую пробку. В таких случаях бронхоэктазы имеют локальный характер и ограничены легочным сегментом, где возникла обструкция. Бронхоэктазы могут также осложнить атопическую астму и хрони-
ческий бронхит.
• Врожденные или наследственные факторы (приведены только некоторые из них).
–При кистозном фиброзе (муковисцидозе) бронхоэктазы широко распространены и возникают вследствие инфекций и обструкции дыхатель-
1 В русскоязычной литературе обычно используют термин «бронхоэктатическая болезнь». — Прим. ред.
ГЛАВА 13. Легкие 591
ных путей (вызваны секрецией чрезмерно вязкой слизи). Бронхоэктазы представляют важнейшее и серьезное осложнение заболевания (см. главу 7).
–При иммунодефицитных состояниях, особенно при дефиците иммуноглобулина, бронхоэктазы, вероятно, развиваются из-за повышенной восприимчивости к повторным бактериальным инфекциям; при этом могут возникнуть локальные или распространенные бронхоэктазы.
–При синдроме Картагенера (аутосомнорецессивное заболевание) бронхоэктазы служат
распространенным признаком (сочетанным с мужским бесплодием). В основе заболевания лежат структурные нарушения ресничек эпителиальных клеток, приводящие к ослаблению мукоцилиарного клиренса в дыхательных путях, что приводит к постоянным инфекциям, а также
куменьшению подвижности сперматозоидов.
•Некротизирующая или абсцедирующая пневмонии, вызванные высоковирулентными организмами (Staphylococcus aureus или Klebsiella spp.), могут создавать предрасположенность к бронхоэктазам. В прошлом постинфекционные бронхоэктазии являлись следствием перенесенных в детстве пневмоний, осложнявших корь, коклюш и грипп (в настоящее время
всвязи с успешной иммунизацией такие состояния регистрируют редко). Посттуберкулезные бронхоэктазы — существенная причина заболеваемости
вэндемичных районах.
Патогенез. В патогенезе бронхоэктазии крайне важны два взаимосвязанных фактора: обструкция и хроническая персистирующая инфекция. Каждый из этих двух факторов может иметь первостепенное значение. Нормальные механизмы клиренса могут нарушаться при обструкции, к которой быстро присоединяется вторичная инфекция. И наоборот, хроническая инфекция со временем вызывает повреждение стенок бронхов, приводя к ослаблению их тонуса и дилатации. Например, обструкция, вызванная бронхогенной карциномой или инородным телом, ослабляет мукоцилиарный клиренс, создавая тем самым благоприятную среду для вторичной инфекции. Возникающее впоследствии воспаление бронхиальной стенки приводит к накоплению экссудата в дистально расположенных участках, приводя к необратимому расширению бронхов. Постоянное некротизирующее воспаление в бронхах или бронхиолах вызывает обструкцию (вследствие повышенной секреции), воспаление бронхиальной стенки (с перибронхиальным фиброзом, обусловливающим тракцию стенок бронхов) и в конечном счете вышеописанную последовательность событий.
Морфология
Бронхоэктазы обычно развиваются в нижних долях с двух сторон, особенно в дыхательных путях, имеющих наиболее вертикальное расположение. В случаях бронхоэктазов при опухолевом росте или аспирации инородных тел процесс носит локальный

592 ГЛАВА 13. Легкие
Рис. 13.13. Бронхоэктазы. Обратите внимание на поверхность разреза легкого с расширенными бронхами, простирающимися практически на плевру (макропрепарат). [Любезно предоставлено доктором Линдой Марграф, кафедра патологии, Университет Техаса, Юго-Западная Медицинская Школа, Даллас. Техас]
характер и ограничен единственным легочным сегментом. Обычно наиболее выраженные изменения выявляют в более дистальных бронхах и бронхиолах. При макроскопическом исследовании бронхи расширены и прослеживаются до плевральной поверхности, а просвет их может превышать просвет неизмененных бронхов более чем в 4 раза (рис. 13.13). (В отличие от этого, в нормальных легких бронхи невозможно визуализировать при макроскопическом исследовании на расстоянии 2–3 см от плевральных поверхностей.) Результаты гистологического исследования зависят от активности процесса и длительности болезни. В случае высокой активности процесса в стенках бронхах обнаруживают признаки хронической воспалительной реакции в стадии обострения с десквамацией бронхиального эпителия и образованием обширных изъязвлений слизистой оболочки. Обычно в бактериальных культурах, полученных из бронхов, выявляют смешанную флору, включающую стафилококки, стрептококки, пневмококки, энтерококки и кишечные микроорганизмы, анаэробные и микроаэрофильные бактерии, а также (особенно у детей) Haemophilus influenzae и Pseudomonas aeruginosa. В ходе заживления может происходить полная репарация покровного эпителия, однако, как правило, повреждение носит глубокий характер, что приводит к формированию рубца и дилатации бронхиальной стенки1. Фиброз бронхиальных и бронхиолярных стенок, а также
перибронхиальный фиброз развивается у большого количества пациентов с хронической формой заболевания. В некоторых случаях некроз бронхиальных или бронхиолярных стенок приводит к формированию абсцесса легкого.
1 Речь идет о разрушении фиброзно-мышечного каркаса и лизисе эластических волокон. Репарация при этом носит
неполный характер с формированием рубца вместо разрушенных тканей. — Прим. ред.
Клинические проявления. Клинические признаки включают тяжелые, постоянные приступы кашля с откашливанием слизисто-гнойной, иногда зловонной мокроты. Мокрота может содержать примесь крови; иногда возникает выраженное кровохарканье. Симптомы часто носят эпизодический характер и индуцируются инфекциями верхних дыхательных путей или воздействием новых патогенных агентов. Иногда наблюдают деформацию пальцев в виде барабанных палочек. В тяжелых вариантах заболевания с широким распространением бронхоэктазов возникают существенные нарушения вентиляции обструктивного характера с гипоксемией, гиперкапнией, легочной гипертензией и (реже) легочного сердца. Метастатические абсцессы головного мозга и реактивный амилоидоз (см. главу 5) — менее распространенные осложнения бронхоэктазов.
Диффузные интерстициальные (рестриктивные, инфильтрирующие) болезни легкого
Диффузные интерстициальные (рестриктивные) болезни легкого2 — гетерогенная группа заболеваний, которые характеризуются преобладанием диффузного
иобычно хронического поражения легочной соединительной ткани, преимущественно наиболее периферических отделов легкого, включая интерстиций альвеолярных стенок. Как показано на рис. 13.1, легочный интерстиций представлен базальной мембраной эндотелиальных и эпителиальных клеток (совмещенных в области аэрогематического барьера), коллагеновыми
иэластическими волокнами, фибробластами, небольшим количеством тучных и мононуклеарных клеток. Многие заболевания данной группы имеют неустановленную этиологию и патогенез; для некоторых характерно наличие внутриальвеолярного или интерстициального компонента, а также их сочетание (по данным гистологических изменений). Однако наличие идентичных клинических признаков, симптомов, радиологических проявлений и патофизиологических признаков оправдывает рассмотрение данной группы заболеваний. Хотя причиной рестриктивных заболеваний может служить также и нарушение строения стенок грудной клетки (некоторые состояния были описаны ранее), в данном разделе рассмотрены только заболевания с паренхиматозным компонентом. Важные признаки и симптомы рестриктивных заболеваний легкого можно объяснить, исходя из морфологических изменений. Ключевой признак заболеваний данной группы — уменьшение эластичности ткани (то есть расширение легких происходит при большем давлении в связи с повышенной их жесткостью), что, в свою очередь, требует повышенного усилия при дыхании (одышка). Кроме того, повреждение альвеолярного эпителия
имикрососудов интерстиция приводят к нарушениям вентиляционно-реперфузионных взаимодействий
ик гипоксии. При радиологическом исследовании обнаруживают диффузную инфильтрацию и мелкие
2 Речь идет о поражении интерстиция и паренхимы респираторных отделов легкого. — Прим. ред.

ПОВРЕЖДЕНИЕ ЛЕГКОГО Вдыхаемые агенты, пыли,
кровяные токсины, неизвестные антигены
АКТИВИРОВАННЫЕ МАКРОФАГИ
Рекрутмент |
Фиброгенные |
|
и хемотаксические |
||
нейтрофилов |
||
цитокины |
||
|
||
Оксиданты, |
|
|
протеазы |
|
|
|
ФИБРОБЛАСТЫ |
|
Повреждение |
Фиброгенные |
|
и хемотаксические |
||
пневмоцитов 1 типа |
||
цитокины |
Гипертрофия и гиперплазия пневмоцитов II типа
Рис. 13.14. Общая схема патогенеза хронических рестриктивных болезней легкого (см. описание в тексте)
очажки, иррегулярные линии и симптом «матового стекла». С прогрессированием заболевания у пациентов может развиться дыхательная недостаточность, часто в сочетании с легочной гипертензией и легочным сердцем (см. главу 11).
Диффузные интерстициальные заболевания объединены в группу клинико-патологических синдромов на основании их морфологической общности (табл. 13.3). В то время как финальная стадия большинства хронических диффузных интерстициальных болезней легкого, вне зависимости от их этиологии, представлена диффузным интерстициальным легочным фиброзом с развитием сотового легкого (или без него),
то более ранние изменения часто имеют достаточные гистологические признаки, которые можно обнаружить при биопсии (например, существование гранулем или сигнализирующего о повреждении нехарактерного для этой ткани материала) для исключения некоторых заболеваний, а иногда и для постановки точного диагноза. Точный социальный и профессиональный анамнез обязателен для патолога, исследующего биоптат.
Патогенез. Принято считать, что независимо от типа интерстициальной болезни или определенной причины, самым ранним общим признаком большинства интерстициальных заболеваний служит альвеолит (под этим термином подразумевают развитие воспалительного инфильтрата, включающего
ГЛАВА 13. Легкие 593
также иммунокомпетентные клетки в пределах стенок и просветов альвеол). Если повреждение носит умеренный характер и самоограничено, то происходит полная репарация ткани с восстановлением ее структуры. Однако при персистенции повреждающего агента в ответную реакцию вовлекаются
лимфоциты, макрофаги и нейтрофилы, сами вызывающие повреждение паренхимы, пролиферацию фибробластов и прогрессирующий интерстициальный фиброз (рис. 13.14). Активация легочных макрофагов — ключевое событие в патогенезе интерстициального фиброза. Активированные макрофаги секретируют хемоаттрактанты (например, ИЛ-8 и лейкотриен B4), привлекающие в очаг и стимулирующие нейтрофилы. Растворимые медиаторы (оксиданты, протеазы), высвобождающиеся из макрофагов и нейтрофилов, повреждают альвеолярные эпителиальные клетки и вызывают деградацию соединительной ткани. Альвеолярные макрофаги секретируют также и «фиброгенные» факторы, включая фактор роста фибробластов, трансформирующий фактор роста β (ТФР-β) и тромбоцитарный фактор роста, которые могут привлекать фибробласты и стимулировать их пролиферацию, запуская, таким образом, процессы репарации ткани. Установлено, что альвеолярные эпителиальные клетки являются не просто пассивными целями в этом процессе. Разрушение пневмоцитов I типа сопровождается пролиферацией пневмоцитов типа II. Эти клетки секретируют хемотактические факторы (например, хемотактический белок 1 для макрофагов), привлекающие дополнительно макрофаги в альвеолы. Кроме того, они могут способствовать фиброзу путем секреции фактора роста тромбоцитов и других фиброгенных цитокинов (как, например, ТФР-β). В настоящее время ученые разрабатывают лекарственные средства, способные блокировать ТФР-β-индуцированный фиброз.
Таблица 13.3. Основные группы хронических интерстициальных заболеваний легких
Фиброзирование
Обычная интерстициальная пневмония (идиопатический легочный фиброз)
Неспецифическая интерстициальная пневмония Криптогенная организующаяся пневмония Патология легких при коллагеновых сосудистых
заболеваниях
Пневмокониозы Патология терапии (лекарства, радиация)
Гранулематоз
Саркоидоз Гиперсенситивные пневмониты
Эозинофильная патология
Патология, связанная с курением
Десквамативная интерстициальная пневмония Респираторный бронхиолит

594 ГЛАВА 13. Легкие
Легочный фиброз
Идиопатический легочный фиброз
Идиопатический легочный фиброз (ИЛФ), также называемый криптогенным фиброзирующим альвеолитом, относят к легочным заболеваниям неизвестной этиологии. Болезнь характеризуется гистологически диффузным интерстициальным фиброзом, приводящим в тяжелых случаях к серьезной гипоксемии и цианозу. Этиология заболевания неизвестна. Мужчины заболевают чаще, чем женщины (приблизительно две трети пациентов старше 60 лет на момент постановки диагноза). Гистологические изменения обозначаются как обычная интерстициальная пневмония (ОИП), что необходимо подтвердить с помощью биопсии легкого для постановки диагноза ИЛФ. Однако следует подчеркнуть, что подобные патологические изменения в легком обнаруживают и при других заболеваниях, например, асбестозе и сосудистых коллагеновых болезнях. Именно поэтому прежде чем поставить диагноз «идиопатических», необходимо исключить заболевания с установленной этиологией.
Морфология
Макроскопически плевральные поверхности легкого имеют вид «булыжной мостовой» вследствие ретракции легочной паренхимы за счет фиброзной ткани, расположенной вдоль междольковых перегородок. На поверхности разреза также определяют очаги фиброза (плотные очаги резиновой консистенции, имеющие белый цвет), более выраженные в нижних долях легкого (с явным преобладанием субплевральной локализации вдоль междольковых перегородок). Морфология фиброза при ИЛФ соответствует структуре обычной интерстициальной пневмонии (ОИП). Гистологический признак ОИП —
неоднородный интерстициальный фиброз (рис. 13.15), который характеризуется вариантной интенсивностью и изменчивостью со временем. Более ранние изменения содержат скопления пролиферирующих фибробластов с формированием фибробластических фокусов (рис. 13.16). Со временем эти области замещаются большим количеством коллагена и становятся малоклеточными. Весьма типичным считают существование ранних и поздних изменений (стадий) заболевания. Плотный фиброз вызывает коллапс альвеолярных стенок и формирование кистозных полостей, выстланных гиперплазированными пневмоцитами II типа или бронхиолярным эпителием (сотовый фиброз). Межуточное воспаление обычно носит очаговый характер и представлено инфильтрацией альвеолярных перегородок, главным образом лимфоцитами, отдельными плазматическими клетками, тучными клетками и эозинофилами. Часто присутствуют признаки вторичной легочной гипертензии (фиброз интимы и утолщение средней оболочки легочных артерий).
Клинические проявления. ИЛФ обычно имеет период бессимптомного течения, с постепенным нача-
Рис. 13.15. Обычная интерстициальная пневмония (ОИП). Фиброз разной степени выраженности, наиболее интенсивный в субплевральных отделах
Рис. 13.16. Обычная промежуточная пневмония. Фибробластический фокус с волокнами, идущими параллельно поверхности, и синеватым микоматозным внеклеточным матриксом
лом непродуктивного кашля и прогрессированием одышки. При аускультации у большинства пациентов с ИЛФ выслушивают потрескивания во время вдоха (крепитация, напоминающая звук по типу «застежка на липучке»). На более поздних стадиях болезни возникает цианоз, легочное сердце и периферические отеки. Биопсия легкого остается золотым стандартом диагностики ИЛФ (ее используют и для исключения других причин легочного фиброза). К сожалению, прогрессирование ИЛФ не удается остановить, несмотря на терапию, и средняя выживаемость составляет 3 года или меньше. Трансплантация легкого — единственный приемлемый метод терапии.
Неспецифическая интерстициальная пневмония
У пациентов с неспецифической интерстициальной пневмонией наблюдают диффузное интерстициальное заболевание неизвестной этиологии, при котором в биоптате легкого не обнаруживают признаки другой известной интерстициальной болезни легких.
Хотя метод постановки диагноза и основан на принципе «корзины для мусора», но имеет значение для диффе-

ГЛАВА 13. Легкие 595
Рис. 13.17. Криптогенная организующаяся пневмония. Просветы альвеол заполнены пробочками из фибробластов (стрелка)
ренциальной диагностики неспецифической интерстициальной пневмонии и ИЛФ, так как пневмония имеет лучший прогноз. На основе гистологической картины выделяют клеточный и фиброзный типы неспецифической интерстициальной пневмонии. Клеточный тип заболевания характеризуется наличием хронического интерстициального диффузного или очагового воспаления (лимфоциты и отдельные плазматические клетки), выраженность которого варьирует от слабого до умеренного. Фиброзный вариант пневмонии представлен диффузным или очаговым интерстициальным фиброзом без стадийных изменений, характерных для ИЛФ. Фибробластические фокусы в типичных случаях отсутствуют. Пациенты жалуются на одышку
идлительный кашель (несколько месяцев). Пациенты с клеточным типом заболевания имеют лучший прогноз, чем с больные с фиброзным типом и ИЛФ.
Криптогенная организующаяся пневмония
Термины «криптогенная организующаяся пневмония»
и«облитерирующий бронхиолит с организующейся пневмонией» — синонимы; однако первый термин считают предпочтительным, поскольку он подчеркивает неизвестную этиологию данного заболевания. Пациенты предъявляют жалобы на кашель и одышку, а при рентгенологическом исследовании выявляют субплевральные или перибронхиаьные очаги консолидации воздушного пространства. Гистологически криптогенная организующаяся пневмония характеризуется наличием полипоидных образований из рыхлой соединительной ткани в просветах альвеолярных ходов, альвеол и часто бронхиол (рис. 13.17). Соединительная ткань имеет одинаковую степень зрелости, а основная архитектура легкого нормальна. Некоторые люди выздоравливают спонтанно, но большинству требуется лечение глюкокортикоидами в течение 6 месяцев или более. Следует заметить, что криптогенная организующаяся пневмония с внутриальвеолярным фиброзом1 может также возникать в исходе легочных инфекций (например, пневмоний) или воспалительного процесса (например,
1 Синоним внутриальвеолярного фиброза — «карнификация». — Прим. ред.
при коллагеновых болезнях и при трансплантации); в этих случаях этиологию, очевидно, нельзя считать «криптогенной».
Патология легких при ревматических заболеваниях
Многие ревматические болезни (например, системная красная волчанка, ревматоидный артрит, системный склероз и дерматомиозит-полимиозит) сопровождаются легочной патологией. Различные варианты легочных изменений описывают при разных ревматических заболеваниях, включая неспецифическую интерстициальную пневмонию, ОИП-подобные изменения (близкие ИЛФ), сосудистый склероз, организующаяся пневмония и более распространенный бронхиолит (маленькая болезнь воздушных путей с фиброзом или без него). Плевральная патология (плеврит, плевральные узелки и плевральные бляшки) также может присутствовать. Патология легких при этих болезнях обычно связана с плохим прогнозом, хотя он лучше, чем при ИЛФ.
ЗАКЛЮЧЕНИЕ
•Диффузный легочный фиброз лежит в основе рестриктивных заболеваний легких, которые характеризуются уменьшением объема легких
иснижением их жизненной емкости (ЖЕЛ).
Соотношение ОФВ1 к ЖЕЛ остается нормальным.
•Болезни, вызывающие диффузный интерстициальный фиброз, представляют группу гетерогенных заболеваний. Универсальным патогенетическим фактором считают повреждение
альвеол с активацией макрофагов и выбросом фиброгенных цитокинов (таких как ТФР-β).
•Идиопатический легочный фиброз — прототип рестриктивных заболеваний легких — характеризуется неоднородным фиброзом легкого
иформированием кистозных полостей (сотовое легкое). Гистологическое строение аналогично
обычной интерстициальной пневмонии.

596 ГЛАВА 13. Легкие
Пневмокониозы
Термин «пневмокониоз» первоначально использовали для описания неопухолевых заболеваний легких, возникающих в ответ на вдыхание минеральной пыли. Со временем пневмокониозами стали называть неопухолевые легочные заболевания, вызванные как органическими, так и неорганическими частицами, а по мнению некоторых экспертов, — также дымами и парами. Из пневмокониозов, вызванных минеральными пылями, наиболее часто диагностируют заболевания, развивающиеся вследствие экспозиции угля, кремния и асбеста (профессиональные вредности). Как бы то ни было, но экспозиция асбеста повышает риск развития рака как у самих рабочих, так и членов их семей и других индивидов, контактировавших с асбестом вне рабочего места. В табл. 13.4 представлены патологические состояния, связанные с разнообразными минеральными пылями и основными промышленными производствами, где экспозиция пыли приводит к заболеваниям.
Патогенез. Реакция легкого на минеральную пыль зависит от многих факторов, включая размер, форму, растворимость и реактивность частиц. Например, частицы диаметром более чем 5–10 мкм вряд ли достигнут отдаленных от центра участков дыхательной системы, тогда как частицы диаметром менее 0,5 мкм имеют тенденцию действовать как газы и через альвеолы могут попадать в кровоток, часто без существенного накопления в ткани легкого и повреждения. Частицы диаметром 1–5 мкм представляют наибольшую опасность, потому что они накапливаются в областях бифуркаций мелких бронхов, отдаленных от центра. Угольная пыль относительно инертна, и большое количество должно быть депонировано в легких прежде, чем болезнь легкого можно клинически обнаружить. Кварц, асбест и бериллий — более реактивны, чем угольная пыль, и приводят
кфиброзированию при более низких концентрациях. Большинство вдыхаемых пылей оседают в пласте слизи и быстро удаляются из легкого движением ресничек1. Тем не менее некоторые частицы задерживаются в местах бифуркаций альвеолярных ходов, где макрофаги накапливают их путем эндоцитоза. Легочный альвеолярный макрофаг — ключевой клеточный элемент в инициировании и осуществлении повреждения легкого, развитии его фиброза. Более реактивные частицы побуждают макрофаги
ксекреции большого количества продуктов, которые вызывают воспалительный ответ, инициируют пролиферацию фибробластов и накопление коллагена. Некоторые частицы достигают грудного лимфатического протока или путем прямого дренажа, или в составе мигрирующих макрофагов. Таким образом, инициируется иммунный ответ на компоненты макрочастиц и/или на собственные белки, измененные частицами. Затем происходит усиление местной реакции. Курение табака потенциирует эффекты любой вдыхаемой минеральной пыли (наиболее опасен в этом отношении асбест).
Пневмокониоз работников угледобывающей промышленности. Во многих британских романах (например, Д.Г. Лоренса «Сыновья и любовники») описана трагедия шахтеров конца XX в., трудившихся под землей на протяжении всей
жизни и погибавших от «черных легких», осложненных туберкулезом. Снижение запыленности в угольных шахтах значительно уменьшило распространенность заболевания, вызванного угольной пылью. Спектр патологии легкого у рабочих угольных шахт широк и представлен такими заболеваниями, как бессимптомный антракоз (при котором пигмент накапливается без заметной клеточной реакции), простой пневмокониоз рабочих угольных шахт, или ПРУШ (при котором накопление макрофагов вызывает небольшую дисфункцию легких или протекает без таковой), сложный ПРУШ, или прогрессирующий массивный фиброз, ПМФ (характеризуется обширным фиброзом с нарушением функций легкого) (см. табл. 13.4). Несмотря на различие статистических данных, в целом установлено, что немногим менее 10% случаев простого ПРУШ прогрессируют в ПМФ. Следует отметить, что ПМФ — общее определение — относится к прогрессирующему фиброзу легких, который может развиваться при каждом из трех вариантов пневмокониоза, обсуждаемых в данном разделе.
Хотя уголь и состоит из углерода, пыль угольных шахт содержит множество примесей металлов, неорганических минералов и кристаллов кварца. Соотношение содержания углерода к химическим примесям и минералам («степень углефикации») увеличивается от битума до антрацита; в целом добыча антрацита связана с более высоким риском развития ПРУШ.
Морфология
Легочный антракоз — самая «безобидная» патология легких, вызванная угольной пылью у шахтеров, а также нередко у горожан и курильщиков табака. Вдыхаемый угольный пигмент захватывается альвеолярными или интерстициальными макрофагами, которые затем накапливаются в соединительной ткани вдоль лимфатических сосудов (включая лимфатические сосуды плевры) или в лимфатических узлах. Простой ПРУШ характеризуется формированием угольных пятен и угольных узелков (образований несколько большего диаметра). Угольные пятна построены из скоплений макрофагов, нагруженных пылью; в дополнение к описанному, в угольных узелках содержится небольшое количество тонкой сети коллагеновых волокон. Хотя эти очаги и рассеяны по всему легкому, однако верхние доли и верхние зоны нижних долей поражаются в большей степени. Именно поэтому может развиться центрилобулярная эмфизема. Эмфизему с нарушением функций легких обычно диагностируют в Великобритании и Европе, где степень углефикации выше, чем в США.
Осложненный ПРУШ (ПМФ) возникает на фоне простого ПРУШ и характеризуется наличием сливающихся угольных узелков (их формирование происходит в течение многих лет). Макроскопически в легких обычно обнаруживают множественные, интенсивно-черного цвета рубцы диаметром от 2 до 10 см (рис. 13.18). При микроскопическом исследовании угольные узелки состоят из плотно расположенных коллагеновых волокон и пигмента.
1 Механизм мукоцилиарного клиренса. — Прим. ред.

Рис. 13.18. Прогрессирующий массивный фиброз при пневмокониозе работников угольных шахт. Большие почерневшие рубцырасположеныпреимущественновверхнейдоле.Обратите внимание на распространение рубцов в окружающую паренхиму и втянутость прилежащей плевры. [С благодарностью Dr. Werner Laquer, Dr. Jerome Kleinerman и Национальному Институ Профессиональной Безопасности и Здоровья]
Клинические проявления. Как правило, ПРУШ характеризуется нетяжелыми симптомами и небольшими нарушениями функций легких. В тех случаях, когда развивается ПМФ, отмечают выраженную легочную дисфункцию, легочную гипертензию и легочное сердце. Прогрессирование от ПРУШ до ПМФ связано со множеством условий, включая уровень запыленности угольной пылью и полную пылевую нагрузку. К сожалению, ПМФ имеет тенденцию прогрессировать даже в отсутствие дальнейшего контакта с пылью. Риск развития бронхогенной карциномы при ПРУШ не больше, чем при экспозиции кремния и асбеста, что было доказано в исследованиях с учетом фактора курения (см. далее).
Силикоз
В настоящее время силикоз — самая распространенная хроническая профессиональная болезнь в мире. Это вызвано ингаляцией кристаллического кварца, главным образом на рабочем месте. Кварц существует
ГЛАВА 13. Легкие 597
вкристаллической и в аморфной форме, но кристаллические формы (включая кварц, кристобалит и тридимит), безусловно, являются наиболее токсичными и фиброгенными. Кварц наиболее часто служит причиной силикоза. После ингаляции частицы взаимодействуют с эпителиальными клетками и макрофагами. Поглощенные частицы кварца вызывают активацию легочных макрофагов и выброс ими медиаторов, включая ИЛ-1, ФНО, фибронектин, фиброгенные цитокины, перекиси липидов, а также генерацию кислородных свободных радикалов. Особенно поразительными считают доказательства роли ФНО; как показали исследования, введение мышам антител против ФНО способно заблокировать накопление коллагена в ткани легкого
вэксперименте с интратрахеальным введением кварца.
Было отмечено, что при одновременном введении кварца с другими минералами снижается его фиброгенное действие. Это явление имеет практическое значение, потому что кварц, вдыхаемый на рабочем месте, редко бывает чистым. Таким образом, легкие шахтеров, имеющих контакт с кварцевой пылью с примесями железосодержащего минерала гематита, могут содержать больше кварца при меньшей степени выраженности патологии, чем легкие лиц, работающих с кварцем (так как гематит обеспечивает защитный эффект).
Морфология
Силикотические узелки макроскопически на ранних стадиях имеют вид крошечных (едва заметных), дискретных, бело-черных (при наличии угольной пыли) образований, характерных для верхних зон легких (рис. 13.19). При микроскопическом исследовании силикотические узелки состоят из концентрически расположенных гиалинизированных волокон коллагена, окружающих аморфный центр. «Завитой» вид волокон коллагена весьма типичен для силикоза (рис. 13.20). При поляризационной микроскопии обнаруживают слабо двоякопреломляющие частицы кварца, расположенные преимущественно в центре узелков. Прогрессирование заболевания приводит к слиянию индивидуальных узелков в плотные коллагеновые рубцы, возможна также прогрессия в ПМФ. В пораженной легочной ткани отмечают очаги ателектаза или эмфиземы, может развиться также сотовое легкое. Фиброзные изменения иногда возникают в лимфатических узлах ворот легкого и в плевре. В некоторых случаях небольшие очаги кальцификации обнаруживают в лимфатических узлах и выявляются радиологически как симптом «яичной скорлупы» (кальций, окружающий зону без признаков кальцификации).
Клинические проявления. Силикоз, как правило, обнаруживают на обычных рентгенограммах грудной клетки, выполненных у не предъявляющих жалоб рабочих. Характерна мелкая нодулярность верхних зон легкого, легочные функции при этом нормальны или только умеренно нарушены. У большинства индивидуумов одышка долго не развивается, возникая
