
хирургия 5 курс / книги / Savel'ev V.S. (red.) 80 lekcij po hirurgii (Litterra, 2008)(ru)(T)(K)(910s)(ISBN 9785982161190)
.pdfТрансплантация сердца: настоящее и будущее
расслоения доводили до овального окна межпредсердной перегородки. Затем изнутри рассекали на этом уровне заднюю стенку правого предсердия. После окончания анастомоза между левыми предсердиями донора и реципиента анастомозировали края разреза нижней полой вены донора с краями разреза «мостика» между полыми венами реципиента. В конце операции накладывали анастомозы между аортами и легочными артериями донора и реципиента.
В настоящее время мы упростили технику операции, устранив этап формирования «мостика» между полы ми венами реципиента. Для этого сшиваем латераль ный край разреза нижней полой вены донора с задней стенкой правого предсердия реципиента анастомозом «конец в бок» латеральнее его овальной ямки, по той же линии, где производили разрез в первоначальном варианте. Противоположный край разреза нижней полой вены сшиваем с краем правого предсердия реци пиента, после удаления излишков его тканей. Отказ от формирования «мостика» между полыми венами реципиента позволил упростить операцию и ускорить время ее выполнения.
При выполнении пересадки сердца по данной мето дике отпадает необходимость создания отдельных цир кулярных анастомозов между нижними и верхними полыми венами донора и реципиента. Частота дисфун кции синусового узла, трикуспидальной регургитации при данной методике достоверно не отличается от результатов при кава-кавальной методике ТС.
Месячная летальность после ТС составила 31,6%. Основными причинами ееявлялись нарушения насосной функции трансплантата (тотальная или правожелудочковая недостаточность) и инфекционные осложнения.
Использование с 1996 г. ингаляционного оксида азота позволило полностью исключить летальность от правожелудочковой недостаточности, а приме нение нового поколения антибактериальных и проти вовирусных препаратов значительно снизить частоту инфекционных осложнений.
Посттрансплантационная иммуносупрессивная терапия включает циклоспорин А, азатиоприн и метилпреднизолон. С 1998 г. начато использование новой схемы трехкомпонентной терапии— циклоспорин А, метилпреднизолон и селл-септ. В настоящее время циклоспорин А постепенно заменяется на Програф (FK506). —
При использовании циклоспорина А нередко отме чаются артериальная гипертензия, нефро- и гепатотоксичность. Сочетание с кетоканозолом (низорал) позво лило снизить дозу принимаемого циклоспорина А на 70%, что в 90% случаев предупреждает его нефро- и
гепатотоксический эффект, не снижая при этом концен трацию иммуносупрессора в крови.
После ТС с целью диагностики острого отторжения трансплантата необходимо выполнение эндомиокардиальной биопсии. В первый месяц после ТС— ежене дельно, во второй месяц — один раз в две недели, далее в течение первых двух лет — один раз в два-три меся ца. С третьего года — один раз в полгода. Всего после ТС в НИИТ и ИО МЗ РФ выполнено более 1300 биопсий. Только в б% наблюдений при этом выявили умеренное или тяжелое острое отторжение. Стероидо-резистен- тное (персистирующее) клеточное острое отторжение наблюдали у 3 больных. Положительный эффект был достигнут в результате лечения антитимоцитарным гло булином и метотрексатом.
При гуморальном (сосудистом) отторжении с нару шением функции трансплантата, диагностированном у 2 реципиентов, лечебный эффект обеспечили соче тания гормональной пульс-терапии с 5—7 сеансами плазмафереза.
После ТС из клиники выписали 74 пациента. Анализ отдаленных результатов ТС, выполненных более 10 лет тому назад, показал, что выживаемость более 1 года соста вила 84,6%, более 5 лет — 69,2% и более 10 лет — 24%.
Степень недостаточности кровообращения в тече ние первого и последующих годов наблюдения после ТС у 86% пациентов соответствует 0—1 функцио нальному классу NYHA. Снижение толерантности к физической нагрузке, соответствующее II—III функ циональному классу NYHA, отмечали только у больных с посттранспланционным поражением коронарных артерий.
При анализе особенностей восстановления функции синусового узла трансплантированного сердца выделе ны пять вариантов: нормальную функцию наблюдали у 71,7% пациентов, транзиторную дисфункцию — у 14,3%, персистирующую — у 5,4%, полное отсутствие функ ции — у 8,6%. У 71,7% больных восстановился сину совый ритм с частотой сокращений более 90 в минуту. Частота сокращений пересаженного денервированного сердца превышала частоту сокращений иннервированного органа в среднем на 25%.
Развитие дисфункции синусового узла связано, вероятно, с травмированием его во время операции в процессе анастомозирования правого предсердия донорского сердца с остатком предсердия реципиента. При использовании кава-кавальной и модифицирован ной методики ТС этой проблемы практически не возни кает. Она достаточно значима после ТС по атриальной методике. Почти у 14% пациентов возникает необходи мость в имплантации постоянного водителя ритма либо
51
Сердечно-сосудистая хирургия
в ближайшем, либо в отдаленном посттрансплантаци онных периодах.
При анализе электрокардиограммы у 75% реципи ентов выявили частичную и полную блокаду правой ножки пучка Гиса. Причины ее развития остаются пока неясными. Наблюдаемые желудочковые и наджелудочковые нарушения ритма легко поддавались терапии и не влияли на прогноз после ТС.
Мониторинг гемодинамики пересаженного сердца в постреанимационном (госпитальном) и отдаленном (пост госпитальном) периодах в покое при синусовом ритме и отсутствии острого отторжения трансплантата показал, что денервация трансплантированного сердца оказывает незначительный эффект на гемодинамические показате ли донорского сердца в покое. После периода гемодинамической нестабильности в непосредственном пост трансплантационном периоде насосная функция сердца достигает нормальных или субнормальных значений уже через 2—3 недели после ТС.
Венозную гипертензию легкой степени (до 15 мм рт. ст.) наблюдали у 15% реципиентов в течение первого года после ТС, умеренную (до 20 мм рт. ст.) — только в течение первых двух месяцев у 5% больных и тяжелую (более 20 мм рт. ст.) исключительно интраоперационно и в ран нем посттрансплантационном периоде. Тяжелая венозная гипертензия была обратимой при использовании инотропных препаратов в сочетании с вазодилататорами либо при механической поддержке правого желудочка пересажен ного сердца. Причинами развития венозной гипертензии являются трикуспидальная регургитация, предшествую щая легочная гипертензия, гиперволемия, замедленная адаптация правого желудочка пересаженного сердца.
В первый месяц после ТС артериальную гипертензию наблюдали у 62% больных. Посттрансплантационная артериальная гипертензия обусловлена вазоконстрикторным эффектом циклоспорина А, который, увеличи вая продукцию тромбоксана, снижает уровень простациклина, одновременно активирует ренин-ангиотензи- новую систему и повышает концентрацию норадреналина, а также гиперволемию в результате применения стероидных гормонов.
Для предупреждения артериальной гипертензии, гиперфункции и гипертрофии пересаженного сердца необходим контроль концентрации циклоспорина А и индивидуальный подбор гипотензивных препаратов. Лучшие результаты получены от использования анта гонистов кальция (нифедипин и др.) или ингибиторов ангиотензин-превращающего фермента (каптоприл, эналаприл и др.).
Результаты нагрузочных тестов показали, что денервированный трансплантат способен адаптиро
ваться к нагрузке и обеспечивает адекватный кровоток в организме. Вместе с тем, в отличие от иннервированного сердца, денервированное сердце увеличивает минутный объем кровообращения прежде всего за счет прироста ударного объема на фоне увеличения венозного возврата с вторичным повышением частоты сокращений.
Длительное выживание после ТС лимитировано болезнью коронарных артерий пересаженного сер дца (основная причина), инфекционными осложне
ниями и острым отторжением трансплантата.
С целью ранней диагностики болезни коронарных артерий у 53 реципиентов выполнили 172 рентгеноконтрастные коронароангиографии. Частота поражения коронарных артерий в сроки до 5 лет составила 15%, от 5 до 14 лет — 43,8%.
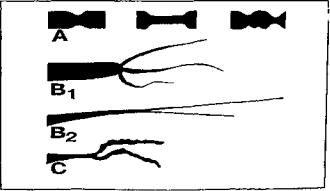
По международной классификации выделяют 3 типа поражения коронарных артерий пересаженного сердца {рис. 2): тип А — дискретные или тубулярные стенозы; тип В — диффузные концентрические стенозы средних и дистальных отделов сосудов (подтип В : — резкое концентрическое стенозирование, подтип В2 — плавное концентрическое стенозирование) и тип С— дистальное поражение мелких ветвей.
По нашим данным, в венечных сосудах первого поряд ка поражение типа А встречается в 69,4% наблюдений, типов В и С — в 12%; в артериях второго порядка, соответственно — в 30,6% и 32%. Для артерий третьего порядка тип А не характерен, а поражение типов В и С выявляется в 56% наблюдений. Окклюзии венечных сосу дов выявляют в 19,7% случаев от всех поражений. В 50% наблюдений они локализуются в проксимальных сегмен тах, в 18% — в средних и в 32% — в дистальных.
Возможны 2 варианта клинического течения болезни коронарныхартерий пересаженного сердца: быстро про грессирующий (до 6 месяцев) наблюдают у 25% больных
Рис. 2. Международная классификация поражения коронар ных артерий пересаженного сердца
52
Тронспламтоция сердца: настоящее и будущее
и медленно прогрессирующий (несколько лет) — у 75%. Первый вариант протекает с клиникой острой декомпен сации сердечной деятельности; второй — с постепен ным нарастанием явлений сердечной недостаточности и ухудшением состояния реципиентов.
Патогенез гиперплазии интимы сосудов при болез ни коронарных артерий до конца не ясен. К факторам риска относят предтрансплантационную ишемическую болезнь сердца, ранние (до 3 месяцев) острые кризы отторжения трансплантата, повышенное отложение иммунноглобулинов, СЗ-фракции комплемента и фиб рина под сосудистым эндотелием (диагностируется в биопсийном материале), повышение содержания обще го холестерина и триглицеридов в крови, нарушения гемостаза, цитомегаловирусную инфекцию, артериаль ную посттрансплантационную гипертензию, побочные эффекты стероидов.
Для профилактики болезни коронарных артерий пересаженного сердца используют назначение дезагрегантов (препараты ацетилсалициловой кислоты), гиполипидемических, гипотензивных и противовирусных лекарственных средств. С целью ранней диагностики болезни коронарных артерий трансплантата необходи мо ежегодное проведение коронароангиографических исследований. Показанием для проведения внеплано вой ангиографии являются результаты радиоизотоп ных исследований и велоэргометрических нагрузочных проб.
Современной лечебной мерой служит транслюминальная баллонная коронароангиопластика. Несмотря на паллиативность данной процедуры, она позволяет восстановить коронарный кровоток и продлить нор мальную функцию трансплантата. В НИИТ и ИО 8 боль ным с поражением коронарных артерий типа А выпол нено 16 транслюминальных баллонных коронароангиопластик с постановкой покрытого сиролимусом стента в переднюю межжелудочковую артерию в пяти случаях. К сожалению, часто возникает необходимость повтор ных вмешательств в связи с рестенозами коронарных артерий. У 4 реципиентов через 4—30 месяцев после выполнения первой процедуры проведены повторные баллонные коронароангиопластики.
В отдаленные сроки после ТС причиной леталь ности пациентов являются инфекционные вирус ные гепатиты (В, С, сочетание В и С). Динамический анализ маркеров гепатита у непривитых реципиентов выявил прогрессирующее инфицирование гепатотропными вирусами: на первом году число инфицированных составляет 22,3%, а к 10 годам — 80%.
Одним из путей профилактики инфицирования вирусом гепатита В представляется плановая вакцина
ция реципиентов, стоящих в листе ожидания, которую выполняем с 1998 г. (вакцина Энджерикс В).
Гибель больных от острого отторжения переса женного сердца при несвоевременной диагностике и лечении возможна как в первый год, так и в отдаленные сроки после ТС.
Увеличение продолжительности жизни пациентов с пересаженным сердцем выявило новую проблему — рост числа злокачественных новообразований в этой популя ции больных. Онкологические заболевания диагности руют, как правило, у пациентов, живущих после ТС более 10 лет. Среди наших реципиентов базалиому кожи выявили в наблюдениях на 10-м и 12-м годах после ТС; перифери ческую аденокарциному легкого — в 1 случае на 11 году после ТС; неоперабельный рак прямой кишки с метастаза ми в печень в 1 случае — через 12 лет после ТС.
Важной проблемой является необходимостьэкстракардиальных хирургических операций в ближайшие и отдаленные сроки после ТС. У реципиентов выполняли различные внесердечные операции в условиях общей анестезии: ушивание прободной язвы желудка, панкреатотомию с дренированием общего желчного прото ка по поводу острого панкретатита, холецистэктомию, резекцию нижней доли левого легкого по поводу аденокарциномы с метастазами в лимфоузлы сре достения, бифуркационное протезирование брюшной аорты, удаление варикозно расширенных вен нижних конечностей, имплантации искусственных хрустали ков глаза и др. У 2 пациенток с пересаженным сердцем в сроки от 8 до 24 нед выполняли прерывание бере менности. Результаты хирургических вмешательств у пациентов с пересаженным сердцем не отличаются от таковых в обычной популяции больных.
Результаты первых 100 ТС в НИИТ и ИО МЗ РФ вполне соответствуют международным данным.
Для оказания своевременной и радикальной помощи пациентам с конечной стадией застойной сердечной недостаточности и обеспечения длительного выживания после ТС необходимо решение следующих проблем:
•дефицит донорских органов;
•создание имплантируемых систем для длительно го вспомогательного кровообращения или полной замены сердца;
•изучение патогенеза и разработка методов про филактики болезни коронарных артерий переса женного сердца;
•разработка эффективных мер профилактики вирусной инфекции и злокачественных новооб разований;
•внедрение новых более совершенных иммунносупрессантов.
53
Сердечно-сосудистая хирургия
Литература |
|
Трансплантология. Руководство (под ред. В.И. Шумакова) |
|||||||||||||
|
М.: Медицина, Тула «РепрониксЛтд», 1995, с. 212 |
|
238 |
||||||||||||
1. Шумаков В.И., Семеновский М.Л., |
Казаков Э.Н. и др. |
7. |
Шумаков |
В.И., |
Хубутия |
М.Ш., Селезнева |
Е.А. |
и.до |
|||||||
|
Электрофизиологические |
исследования |
после |
орто- |
|||||||||||
Трансплантация сердца. Первый |
клинический опыт / |
|
|||||||||||||
|
топической трансплантации |
сердца |
/ |
Кардиология |
|||||||||||
Грудная хирургия, 1988, 4, с. 5—П. |
|
|
|||||||||||||
|
|
1995, 2, |
с. 28—31. |
|
|
|
|
|
|
|
|
|
|||
2. Шумаков В.И. Рациональные детали техники пересадки |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
сердца / Грудная хирургия, 1989, 4, с. 13—17. |
8. |
Шумаков В.И., Кормер А.Я., Казаков Э.Н. и др. Клиническая |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
3. Шумаков В.И., Казаков Э.Н., Семеновский (иниц.) и др. |
|
физиология пересаженного сердца. Глава: Очерки по фи- |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Хроническое отторжение пересаженного сердца / Грудная |
|
зиологическим проблемам трансплантологии и применения |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
и сердечно-сосудистая хирургия, 1991,1, с. 18—21. |
|
искусственных органов (под ред. В. И. Шумакова), Тула |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
4. Шумаков В.И., Казаков Э.Н., Кормер А.Я. и др. Гемодинамика |
|
«Репроникс Лтд», 1998, с. 9—33. |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
малого круга кровообращения до и после трансплантации |
9. |
Шумаков В.И. Модификация хирургической техники |
|||||||||||||
сердца при дилатационной кардиомиопатии / Грудная и |
|
ортотопической трансплантации сердца / Вестник |
|||||||||||||
сердечно-сосудистая хирургия, 1993,6, с. 4—7. |
|
трансплантологии |
и |
искусственных |
органов, |
2000, 3 |
|||||||||
5. Шумаков В.И., Казаков Э.Н., Кормер А.Я. Терапия прогрес |
|
с. |
3—5. |
|
|
|
|
|
|
|
|
|
|
|
|
сирующей сердечной недостаточности перед трансплан |
10. |
Шумаков В.И., Остроумов Е.Н., Кормер А.Я. и др. Общая и |
|||||||||||||
тацией сердца / Клиническая фармакология и терапия, |
|
региональная функция миокарда левого и правого желу |
|||||||||||||
1993, 4, с. 26—30. |
|
|
дочков при стенозирующем поражении коронарных арте |
||||||||||||
6. Шумаков В.И., Казаков Э.Н., Кормер А.Я. и др. Транс |
|
рий |
пересаженного |
сердца / |
Вестник |
трансплантологии |
|||||||||
плантация сердца. Глава «Частная трансплантология». |
|
и искусственных органов. 2001, 2, с. |
15—20. |
|
|
|
|||||||||
54
МИНИМАЛЬНО ИНВАЗИВНАЯ ХИРУРГИЯ ВРОЖДЕННЫХ
ИПРИОБРЕТЕННЫХ ПОРОКОВ СЕРДЦА
Р.К. Джорджикия
Всовременной кардиохирургии большое внима ние уделяется не только адекватной коррекции пато логического процесса, но и уменьшению травматичности оперативного вмешательства, что способствуют предупреждению послеоперационных осложнений, сокращению сроков пребывания в стационаре, быстрой реабилитации больных, достижению хорошего косме тического эффекта. Сложности оперативного лечения
вкардиохирургии во многом обусловлены значитель ной травматичностью оперативных доступов (в основ ном используется продольная тотальная стернотомия), необходимостью применения искусственного крово обращения (ИК) и связанными с ним последствиями (нарушения гомеостаза, гемостаза и т.д.) и другими факторами.
Вкоронарной хирургии эти трудности преодолева ют путем широкого распространения эндоваскулярных методов лечения (ангиопластика и стентирование), при менения операций на работающем сердце с помощью различных стабилизаторов и интраоперационных посо бий. Все это позволяет исключить ИК и связанные с ним проблемы.
Вхирургии врожденных пороков сердца в основном при септальных дефектах (в большинстве случаев — ДМПП) в последние годы также стали применять эндоваскулярные методы закрытия дефектов с помощью специальных устройств (Amplatzer), которые не требуют ИК и резко сокращают сроки лечения больных. Вместе
стем в лечении приобретенных и ряда врожденных пороков сердца отказаться от применения ИК в насто ящее время невозможно. Поэтому на пути к улучшению результатов лечения, наряду с совершенствованием методов хирургической коррекции пороков, защиты миокарда, ИК и других факторов важное значение приобретает уменьшение травматичности оперативного доступа.
Внастоящее время оперативные методы, применя емые для лечения врожденных и приобретенных поро ков сердца, использующие небольшие хирургические доступы, традиционные и/или специальную технику и инструменты, направленные на уменьшение травматич ности операций и ускорение реабилитации больных, стали называть минимально инвазивной кардиохирур
гией. В отношении ИБС минимально инвазивной хирур гией (МИХ) считают операции на работающем сердце (без ИК) из продольной стернотомии или правосторон ней торакотомии.
Первые публикации о применении минимально инвазивной техники в хирургическом лечении при обретенных пороков сердца появились в 1996 году. D.M. Cosgrove и J.F. Sabik (1996), J.L. Navia и D.M. Соsgrove (1996) сообщили об успешных операциях на
аортальном и митральном клапанах из |
небольшо |
го правостороннего парастернального |
доступа. |
В 1996 г. D.S. Schwarts с соавт. привели данные экспери ментального исследования, в котором подключение ИК осуществлялось через бедренные сосуды, применялись окклюзия аорты эндоаортальным баллоном и антеградная кардиоплегия. Было показано, что данная методика также эффективна, как и традиционная. M.F. Pompili с соавт. (1996) в эксперименте использовали подобную технику, малые (портовые) доступы и видеоподдержку для протезирования и пластики митрального клапана. Впоследствии такой способ оперативного вмешатель ства был назван «port-access» техникой. В дальнейшем она стала применяться в клинике для коррекции врож денных и приобретенных пороков сердца, ишемической болезни сердца.
Ключевым моментом в МИХ-пороков сердца служит выбор адекватного оперативного доступа и определе ние критериев для такого выбора. В наиболее ранних исследованиях J. Navia и D. Cosgrove (1996) для опера ций на митральном клапане применяли правосторон нюю парастернальную торакотомию от нижнего края II ребра до верхнего края V ребра с резекцией I I I — IV реберных хрящей. Этот доступ требует перевязки правой внутренней грудной артерии и подключения ИК через бедренные сосуды. Кроме того, имеются затруд нения при необходимости расширения доступа. По мере накопления опыта выявилось, что при парастернальном доступе после резекции хрящей ребер у ряда больных наблюдается парадоксальная пульсация в области вме шательства. Поэтому в последующих исследованиях А.Н. Gillinov и D.M. Cosgrove (1999) стали использовать верхнюю парциальную стернотомию и транссептальный доступ к митральному клапану. Авторы сообщили о
55
Сердечно-сосудистая хирургия
462 операциях с использованием данного доступа с
0,2% летальностью, подчеркивая хорошую экспозицию МК, минимальные осложнения со стороны раны, умень шение гемотрансфузий и превосходный косметический эффект.
W. Konertz с соавт. (1996) предложили верхнюю частичную стернотомию для операций на митральном и аортальном клапанах. Разрез грудины производили по средней линии от верхнего края грудины до IV межреберья с пересечением поперечно вправо (L-образный). Инвертированную L-образную стернотомию применяли J.E. Rodrigues с соавт. (1996, 1998), R.K. Tarn с соавт. (1997), J. Kobayashi с соавт. (1998). Авторы использова ли стандартное подключение ИК и пришли к выводу, что данный доступ безопасен и, при необходимости, может быть переведен в традиционный стернотомный доступ.
U.R. Nair и D. Sharpe (1997) для подхода к митраль ному клапану предложили ограниченную стернотомию, начинающуюся со II межреберья справа к середи не грудины, а затем охватывающую нижние ее 2/3. Данный доступ позволяет традиционно подключать ИК, а, в случае необходимости — выполнить полную стернотомию. Кроме того, он сохраняет обе внутренние грудные артерии, грудинноключичный сустав и верх нюю треть грудины.
R.3. Moreno-Cabral (1997), D. Doty с соавт. (1998) выполняли операции при приобретенных заболеваниях сердца из Т-образной нижней стернотомии. Кожный разрез, длиной 10 см, проходил от III межреберья до мечевидного отростка. Грудина пересекалась попереч но на уровне II или III межреберья, а затем продольно по средней линии с мечевидным отростком. Интактной оставалась верхняя половина грудины. Подключение артериальной магистрали можно было производить как через аорту, так и через бедренную артерию.
Н. Kasegawa (1998) применил правостороннюю парциальную стернотомию по типу «открытой двери» (open-door) у 40 больных с митральным пороком. При этом доступе рассекается правая половина грудины на уровне II межреберья, затем выполняется продольная срединная стернотомия до мечевидного отростка и вновь вправо поперечно пересекается грудина.
L.G. Svensson и R.S. D'Agostino (1998) для выполне ния МИХ-операций применяли J/j разрезы. «J разрез» грудины начинается от правого I межреберья, затем продольно вниз по средней линии и вновь отклоня ется вправо на уровне IV или V межреберья. Данный доступ авторы применяли для протезирования аорталь ного и митрального клапанов, вмешательства на вос ходящей аорте, а также для закрытия ДМПП. «J досту пом» авторы назвали разрез грудины от рукоятки до
III правого межреберья и использовали при синдроме |
|
Марфана. Авторы отмечали относительную универсаль |
|
ность доступа. |
/ |
М. Massetti с соавт. (1998, 1999) предложили еле- |
: |
дующий МИХ-доступ: кожный разрез длиной 6—9 см |
i |
при вмешательстве на митральном клапане выполняют |
|
в промежутке от III до V межреберья, при манипуляци |
|
ях на аортальном клапане — от II до IV межреберья. |
|
Затем мягкие ткани, покрывающие грудину, мобилизуют |
|
и производят субтотальную стернотомию (рассекают |
|
рукоятку и тело грудины при сохранении мечевидного |
|
отростка). ИК подключают стандартно. Для облегчения |
|
мобилизации тканей авторы предложили специальный |
|
адаптированный ретрактор. H.Y. Karagoz с соавт. (1999) |
|
показали, что для коррекции пороков атриовентрику- |
|
лярных клапанов может использоваться субксифоид- |
|
ный доступ. |
|
При коррекции пороков митрального клапана по |
|
«Port-access» технике или модификациях данного |
|
метода (трансторакальное пережатие аорты и др.) |
|
вкачестве оперативного доступа используют пра востороннюю переднюю или боковую торакотомию
вIV межреберье. Длина кожного разреза составляет от 5 до 8 см (Farm J.I. et al., 1997; Reichenspurner H. et al., 2000 и др.).
Хирургическим доступам к аортальному клапану, их преимуществам и недостаткам посвящены ряд исследо ваний. D.M. Cosgrove и J.F. Sabik (1996) сначала приме няли правый парастернальный доступ, преимущества и недостатки которого были описаны выше. Другие хирурги (Cosgrove D.M., Sabik J.F., 1996; Cuenca J. et al., 1998; Bridgewater B. et al.,1998; Yakub M.A. et al., 1999) в качестве доступа к аортальному клапану применя ли поперечную стернотомию во II межреберье. Если D.M. Cosgrove использовал бедренную канюляцию арте рии и вены, то J. Cuenca с соавт. (1998) применяли попе речный доступ у 23 больных со стандартным подклю чением ИК с хорошими результатами. Авторы считают, что данная методика является более простой и, вместе с тем, менее агрессивной процедурой. Y. Fujimura с соавт. (1998) для коррекции пороков АК предложили J-образную стернотомию со стандартным подключе нием ИК. F.F. Sardari с соавт. (1997), М.В. Izzat с соавт. (1998) описали верхнюю перевернутую Т-образную министернотомию для операций на аортальном клапа не. Шестисантиметровый кожный разрез начинают на 2 пальца ниже вырезки грудину и продолжают до уров ня IV ребра. Затем грудину пересекают поперечно в III межреберье. ИК подключают стандартно.
Y-S. Chang с соавт. (1999) предложили «I» мини стернотомию для протезирования АК. Разрез длиной
96
Минимально инвазивная хирургия врожденных и приобретенных пороков сердца
8—10 см выполняли вертикально в промежутке между II и V межреберьем. Грудину рассекали по средней линии в указанном промежутке, а затем поперечно как в проксимальной, так и дистальной части. ИК подключали стандартно. Авторы заключают, что «1»-доступ создает хорошую экспозицию.
A. Aris с соавт. (1999) описали реверсированную «С»-министернотомию для хирургии АК. Разрез груди ны осуществляют между II и V межреберными проме жутками по средней линии и переводят вправо гори зонтально на уровне вышеуказанных межреберий. Доступ обеспечивает стандартное подключение ИК и, в случае необходимости, может быть преобразован в традиционный.
Л.А. Бокерия с соавт. (1998) для коррекции пороков аортального и митрального клапанов использовали верхнюю L-образную министернотомию.
Таким образом, предложенные для коррекции при обретенных пороков сердца минимально инвазивные доступы обеспечивают вмешательства либо на одном из клапанов сердца, либо обладают свойством уни версальности. Тем не менее в ряде случаев возникают трудности в выполнении операции и приходится при бегать к конверсии доступа. По данным A.M. Gillinov, D.M. Cosgrove (1999), J.M. De Smet с соавт. (2001), к конверсии приходится прибегать в 3—5% случаев. В связи с этим отмечается важность изучения инди видуальных особенностей расположения сердца и магистральных сосудов по отношению к передней грудной стенке.
F.F. Sardari с соавт. (1997) для выбора места попе речного пересечения грудины при верхней Т-образной стернотомии использовали ЧП Эхо-КГ. R. Yozu с соавт. (1998) и М. Kitamura с соавт. (2002) указывали на необходимость проведения перед минимально инвазивной операцией рентгенографии грудной клетки, компьютерной томографии и ангиографии для выбо ра оптимального доступа. R. Ammar с соавт. (1998) у 3-х больных с аортальным пороком для выявления расположения фиброзного кольца аортального клапа на использовали спиральную компьютерную томогра фию (СКТ). После 30-реконструкции авторы выявляли уровень расположения фиброзного кольца клапана на передней грудной стенке. Во всех случаях была най дена высокая корреляция между СКТ и интраоперационными данными. Л.А. Бокерия с соавт. (1999, 2003) применили методику определения проекции АК, брахиоцефального ствола, верхней и нижней полой вены на передней грудной стенке с помощью спиральной компьютерной томографии у пациентов с клапанной патологией. Авторы показали высокую эффективность
методики для определения топики отделов сердца в грудной клетке.
При выполнении операций на атриовентрикулярных клапанах по «Port-access» технике в подавляющем большинстве случаев используется правосторонняя передняя торакотомия в IV межреберье. Естественно, что индивидуальные особенности расположения серд ца и магистральных сосудов по отношению к передней грудной стенке и у данной категории больных также должны учитываться.
Для уменьшения параметров оперативного доступа и, следовательно, операционной травмы, а также пол ноценного осуществления основного этапа операции важное значение приобретают способы подключения ИК, проведение кардиоплегии в условиях ограниченно го доступа. В настоящее время можно выделить следу ющие варианты подключения ИК:
•Стандартное подключение — через восходящую аорту и правое предсердие (Бокерия Л.А. и соавт., 1998; Cosgrove D.M. et at., 1998; El-Bishry A.S. et at., 2001; Besogyul Y. et at., 2002).
•Подключение артериальной магистрали через бедренную артерию, а венозных - через правое предсердие (Joshi S.V. et Motwani R.A., 2001).
•Подключение артериальной и венозной магистра лей через бедренные сосуды, проведение опера ции при глубокой гипотермии на фибриллирующем сердце без пережатия аорты (Tsai F.C. et at., 1996; Vleissis A.A. et Boiling S.F., 1998 и др.).
•Подключение артериальной и венозной магис тралей через бедренные сосуды, декомпрессия левых отделов сердца через дренаж правой вер хней легочной вены, пережатие аорты зажимом
иретроградная кардиоплегия (Cohn L.H. 1998; Loulment D.F. et al., 1998 и др.).
•Применение «Port-access» системы: подключе ние артериальной магистрали Y-образной каню лей через бедренную артерию, венозной магис трали через бедренную вену для дренирования правого предсердия; применяется специальный эндоаортальный баллон-катетер (Endoclamp; Heartport Inc, Redwood City, CA), позволяющий осуществить окклюзию восходящей аорты, кардиоплегию, а после завершения основного этапа операции — деэмболизацию камер сердца. Для дренирования легочной артерии отдельный кате тер проводят через внутреннюю яремную вену. Нахождение катетеров, адекватность окклюзии контролируют с помощью ЧП Эхо-КГ (Stevens O.H. et al., 1996; Schwartz D.S. et al., 1997; Cotvin S.B. et at., 1998; Reichenspurner H. et al., 2000 и др.).
57
Сердечно-сосудистая хирургия
тЭндоваскулярное подключение ИК с транстора газа наблюдают с помощью интраоперационной ЧП кальным пережатием аорты специальным зажи Эхо-КГ.
мом (Chitwood) и антеили ретроградной кардиоплегией (Chitwood W.R. et al., 1997; Onnasch J.F. et al., 2002; Trehan N. et al., 2002 и др.).
Трансторакальный зажим (sliding-rod-design clamp, Scanlan International, Inc., Minneapolis, MN) вводят через отдельный прокол во II — III межреберье по среднеключичной линии. Под контролем зрения или эндоскопа данным зажимом осуществляют пережа тие восходящей аорты. Подобная техника позволяет использовать антеградную кардиоллегию через корень аорты. Возможно и применение ретроградной кардиоплегии с помощью катетера, установленного в коро нарный синус, под контролем ЧП Эхо КГ.
При выполнении МИХ-операций под непосредствен ным контролем зрения и стандартным подключением ИК используют, как правило, различные виды министернотомных доступов, длина которых колеблется от 10 до 12 см. Эндоваскулярное подключение ИК позволя ет уменьшить оперативный доступ. Длина кожного раз реза при данной технике колеблется от 6 до 8 см. При применении «Port-access» системы оперативный доступ может быть сокращен до минимума (до 4—б см).
Для улучшения визуализации интракардиальных структур в условиях ограниченного доступа, парал лельно с эндоваскулярным подключением ИК, многие авторы стали применять эндовидеосистемы (Tsai F.C. et al., 1996; Carpenter A. et al., 1996; Chitwood W.R. Jr. et al., 1997 и др.). Вначале использовали двухмерные или трехмерные системы визуализа ции (торакоскопы). Затем Mohr F.W. с соавт. (1999) и Reichenspurner H. с соавт. (2000) стали приме нять роботизированную систему, управляемую голо сом — AES0P-3000 (Automated Endoscope System for Optimal Positioning — Computer Motion Inc, Goleta, CA). В настоящее время для улучшения визуализации и экспозиции при выполнении операций на клапанах сердца внедряют роботизированные системы типа «da Vinci» (Nifong L.W. et al., 2001, 2004; Onnasch J.F. et al., 2002 и др.) или «Zeus» (Gundry S.R. et al., 2001; Menkis A.H. et al., 2001).
В условиях ограниченного доступа важное значение приобретают мероприятия, направленные на удаление воздушных пузырьков из камер сердца, т.к. традицион ные методы деэмболизации часто становятся затруд нительными (Скопин И.И. и соавт., 2001, Webb W.R. et al, 1997, Tokunaga S.T. et al., 2001 и др.). Поэтому для надежной деаэрации полостей сердца применяют пода чу углекислого газа в полость раны во время внутрисердечного этапа операции, а за эффективностью удаления
При проведении МИХ клапанов сердца, как правило, применяют общепринятую для данного учреждения анестезию. Вместе с тем ряд авторов отмечают необ ходимость применения таких методов, при которых наряду с адекватным обезболиванием можно было бы достигнуть раннего выхода больных из наркоза, исполь зовать раннюю экстубацию пациентов с последующей активизацией в палате интенсивной терапии и сокра щением сроков пребывания в данной палате (Pawlowski J. et al., 1997; Blanc P. et al., 1999; Marianeschi S.M. et al., 2000 и др.).
Во время проведения анестезии и операции по МИХ технике возникают дополнительные трудности, связанные с установкой чреспищеводного датчика для Эхо-КГ, установкой баллон-катетера в восходящей аорте, катетеров в легочной артерии, коронарном сину се при «Port-access» технике (Blanc P. et al., 1999; Kitamura M. et al., 2002 и др.).
В настоящее время наиболее распространенными показаниями к использованию МИХ считают изолиро ванное поражение митрального и аортального клапа нов, миксому сердца, дефекты межпредсердной пере городки, аномальный дренаж правой верхней легочной вены в правое предсердие в сочетании с дефектом венозного синуса, пороки трикуспидального клапана, сочетание митрального и трикуспидального пороков.
Минимально инвазивная хирургия аортального клапана
Наиболее часто в качестве доступов используют верхние гемистернотомические подходы: инверти рованную L-образную, J-образную или реже — верх нюю, перевернутую Т-образную министернотомию. Применяются ретракторы малого размера. Перикард рассекается продольно. Подключение ИК осущест вляют по схеме «аорта—ушко правого предсердия». Выполнение основного этапа операции не отлича ется от общепринятой методики и не сопровожда ется трудностями. Дефибрилляцию осуществляют малыми электродами или проводят чрескожно. Для предупреждения воздушной эмболии используются традиционные методы (выпускание крови из восхо дящей аорты, отсасывание из дренажа правой верх ней легочной вены и др.); в случае затруднений — подача в рану углекислого газа со скоростью 2 л/мин. Подшивание временных электродов ЭКС к миокарду, дренирование полости перикарда и подстернального
58
Минимально инвазивная хирургия врожденны» и приобретенных пороков сердца
пространства предпочтительнее проводить до отклю чения ИК.
Минимально инвазивная хирургия митрального клапана и врожденных пороков сердца
Chitwood W.R. Jr. с соавт. (2003) выделяют 4 вариан та вмешательств.
1.Операции под непосредственным контролем зре ния (Direct-Vision).
2.Видеоассистированные операции (VideoAssisted).
3.Операции с помощью видеосистем или роботассистированные (Video-Directed and RobotAssisted).
4.Операции, выполняемые с помощью роботов
(Telemaniputation and Robotic).
Операции на МК, септальных дефектах под непо средственным контролем зрения выполняют из право сторонней миниторакотомии в IV межреберье; верхней J-образной или нижней Т-образной министернотомии. При традиционном подключении ИК длина кожного разреза у взрослых может колебаться от 10 до 12 см. При министернотомиях операция значительно не отли чается от традиционных методов.
Правостороннюю миниторакотомию обычно у взрос лых пациентов используют в сочетании с бедренным подключением артериального и венозного магистра лей ИК, эндовидеоподдержкой. Длина кожного разре за сокращается до б—8 см. Для канюляции бедрен ной вены используют бикавальную канюлю Карпанть (Medtronik), которую проводят в правое предсердие и обе полые вены. Пережатие аорты осуществляют с помощью трансторакального зажима, введенного через отдельный порт в III межреберье. С этой целью мы при меняем управляемый аортальный зажим собственной конструкции, который можно вводить как через порт, так и непосредственно через рану. Кардиоплегия может выполняться антеградно, через корень аорты.
При применении «Port-access» техники окклю зию аорты проводят эндоаортальным баллоном. Кардиоплегию осуществляют антеградно (через корень аорты, через зндоаортальный баллон) или ретроградно через введенный в коронарный синус катетер. Доступ к МК может проводиться как через правое, так и левое предсердие. Основной этап операции (различные вари анты пластики, протезирование) выполняют под кон тролем зрения или с помощью эндовидеоподдержки,
используя при этом стандартные или модифициро ванные инструменты. Для профилактики воздушной эмболии применяют подачу в рану углекислого газа со скоростью 2 л/мин. Контроль за нахождением катете ров, деаэрацией, эффективностью коррекции порока осуществляют с помощью ЧП Эхо-КГ. Дефибрилляцию проводят с помощью малых электродов внутриперикардиально или, в случае неэффективности, чрескожно. Подшивают электроды ЭКС до отключения ИК.
При проведении операций с помощью видеосис тем используют трехмерную систему визуализации, управляемую голосом AESOP — 3000. Значительно улучшается визуализация операционного поля, клапана и подклапанных структур. Для выполнения операций используют роботы «da Vinci» или «Zeus». При опера циях с помощью робототехники выполняют 4 см разрез в IV межреберье справа по среднеключичной линии, ИК подключают через бедренные сосуды. В верхний угол раны устанавливают видеосистему, которая поз воляет наблюдать за операционным полем на расстоя нии. Окклюзию аорты проводят либо трансторакальным зажимом, либо эндоаортальным баллоном. После про ведения кардиоплегии в III и VI межреберьях через порты вводят манипуляторы робота. С их помощью, находясь у консоля робота (дистанционно), хирург выполняет основной этап операции.
Особенности ведения больных после МИХ приоб ретенных и врожденных пороков сердца в раннем послеоперационном периоде, послеоперационные осложнения, госпитальная летальность, длительность пребывания больных в 0РИТ и стационаре проанализи рованы в ряде работ. Вусловиях нашей клиники в 2000— 2006 годы были выполнены более 350 МИХ-операций по поводу ВПС и ППС с применением как министернотомных доступов, так и правосторонней миниторакотомии с подключением ИК через бедренные сосуды и эндови деоподдержкой. В данной группе больных наблюдались уменьшение послеоперационного болевого синдрома, кровопотери, сокращение сроков пребывания в палате реанимации и стационаре, уменьшение послеопераци онных осложнений, сокращение сроков реабилитации больных, хороший косметический эффект.
Первое многоцентровое исследование, посвящен ное результатам применения «Port-access» техники (Galloway А.С. et al., 1999), показало, что на 184 протези рования МК летальность составила 3,3%, на 137 пластик МК — 1,5%. Авторы приходят к заключению, что МИХ ППС может быть безопасной, с частотой осложнений и летальности, аналогичной традиционным методам.
L.H. Conn (2001) приводит результаты МИХ-операций у больных с изолированным митральным (п = 353) и аор-
59
Сердечно-сосудистая хирургия
тальным (п = 336) пороками по «смешанной» методике подключения ИК. Автор приходит к выводу, что при дан ной технике послеоперационная летальность меньше в группе с митральным пороком и одинакова при аор тальном пороке в сравнении со стандартной техникой. Отмечаются более короткие сроки нахождения в ПИТ и стационаре, уменьшение стоимости операции, меньшая кровопотеря, уменьшение случаев фибрилляции пред сердий, более быстрый возврат к активной жизни.
J.F. Onnasch с соавт. (2002) проанализировали 5-летний опыт применения МИХ митрального клапана у 449 больных со средним возрастом 59 лет. Вначале авторы использовали «Port-access» технику. Однако после значительного числа осложнений в начальной серии исследований в дальнейшем стали применять трансторакальное пережатие аорты (по Chitwood), кото рое упростило технику операции. Двум третям больных выполнена пластика МК, остальным — протезирова ние. Неврологические осложнения в группе с транс торакальным пережатием (ТТП) аорты уменьшились по сравнению с «Port-access» техникой, послеоперацион ная летальность составила соответственно 3,1 и 5,2%. Стоимость операции была сопоставима с традиционной в группе ТТП, в то время как в «Port-access» группе она была дороже. Учитывая надежность МИХ митраль ного клапана, уменьшение осложнений, связанных со стернотомией, как при первичных, так и повторных операциях, авторы используют данную методику как стандартный подход.
A. Grossi с соавт. (2002) в течение 6 лет, преиму щественно по «Port-access» технике (82,3%), проопе рировали 714 пациентов. Средний возраст больных составил 58,3 года. Изолированное поражение МК имел 561 больной, у остальных были сочетанные пороки. Госпитальная летальность при пластике МК составила 1,1% и при протезировании — 5,8%. Общая после операционная летальность была 4,2%. Среднее время нахождения в ОРИТ составило 19 часов, в стационаре — 6 дней. Осложнения включали неврологический дефи цит (2,9%), диссекцию аорты (0,3%). Инфекционные осложнения не наблюдались.
В 2002 году в клинике Кливленда доктором Cosgrove D.M. выполнена работа, обобщающая результаты 607 минимально инвазивных вмешательств на аорталь ном клапане. Протезированию механическим или ксенопротезо^ подверглись 76% больных, 24% операций составили пластические вмешательства. Интересно, что только в 1,7% наблюдений производили расширение доступа до продольной стернотомии. Наиболее частой причиной служило решение выполнить симультантную операцию реваскуляризации. Время пережатия аорты и
ИК было сравнимо с таковыми при традиционных мето диках. В указанной клинике за такой же период были прооперированы 1427 больных с поражением митраль ного клапана при помощи верхней гемистернотомии и модифицированных перфузионных методик: 82% боль ных страдали дегенеративной формой порока в форме недостаточности, 9% — ревматическим пороком с пре обладанием недостаточности. Практически все больные подверглись пластическим операциям. Длительность ИК и пережатия аорты в среднем составили 80 и 60 минут соответственно. Эти показатели оказались меньше, чем соответствующие значения при полной продольной стернотомии. В этой группе больных отмечена меньшая частота послеоперационных осложнений, смертности и послеоперационного койко-дня.
А.Р. Kypson и W.R. Зг. Chitwood (2004) провели 50 операций пластики митрального клапана с помощью роботизированной системы да Винчи. Авторы отмечают, что с ростом опыта выполнения таких операций снижа ется их длительность, практически нет значимых пос леоперационных осложнений. В настоящее время идут многоцентровые испытания этой роботизированной сис темы в хирургии митрального клапана. Промежуточные результаты свидетельствуют об относительной без опасности и эффективности роботизированного метода вмешательства на митральном клапане.
Таким образом, в настоящее время минимально инвазивная кардиохирургия приобретенных и врожденных пороков сердца - реально существующая методика. Она востребована, показана определенному кругу боль ных. Более широкое ее применение (особенно в России) ограничивается необходимостью выбора нестандарт ных подходов, нового инструментария и оборудования, в некоторых случаях консерватизмом хирургов и дру гими факторами. В распространении МИХ-технологий большую роль должны сыграть развитие видеоэндоско пических трехмерных систем визуализации, разработка новых инструментов, роботизированных манипулято ров, обучение кардиохирургов данной технологии.
Литература
1.Бокерия Л.А., Скопин И.И., Нарсия Б.Е., Макаренко В.Н., Седов И.Н. Спиральная компьютерная томография в опре делении показаний к минимально инвазивной хирургии приобретенных пороков сердца/ Грудная и сердечно-сосу дистая хирургия, 1999, № 5, с. 34—37.
2.Бокерия Л.А., Джорджикия Р.К., Садыков А.Р. и др. Актуальные вопросы минимально инвазивной хирургии приобретенных пороков сердца / Грудная и сердечно-со судистая хирургия. 2003, /V? 4, с. 5—9.
60
