
хирургия 5 курс / книги / Savel'ev V.S. (red.) 80 lekcij po hirurgii (Litterra, 2008)(ru)(T)(K)(910s)(ISBN 9785982161190)
.pdfХирургическое лечение нарушений мозгового кровообращения
Развитие циркуляторных расстройств мозгового
кровообращения при патологических ИЗБИТОСТЯХ СОН
НЫХ артерий обусловлено фиброзной трансформацией стенки в зоне деформации и сужением просвета, вкли ниванием (при перегибах) в виде «гребешка» медиаль ной стенки артерии в просвет, появлением турбулент ного потока крови дистальнее извитости, способствует тромбообразованию и эмболии в сосуды головного мозга.
Причиной сосудисто-мозговой недостаточности может быть поражение брахиоцефальных артерий
неспецифическим аортоартериитом. Брахиоцефальная локализация данного заболевания встречается довольно часто— в 50—90% случаев. Примечательно, что в основном наблюдаются поражения общих сонных и подключичных артерий, при этом внутренние сонные артерии остаются почти интактными.
В 0,5—1,0% случаев причиной поражений брахио цефальных ветвей является фиброзно-мышечная дисплазия. Чаще поражается внутренняя сонная арте рия, нередко наблюдается сочетанное поражение поз воночных артерий. Стеноз развивается в результате гиперплазии субинтимальных и средних слоев с пос ледующей фиброзной трансформацией стенок. Часто наблюдается «четкообразное» чередование стенозов и расширений в виде аневризм, при образовании тромбов в которых реальна опасность эмболии в сосуды голо вного мозга.
Причиной экстравазальной компрессии брахиоце фальных ветвей могут быть расположенные в их зоне первичные и метастатические опухоли (хемодектомы, ганглиомы, нейросаркомы, лимфомы, фибромы и др.). Особое место среди них занимают хемодектомы — опу холи каротидного тельца. Впервые Malligan R.M. с соавт. в 1950 году предложили назвать эти опухоли термином «хемодектома». Особенности хемодектом заключаются
втом, что, не имея собственной капсулы, увеличиваясь
вобъеме, они в виде муфты окутывают и «замуровы вают» сонные артерии, приводя к значительным рас стройствам кровообращения. Отличает эти опухоли и возможность их малигнизации (от 2 до 50% случаев).
Фиброзно-сухожильные или костные образова ния обычно вызывают сдавление позвоночной артерии при ее высоком вхождении (на уровне С5—С6) или высо ком выходе (на уровне С7 вместо С6) из костного канала. Возможно сдавление артерии в самом костном канале. В основе сосудисто-мозговой недостаточности лежит уменьшение, а при определенных положениях головы практически полное резкое прекращение кровотока и развитие циркуляторных расстройств в вертебро-бази- лярном бассейне.
К нарушению мозгового кровообращения могут при вести спонтанно развившиеся или вызванные тупыми травмами расслоения сонных артерий, сопровождаю щиеся внутристеночными кровоизлияниями, с опасностью тромбоза и дальнейшего распространения процесса в дистальном направлении (в том числе интракраниально). Спонтанным расслоениям обычно предшествует ряд про воцирующих факторов: резкие повороты головы или раз гибания, подводное плавание, приступы надсадного кашля, позывы на рвоту, сопутствующая высокая артериальная гипертензия и др. Данную патологию не следует считать казуистичной в структуре СМН. Из-за скудности симптома тики, складывающейся в основном из головных болей, она часто остается незамеченной. Между тем распространение расслоения в интракраниальные артерии может привести к тяжелым циркуляторным расстройствам.
Течение спонтанного расслоения экстракраниальных отделов сонной артерии благоприятное: у 95% больных в течение 2—3 месяцев проходят головные боли и в те же сроки у 85% больных наступает стабилизация про цесса и регресс неврологической симптоматики. Более тяжелое течение имеют посттравматические расслое ния, хотя и здесь возможна стабилизация процесса и дальнейшее улучшение состояния больных.
Таким образом, различные по своему генезу, лока лизации, объему и характеру поражения брахиоце фальных артерий приводят к единому по сущности патологическому состоянию— нарушению мозгового кровообращения.
Патогенез сосудисто-мозговой недостаточности
Анатомо-физиологические особенности мозгового кровообращения определяют характер сосудисто-моз говой недостаточности при окклюзирующих поражени ях брахиоцефальных артерий.
Каждая из сонных и позвоночных артерий имеет «свой» бассейн кровоснабжения. В то же самое время они, анастомозируя между собой, превращают артери альное русло головного мозга в единую анатомическую систему, в которой возможен свободный переток крови из одного артериального бассейна в другой, принесение «в жертву своих интересов» при возникновении в этом необходимости, а именно, при нарушении кровообраще ния в «соседних» артериальных бассейнах. Этот процесс способствует сохранению гемодинамической стабиль ности внутримозгового кровообращения, придает ему определенную независимость от общей гемодинамики. Основным распределительным коллектором кровотока
131

Сердечно-сосудистая хирургия
является Виллизиев круг, соединяющий между собой бас сейны кровоснабжения позвоночных и сонных артерий (рис. 1). От анатомической целостности и адекватности действия образующих данный круг артериальных ветвей во многом зависят возможности коллатеральных путей в компенсации образовавшегося дефицита кровотока в том или ином участке головного мозга. При гипоплазии или отсутствии отдельных ветвей Виллизиева круга, возможности коллатеральных путей максимально быстро и адекватно купировать образовавшийся дефицит кро вотока ограничены. Между тем головной мозг человека, составляя 2% массы тела, потребляет 20% поступающего
ворганизм кислорода, и при этом не имеет «... запасов кислорода». Расходование всего резервного кислорода
вслучае прекращения его поступления завершается в течение 10—12 с. Необратимые изменения клеток коры мозга наступают при ишемии более 5 минут. При объ емном кровотоке 10,0 мл/100 г ткани в минуту нейроны погибают в течение нескольких минут. Для нормальной функции головного мозга необходим объемный кровоток 80 мл/100 гр/мин, редукция же кровотока наступает уже при суммарном стенозе магистральных артерий головы, превышающем 40%. Именно нарушения кровообраще ния и развивающиеся на этом фоне метаболические и структурные расстройства лежат в основе сосудистомозговой недостаточности.
Передняя мозговая артерия
11ередняя |
|
|
|
|
|
соединительная - JU1 |
|
Средняя мозговая |
|||
артерия |
~т\ |
|
' артерия |
||
Задняя |
|
|
|
|
|
соединительная Vi |
|
|
|
||
артерия |
)L ) |
|
|
||
Основная |
Jkr |
Н\\ |
мозговаяЗадняя |
||
у-! |
|
|
\\ |
артерия |
|
артерия |
' |
|
|
||
|
|
|
|
||
|
\ |
|
\7/ |
Внутренняя |
|
Потяоночная у1(4У/ |
сонная аргерия |
||||
артерия |
// |
|
п |
|
|
|
д\ \ |
//'/JL |
|||
Аорта) у///
s
/
1гнс. I. Схематическое изображение Виллизиева круга
Нарушение кровоснабжения головного мозга проис ходит либо в результате постепенно нарастающих гемодинамических расстройств на фоне прогрессирующих окклюзирующих процессов и наличии определенных
анатомо-функциональных составляющих (множествен ные поражения, сочетанные поражения интракраниальных отрезков артерий, разомкнутость Виллизиева круга), либо же резко — в результате эмболии в сосуды головного мозга частицами дезорганизованных атеросклеротических бляшек или тромботическими массами.
Степень адекватности и сроки купирования развив шейся недостаточности кровотока зависят от объема зоны поражения, компенсаторных ауторегуляторных возможностей мозгового кровообращения. Эти фак торы и определяют течение и последствия окклюзи рующих поражений брахиоцефальных ветвей аорты. Асимптомное течение или быстрый и полный регресс симптомов свидетельствуют о хороших компенсаторных возможностях коллатеральных путей кровообращения.
Клинические проявления
Клиническая манифестация поражения брахиоце фальных артерий свидетельствует о срыве компенса торных возможностей. Появляющаяся симптоматика складывается из общемозговых и очаговых невроло гических симптомов и офтальмологических наруше ний. Общемозговая симптоматика — это когнитивные нарушения в виде снижения памяти, работоспособнос ти, способности абстрагирования, объема восприятия, закрепления информации быстрой истощаемости. Генез общемозговых симптомов окончательно не установлен. По всей вероятности они являются результатом компен саторно измененных скоростных показателей мозгово го кровотока, приводящих к ряду нейротрофического характера метаболических расстройств.
Очаговая неврологическая симптоматика является отражением нарушения кровоснабжения определен ных отделов головного мозга. Обычно она развивается внезапно, без каких-либо настораживающих явлений. Продолжительность и темпы обратного развития очаго вой симптоматики характеризуют тяжесть и компенса торные возможности мозгового кровообращения. При купировании их в сроки до 24 часов развившиеся наруше ния характеризуются как преходящие или транзиторные ишемические атаки (ТИА). Сохранение неврологического дефицита более 24 часов указывает на развитие ишемического инсульта. ТИА в каротидном бассейне проявляет ся афазией, кратковременной потерей зрения (amavrosis fugax), чувствительно-двигательными нарушениями в конечностях и/или лице. Для ТИА вертебробазилярного бассейна характерны головокружения, нарушения равно весия, неуклюжесть ходьбы, парестезии.
Чем дольше сохраняются очаговые симптомы и чем чаще они повторяются, тем неблагоприятнее прогноз
132

Хирургическое лечение нарушений мозгового кровообращения
ТИА. Подобное течение следует расценивать как пред вестник острого нарушения мозгового кровообраще ния. Однако развитие ишемического инсульта — новой стадии сосудисто-мозговой недостаточности — может быть и неожиданным. Начало инсульта может быть острым — с тяжелыми общемозговыми симптомами в виде сильных головных болей, тошноты, рвоты, угнете ния сознания, порой до полной его потери. Подобное начало характерно для эмбологенного генеза инсульта. Более «спокойное» начало, без каких-либо общемозго вых симптомов характерно для инсультов, развившихся на фоне постепенно нарастающих гемодинамических расстройств мозгового кровообращения.
Через 1—2 дня общемозговые симптомы отходят на второй план. На первый план выходит очаговая симп томатика, соответствующая локализации развивающе гося инфаркта головного мозга. Течение ишемического инсульта определяют зона и размер очага поражения и компенсаторные возможности коллатеральных путей кровообращения. При полном регрессе неврологическо го дефицита в течение 3 недель (21 день) принято гово рить о малом инсульте. При сохранении его на более дли тельные сроки — о стойком или завершенном инсульте. Образовавшийся дефицит может быть различной степе ни выраженности в зависимости от объема развившихся деструктивных изменений головного мозга.
Диагностика
Поражения брахиоцефальных ветвей устанавлива ют на основании физикальных и комплекса инструмен тальных методов исследований (ультразвуковые, ком пьютерная томография, ядерно-магнитная томография и ангиография, субтракционная дигитальная ангиогра фия, рентгеноконтрастная ангиография).
Физикальные методы лишь констатируют наличие поражения (ослабление или отсутствие пульсации, сис толический шум над проекцией сонных, позвоночных, подключичных артерий, градиент давления более 20 мм рт. ст. между верхними конечностями).
Основными методами диагностики поражений бра хиоцефальных ветвей и сосудисто-мозговой недоста точности служат ультразвуковые (УЗ) методы исследова-
Iния. Ультразвуковой допплерографией (УЗДГ) определяя наличие кровотока, его 'характер и направление, уже можно констатировать наличие поражения. Дуплексное
| |
сканирование с цветным |
картированием (триплексное |
< |
сканирование) позволяет |
определить сосудистую гео- |
Рис. 2. Дуплексное сканирование сонных артерий. Гетерогенная атеросклеротическая бляшка с неровной поверхностью
степень стеноза по площади, объемные и скоростные показатели кровотока в реальном режиме времени и в большинстве случаев установить этиологию пораже ния. УЗ-методы исследования позволяют определить компенсаторные возможности коллатеральных путей кровотока и степень толерантности головного мозга к ишемии. Исследование проводят компрессионной про бой Матаса (4- минутное пережатие общей сонной арте рии) с изучением неврологического статуса больного, скоростных показателей кровотока по средней мозговой артерии транскраниальной допплерографией (ТКДГ) и данных реоэнцефалографии. Развитие неврологической симптоматики в виде сонливости и заторможенности, снижение ЛСК более 75% от исходных показателей, замедление и снижение альфа-ритма на реоэнцефалограмме свидетельствует об отсутствии толерантности больного к пережатию сонной артерии.
УЗ-методы незаменимы в определении эмбологенности атеросклеротических бляшек, в выявлении внутрибляшечных кровоизлияний, изъязвлений и тромбообразования. Дуплексное сканирование позволяет определить также объемные показатели обкрадывания мозгового кровотока при окклюзиях I сегмента подклю чичной артерии и брахиоцефального ствола.
Диагностические возможности УЗ-методов ограни чены при проксимальных (интраторакальных) локали зациях поражений, ряде анатомических аномалий раз вития позвоночных артерий, а также при высоких лока лизациях патологических извитостей сонных артерий. Подобные случаи являются показанием для проведения рентгеноконтрастной ангиографии. При этом по воз
,метрию, диаметры артерий, состояние стенок и внут можности предпочтение отдается малотравматичной
ренней поверхности, уровень, локализацию, характер и |
методике дигитальной субтракционной ангиографии, |
распространенность окклюзирующего процесса (рис. 2), |
либо же ядерно-магнитнорезонансной ангиографии. |
I
133
Сердечно-сосудистая хирургия
Нейровизуализирующие методы исследования —> компьютерная томография (КТ) и ядерно-магнитная томография (МРТ) — позволяют получить информацию о структурных нарушениях головного мозга, о локали зации и объеме ишемического очага. Проведение их особенно необходимо у перенесших инсульт больных для предотвращения ряда послеоперационных ослож нений и прогнозирования результатов хирургической коррекции мозгового кровотока.
Чувствительность и информативность современных методов исследования позволяют не только установить диагноз сосудисто-мозговой недостаточности, но и опти мально решить вопрос о тактике лечения поражений брахиоцефальных артерий, в частности, вопрос о показа нии к операции и методе хирургической коррекции.
Показания к операции
Хирургическое лечение направлено на предотвра щение последствий окклюзирующих поражений бра хиоцефальных артерий. Именно поэтому при решении вопроса об операции следует исходить как из значи мости сосуда в кровоснабжении головного мозга, так и учитывать наличие условий, способствующих развитию расстройств мозгового кровообращения и, в первую очередь, острых нарушений мозгового кровообраще ния. Подобный подход позволит оптимально решить вопрос о показании к операции для каждой магистраль ной артерии головы.
При атеросклеротических окклюзирующих пора жениях внутренней сонной артерии показанием к операции являются:
шгемодинамически значимый стеноз (более 70%) независимо от клинического течения;
шэмбологенная бляшка, стенозирующая просвет артерии более 50% и клинически проявляющаяся хотя бы одним эпизодом транзиторной ишемической атаки.
Противопоказанием к каротидной эндартерэктомии (КЭАЭ) являются:
• неизвестность сроков от начала инсульта и перене сенный инсульт менее, чем б-недельной давности;
•выраженный неврологический дефицит после перенесенного инсульта;
•заболевания центральной нервной системы с пос тоянным неврологическим дефицитом;
•опухоли головного мозга;
•аневризмы и артерио-венозные мальформации интракраниальных артерий.
При наличии больших кист (более 3,0 см в диаметре) КЭАЭ должна быть выполнена и направлена на предо
твращение повторных инсультов. Однако КТ-исследо- ванием должно быть констатировано завершение про цесса формирования кисты, ограничение ее плотной капсулой, исключающей риск кровоизлияний в нее в условиях повышенной перфузии. Воздержаться от КЗАЭ следует при выраженной дыхательной и тяжелой сер дечной недостаточности.
При патологических деформациях ВСА операция показана при симптомном течении извитостей, а при асимптомном течении — наличие гемодинамических расстройств, соразмерных с нарушениями, наблюда емыми при критических стенозах внутренней сонной артерии атеросклеротического или другого генеза. По данным УЗ методов исследования, этому сопутствует повышение пиковой систолической частоты более 8 Khz и скорости кровотока более 250 см\с. У детей и подрос тков с С- и S-образными ИЗБИТОСТЯМИ показана выжида тельная тактика с учетом их роста и параллельно с этим возможности выпрямления сонной артерии.
Хирургическая коррекция показана при гемоди намически значимом стенозе и симптомном течении поражения внутренней сонной артерии фибромышечной дисплазией. При критическом стенозе и окклюзиях общей сонной артерии операция показана независимо от их течения.
При поражении позвоночных артерий операция показана при наличии симптомов вертебробазилярной недостаточности. Обычно это наблюдается при: 1) двус торонних гемодинамически значимых поражениях поз воночных артерий, 2) гипоплазии одной и гемодинами чески значимом стенозе второй доминантной артерии, 3) разомкнутом Виллизиевом круге и поражении доми нантной позвоночной артерии.
Вопрос тактики лечения окклюзии I сегмента под ключичной артерии следует решать с учетом клиничес кого течения и размеров обкрадывания мозгового крово тока. Операция показана при симптомном течении пора жения (брахиальной ишемией или сосудисто-мозговой недостаточности) или при наличии исходно большого объема обкрадывания (более 150 мл\мин) и увеличении его на фоне физических нагрузок более чем в 2 раза.
При поражении брахиоцефального ствола операция показана как при критическом стенозе, так и его окклю зии, независимо от характера течения. При наличии требующего хирургического лечения поражений брахио цефальных ветвей у больных с ишемической болезнью сердца, с аневризмой брюшной аорты, с окклюзирующими поражениями артерий нижних конечностей прави лом является тактика поэтапных операций с первичной коррекцией мозгового кровотока. Однако при крити ческих ситуациях подобная тактика не оправдана ввиду
134
Хирургическое лечение нарушений мозгового кровообращения
*повышенного риска развития постоперационных ослож
нений в бассейнах реконструированных магистралей. У больных со стенокардией 4-го функционального клас са, с нестабильной стенокардией, с поражением ствола коронарной артерии, целесообразно сочетать коррекцию мозгового кровотока с одномоментной реваскуляризацией миокарда. Подобной тактики следует придерживаться при болевых формах аневризм брюшной аорты или кри тической ишемии нижних конечностей.
Методы хирургического лечения
Выбор метода операции определяется этиологией, локализацией и характером окклюзирующего процесса.
Каротидная эндартерэктомия является методом выбора при атеросклеротическом окклюзирующем поражении внутренней сонной артерии. Операцию выполняют под общим обезболиванием в положении больного на спине через продольный разрез по внутренней поверхности кивательной мышцы. Деликатно, без грубых манипуляций выделяют сонные артерии, определяют протяженность окклюзирующего процесса во внутренней сонной арте рии. Независимо от исходных показателей толерант ности головного мозга к ишемии созданием умеренной гипертензии (20—30 мм рт. ст. выше исходного уровня), введением антигипоксантов и стабилизаторов клеточных мембран проводят защиту головного мозга от ишемии. Эффективность проводимых мероприятий проверяют определением линейной скорости кровотока по средней мозговой артерии (транскраниальной допплерографией) или ретроградного давления во внутренней сонной артерии (пункцией общей сонной артерии проксимальнее пораженного участка). Оба показателя определяют после непосредственного пережатия общей сонной артерии и в течение 20—30 секунд наблюдая за их динамикой. Линейная скорость кровотока больше 20 см/с или ретрог радное давление выше 50 мм рт. ст (или индекса ретрог радного давления 0,4/ по мнению А.В. Покровского) ука зывают на достаточную толерантность головного мозга к ишемии и возможность выполнения операции без при менения дополнительных мер защиты. При более низких показателях необходимо применение внутрипросветного шунта и производство операции в условиях восстанов ленного магистрального кровотока. Шунт должен быть введен очень осторожно, через интактные участки сонных артерий, во избежание эмболии, расслоений внутренней сонной артерии. Определением скорости кровотока по СМА с помощью ТКД проверяют адекватность функциони рования шунта.
Некоторые авторы (в частности? Imparato А. в США) предпочитают выполнить КЭАЭ под местной инфильтра- тивно-проводниковой анестезией, дающей возможность постоянного общения с больным и наглядной оценки защиты головного мозга. Однако следует отметить, что местное обезболивание является немалой психоэмоци ональной нагрузкой для больного, фактором риска для кардиальных осложнений, создает определенную напря женную обстановку при возникновении необходимости перехода на общее обезболивание и применения внут реннего шунта. Между тем само по себе общее обезбо ливание является улучшающим толерантность головного мозга мероприятием. Оно создает и более благоприятные условия при возникновении необходимости в применении внутреннего шунта — позволяет ввести шунт без спешки и лишнего напряжения. Поэтому местное обезболивание должно иметь узкие показания при КЭАЭ, в частности, при обструктивных заболеваниях легких с тяжелой дыхатель ной недостаточностью, анатомических аномалиях шеи и верхних дыхательных путей, являющихся высоким риском, а порой и противопоказанием для наркоза. Безусловно, шунт создает определенные технические трудности, поэ тому он должен быть применен строго по показани ям — при несостоятельности других методов в обеспе чении адекватной защиты головного мозга. Убедившись в адекватной защите приступают к дальнейшим этапам операции. Эндартерэктомию производят двумя методами: стандартным (или «классическим») и эверсионным.
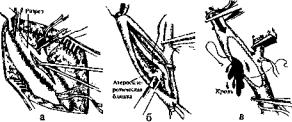
Стандартную методику КЭАЭ (рис. 3) выполняют из продольной артериотомии и, как правило, завершают пластикой ВСА, вшивая в артериотомическое отверстие заплату из аутовены или синтетического материала (обычно из политетрафторэтилена). В качестве шовного материала используют нити б/О или 7/0 из полипропи лена. Вшивание начинают с дистального конца артериотомического разреза. Выполнение эндартерэктомии без
Рис. 3. Схематическое изображение этапов стандартной методики каротндной эндартерэктомии: а — пережатие сон ных артерий, продольный разрез ОСА с переходом на ВСА; б - выполнение эндартерэктомии; в - пуском крови вымыва ются тромботические массы
135

Сердечно-сосудистая хирургия
пластики ВСА допустимо лишь при устьевых поражени ях (протяженностью не более 10 мм) и диаметре ВСА не менее б мм. Перед наложением последних 3—4 швов, проводят пробный пуск кровотока из сонных артерий с целью удаления материальных эмболов.
Эверсионнаяэндартерэктомия,предложеннаяК. Kieny в 1984 году, заключается в иссечении ВСА в устье, выво рачивании ее в дистальном направлении и, после удале ния атеросклеротических бляшек, реимплантации ее в старое устье (рис. 4). Облегчает выворачивание и эндартерэктомию рассечение на протяжении 0,5—0,6 см внут ренней стенки ВСА. Преимуществами данной методики является сохранение неизмененной ангиоархитектоники сонных артерий и восстановление адекватного кровото ка по ВСА без дополнительной пластики. В совокупности эти два фактора практически исключают возникновение турбуленции кровотока по реконструированной ВСА, уменьшая тем самым риск развития миоинтимальной гиперплазии и рестенозов в отдаленные сроки опера ции. Выполнение данной методики целесообразно при толерантности головного мозга к ишемии и отсутствии протяженного (более 3,0 см) характера поражения.
При распространении окклюзирующего процесса по ВСА более 3,0 см коррекцию кровотока лучше производить методом резекции и протезирования, используя в качестве трансплантата большую подкожную вену или синтетические протезы диаметром б мм (обычно из политетрафторэти лена). В подобных ситуациях выворачивание ВСА на ожи даемом расстоянии не всегда представляется возможным, выполнение же эндартерэктомии «вслепую» недопустимо. Нецелесообразна и «классическая» методика — большие заплаты не создают оптимальные функциональные условия, повышают риск развития поздних рестенозов и окклюзии.
При протезировании ВСА у нетолерантных больных на внутренний шунт «надевают» аутовену, проводят продольную артериотомию и шунт вводят в сонные артерии. Последующие этапы выполняют в условиях
восстановленного кровотока. Шунт не создает особых трудностей при наложении анастомозов.
Эндартерэктомия и коррекция кровотока по наруж ной сонной артерии (НСА) показаны при окклюзии ипсилатеральной ВСА, разомкнутости Виллизиева круга и наличии ретроградного кровотока по надблоковой артерии преимущественно из противоположной НСА. Операция направлена на улучшение мозгового кровотока через глазничный анастомоз. Реконструкцию производят методом аутоартериальной пластики, используя выкро енную в виде «язычка» внутреннюю сонную артерию.
В условиях двусторонних гемодинамически значи мых стенозов ВСА первым восстанавливают кровоток на стороне более значимого поражения. При однозначных по степени стенозах первым реконструируют артерию, на сторону которой направлен кровоток по передней соединительной артерии.
Выбор метода хирургической коррекции патологи ческих деформаций ВСА определяют протяженность деформации, степень фиброзно-склеротической транс формации стенок, размеры ВСА вне зоны поражения. При отсутствии выраженных фиброзных изменений и достаточном диаметре ВСА гемодинамически и функци онально наиболее оптимальна реконструкция методом резекции избытка с редрессацией и реимплантацией ВСА в старое устье (рис. 5).
При протяженной фиброзной трансформации, недо статочном диаметре артерии, наличии аневризм или истончении стенок вне зоны извитости показана резек ция внутренней сонной артерии с протезированием. В качестве пластического материала используют боль шую подкожную вену или протезы из ПТФЭ. При большой протяженности фиброзной трансформации и наличии возможности сопоставления, без натяжения прокси мального и дистального отрезков артерии, кровоток может быть восстановлен резекцией извитости и нало жением анастомоза по типу «конец в конец» (рис. 6).
Внугреннв# сонная артерия
РИС. 4. Схематическое изображение зверском и он методики каротидной энлартерэктомнн: а — продольно рассечена ВСА и ОСА. ВСА но медиальной стенке продольно рассекается; б — эверсия ВСА; и — удаление атеросклеротнческсп бляшки: г - ВСА имплантируется в старое устье. Ушита задняя губа анастомоза
136

Хирургическое лечение нарушений мозгового кровообращения
Рнс. 5. Схема операции резекции патологической деформации внутренней сонной артерии с редрессацией и реимплантацией в старое устье: а — этап выделения сонных артерии; б — резекция патологической извитости; в — внутренняя сонная артерия после резекции имплантируется в старое устье; г — схематическое изображение операции
Рнс. 6. Схема операции резекции патологической извитости ВСА с протезированием
Вусловиях сочетания патологической деформации
сатеросклеротическим стенозом ВСА резекцию изви тости сочетают с эндартерэктомией. При этом удаление бляшки из оставшейся после резекции ВСА производят описанным выше методом эверсии.
При фибромышечной дисплазии внутренней сонной артерии, с учетом, как правило, пролонгированного характера поражения, методом выбора служит резек ция с протезированием.
Если отсутствуют условия для реконструкции экстракраниальных отделов ВСА, улучшить мозговой кровоток можно путем операции экстра-интракрани- ального микроанастомоза (ЭИКМА), непосредственно соединяя между собой экстра- и интракраниальные бассейны кровообращения. В качестве донора обычно используется поверхностная височная артерия (a. tem poralis superfacialis), а реципиента — средняя мозговая
артерия и ее ветви. О первой операции подобного анас томоза сообщили R. Donaghy и M.G. Yasargil (1967).
Для оптимального решения вопроса о показаниях к операции необходимо изучение церебрального перфузионного резерва (позитронно-эмиссионной томографией, компьютерной томографией на фоне вдыхания кислоро да и др.). Значительное нарушение церебрального перфузионного резерва является прогностически благопри ятным показателем эффективности операции ЭИКМА.
Показанием к операции ЭИКМА являются: окклюзия ВСА в сочетании со стенозами ее интракраниальных ветвей при разомкнутости Виллизиева круга; гемодинамически значимый стеноз одной и окклюзия проти воположной ВСА при анатомической разомкнутости и функциональной неполноценности Виллизиева круга. ЭИКМА производят как первый этап перед КЭАЭ из про тивоположной ВСА.
В случаях спонтанного или другого генеза рассло ения ВСА лечение следует начать с консервативной терапии в течение 2 недель антикоагулянтами прямого действия (гепарин, низкомолекулярные гепарины) с переходом на прием в течение 3—6 месяцев дезагрегантов (клопидогрель, тиклопидин, аспирин). При неэффективности консервативных мероприятий и прогрессировании процесса с угрозой перехода его на интракраниальные сегменты показано хирургическое лечение. При наличии возможности ликвидации рас слоения методом выбора является резекция с проте зированием. При распространении расслоения в инт ракраниальные отделы показано лигирование ВСА, а при функциональной неполноценности Виллизиева круга — выполнение ЭИКМА.
137

Сердечно-сосудистая хирургия
При поражении брахиоцефального ствола объем операции зависит от характера и распространенности окклюзирующего процесса. При окклюзии брахиоце фального ствола методом выбора является резекция с протезированием. Линейное протезирование показано при ограничении поражения стволом. При распростра нении окклюзирующего процесса на правую подклю чичную и правую общую сонную артерии выполнение эндартерэктомии допустимо лишь при ограничении поражения их устьями. В условиях распространенного окклюзирующего процесса выполнение эндартерэкто мии является грубой технической ошибкой. В подобных случаях необходимо произвести раздельное протези рование с использованием бифуркационных протезов с диаметром основной бранши 16 мм.
При стенозе бифуркации общей сонной или ВСА производится одномоментное протезирование брахио цефального ствола и эндартерэктомия из бифурка ции сонной артерии: после наложения проксимального анастомоза с аортой производится протезирование и пуск кровотока по правой подключичной артерии. Бифуркация общей сонной артерии выделяется из отдельного разреза на шее. Производится эндар терэктомия по одной из вышеприведенных методик. Анастомоз с общей сонной артерией накладывается по типу «конец в конец» (при необходимости боковой пластики ВСА край бранши соответственно выкраива ется) (рис. 7).
В случае окклюзии левой общей сонной артерии показано одномоментное протезирование брахио цефального ствола и левой общей сонной артерии. Технически упрощает операцию предварительное вши вание в выкроенное на медиальной поверхности проте за окно для брахиоцефального ствола дополнительного протеза диаметром 8 мм для сонной артерии. Левая
общая сонная артерия обнажается отдельным разрезом на шее.
При изолированных окклюзиях или гемодинамически значимых протяженных поражениях общих сон ных артерий коррекцию кровотока производят мето дом подключично-сонного шунтирования, используя в качестве донора ипсилатеральную подключичную артерию (рис. 8). Отдельными разрезами (по медиаль ному краю кивательной мышцы и параллельно ключице
ина 1,0—1,5 см выше нее) обнажают общую сонную и II сегмент подключичной артерии. В верхнюю поверх ность подключичной артерии вшивают протез из ПТФЭ диметром 8 мм. Общую сонную артерию пересекают на 1,5—2,0 см проксимальнее бифуркации, протез из-под внутренней яремной вены подводят к общей сонной артерии и по типу «конец в конец» с ней анастомозируют.
Проведение протеза над яремной веной недо пустимо ввиду возможной ее компрессии.
В условиях окклюзии I сегмента подключичной артерии операцией выбора считается транспозиция ее в ОСА, позволяющая восстановить антеградный кровоток по позвоночной и подключичной артериям без исполь зования пластического материала (рис. 9). Операцию выполняют из поперечного надключичного доступа с пересечением наружной ножки кивательной мышцы. Подключичную артерию выделяют на 1,5—2,0 см прок симальнее позвоночной артерии. В медиальном углу раны пальпацией определяют локализацию ОСА, выде ляют ее, берут на держалку и из-под внутренней яремной вены выводят в рану надключичной области. После системной гепаринизации подключичную арте рию пересекают на 1,0—1,5 см проксимальнее устья позвоночной артерии, культю лигируют с обязатель ным прошиванием. После проведения мероприятий по
Рис. 7. Схема операции резекции брахиоцефального ствола г протезированием: а - резекция брахиоцефального ствола с: линейным аллопротезнроиаинем: б — резекция брахиоцефалыютстнолаг бифуркационным протезированием npaiioii подключичной и обшей сонной артерий
Рис. 8. Схема операции подключично-сонного шунтиро вания: а — выделены левая подключичная и общая сонная артерии; б — конечный этап операции
138

Хирургическое лечение нарушений мозгового кровообращения
Г
Внутр«иии
•ргсрм*
Рис. 9. Схема операции резекции I сегмента подключичной артерии с транспозицией се в ОСА: а — из-под яремной вены выведена ОСА. В наружно-боковую стенку ОСА вшивается левая подключичная артерия; б — подключичная артерия имп лантирована в ОСА
защите головного мозга от ишемии на наружной повер хности общей сонной артерии, максимально близко к подключичной артерии, выкраивают овальной формы отверстие длиной 10—12 мм, куда имплантируют ПКА. При наложении анастомоза, край подключичной арте рии необходимо адаптировать таким образом, чтобы позвоночная артерия принимала нормальное для своей анатомии расположение — верхняя поверхность под ключичной артерии. Заднюю губу анастомоза ушивают «на расстоянии». Если подведение подключичной арте рии к общей сонной вызывает заметное натяжение, что грозит прорезыванием швов анастомоза, то устраняется эта опасность путем вшивания между общей сонной и подключичной артериями вставки из аутовены или син тетического протеза диаметром 8 мм.
Операция транспозиции подключичной артерии в ОСА приводит к определенному обкрадыванию кровото ка из общей сонной артерии (приблизительно на 15%). Однако благодаря восстановлению антеградного крово тока по позвоночной артерии суммарный гемисферный кровоток увеличивается почти в 1,25 раза (с 445 мл/мин до 554 мл/мин).
Следует подчеркнуть, что не всегда легко удает ся выделение проксимальных отрезков подключич ной артерии, особенно у лиц повышенного питания. Отсутствие необходимых условий для безопасной рабо ты в этой «нежной и ранимой» области, где расположе ны лимфатические сосуды и коллекторы, «обхватываю щий» подключичную артерию возвратный нерв, грозит повреждением указанных образований. В подобных ситуациях операцией выбора должно быть сонно-под ключичное шунтирование: из надключичного доступа выделяются общая сонная и подключичная артерии во II сегменте. В выкроенное на наружной поверхности
ОСА отверстие вшивается надставка из синтетического материала диаметром 8 мм. Другой конец протеза изпод яремной вены проводится к подключичной артерии и вшивается в выкроенное на ее верхней оконечности отверстие. Таким образом, кровоток по подключичной артерии восстанавливается без выделения ее I сегмен та, что является безусловным преимуществом метода.
При наличии сочетанного поражения ипсилатеральной сонной артерии реконструкцию подключич ной артерии производят после коррекции кровотока в каротидном бассейне и создания условий для безо пасного пережатия ОСА и использования ее в качестве донорской артерии.
В условиях гемодинамически значимого стеноза про тивоположной внутренней сонной артерии первым эта пом производят ее реконструкцию, затем вторым этапом коррекцию кровотока по подключичной артерии.
Если использовать в качестве донора ипсилатеральную общую сонную артерию невозможно (из-за гемоди намически значимого стеноза или окклюзии), кровоток по подключичной артерии можно восстановить путем перекрестного сонно-подключичного или подключич- но-подключичного шунтирования. При сонно-подклю чичном шунтировании выделяют во II сегменте подклю чичную артерию и противоположную ОСА. По медиаль ной полукружности последней выкраивают отверстие, куда вшивают трансплантат (большая подкожная вена с бедра). На этом этапе необходимо проведение мероп риятий по защите головного мозга от ишемии. Затем трансплантат подкожно выводят в подключичную рану и вшивают в выкроенное на верхней стенке подключич ной артерии отверстие.
При подключично-подключичном перекрестном шунтировании поперечными подключичными доступа ми артерии выделяют на месте их перехода в подмы шечные. Первым накладывают анастомоз с «донорс кой» подключичной артерией, вшивая в выкроенное на передней ее поверхности отверстие протез (обычно из ПТФЭ) диаметром 8 мм. Затем его п/к перед грудиной выводят в рану на противоположной стороне и вшивают в сформированное на передней поверхности реципиентной подключичной артерии аналогичное отверстие.
Следует подчеркнуть, что пересекающие шею или грудину шунты — большое препятствие для производс тва продольной стернотомии. Поэтому, если на заре развития хирургии окклюзии I сегмента подключич ной артерии они рассматривались как малотравматич ные экстраторакальные методы коррекции кровотока, то в настоящее время они должны рассматриваться как вынужденные вмешательства, выполняемые при отсутс твии условий для производства других видов операций.
139

Сердечно-сосудистая хирургия
При окклюзирующих поражениях позвоночных артерий операция направлена на: 1) предотвращение эмболии в сосуды головного мозга; 2) коррекцию кро вотока в вертебро-базилярном бассейне; 3) улучшение мозгового кровотока при множественных поражениях магистральных артерий головы, в частности, при нали чии окклюзии внутренних сонных артерий.
Реконструктивные вмешательства выполняются на I (от устья до входа в костный канал) и III (от уровня выхода из костного канала до входа в череп) сегмен тах артерии. Следует учесть, что на основании лишь УЗ-методов исследования не всегда представляется возможным установление этиологии поражений позво ночных артерий и решение вопроса тактики их лечения. Для оптимального решения этого вопроса, в частности о показаниях к операции, потребуется выполнение, как минимум, ядерно-магнитно-резонансной,а порой и рентгеноконтрастной ангиографии (рис. 10).
Арсенал реконструктивных вмешательств, применя емых при наличии поражения I сегмента позвоночной артерии, достаточно широк. Выбор метода операции определяют этиология, локализация, протяженность окклюзирующего процесса и состояние подключич ной артерии. При атеросклеротическом поражении и локализации процесса лишь в устье и проксимальном отрезке артерии (не более 1,0 см) и относительной интактности подключичной артерии целесообразнее произвести трансподключичную эндартерэктомию через окаймляющий устье позвоночной артерии разрез. После дезоблитерации артериотомический разрез уши вают непрерывным обвивным швом полипропиленовой нитью 6/0 или 7/0.
Рис. 10. Ядсрио-магнитно-регюнансная ангиография. Патологические ианитости внутренних сонных артерии
При распространении поражения на более дистальные отрезки I сегмента (но не более 1,5 см) поз воночную артерию иссекают у устья, методом эверсии производят эндартерэктомию и при интактности в этой зоне подключичной артерии имплантируют ее в старое устье или во вновь сформированное отверстие в подключичной артерии (обычно на 1,0—1,5 см дистальнее прежнего устья). При возникновении натяже ния и угрозы прорезывания швов, между позвоночной и подключичной артериями вшивают аутовенозную вставку (большая подкожная вена). Недостатком дан ного метода являются наложение двух анастомозов и возможность перегиба после операции венозного шунта. Поэтому при подобных поражениях предпоч тительнее производить эндартерэктомию через про дольный разрез позвоночной артерии с последующей боковой ее пластикой заплатой из аутовены или синте тического материала. Разрез следует начать с верхней трети передней поверхности подключичной артерии во избежание возможности перегибов позвоночной артерии и для адекватного расширения ее устья. В случае поражения прилегающих сегментов подклю чичной артерии, а также окклюзии ипсилатеральной ВСА, целесообразнее имплантировать позвоночную артерию в выкраиваемое на задней полуокружности общей сонной артерии отверстие (рис. 11).
Реконструкцию III сегмента позвоночной артерии производят при поражении первых двух сегментов, либо при экстравазальной компрессии ее костно-связочными образованиями при входе или выходе из костного канала.
Для подхода и мобилизации III |
сегмента чаще исполь |
||||
зуют |
передний доступ, поз |
|
|
||
воляющий выделять артерию |
|
|
|||
между Cj и С2 — от вершины |
|
|
|||
С2 до атланто-окципитальной |
|
|
|||
мембраны. На этом отрезке |
|
|
|||
артерия |
имеет достаточную |
|
|
||
длину и диаметр (2—2,5 мм) |
|
|
|||
для |
выполнения реконструк |
|
|
||
тивных |
вмешательств. Корре |
|
|
||
кцию кровотока производят |
|
|
|||
либо транспозицией затылоч |
|
|
|||
ной |
артерии в позвоночную, |
|
|
||
либо |
|
сонно-позвоночным |
|
|
|
шунтированием, используя в |
|
|
|||
качестве донорской — общую |
|
|
|||
сонную артерию. При опера |
|
|
|||
ции |
транспозиции затылоч |
Рнс. 11. Схема операции |
|||
ную артерию по типу «конец |
резекции |
позвоночной |
|||
в бок» вшивают в выкроенное |
артерии с |
реи.м планта |
|||
цией ее в общую тонну10 |
|||||
на передней стенке позвоноч- |
|||||
артерию |
|
||||
140
