
хирургия 5 курс / книги / Savel'ev V.S. (red.) 80 lekcij po hirurgii (Litterra, 2008)(ru)(T)(K)(910s)(ISBN 9785982161190)
.pdfПортальная гипертензип
присоединенный к нему проволочный рычаг, на вену надевают эластичное кольцо. Процесс повторяют, пока не будут лигированы все варикозно-расширенные вены. На каждую из них накладывают от 1 до 3 колец. Метод несложен и дает меньше осложнений, чем склеротерапия, хотя для лигирования варикозно-расширенных вен при этом требуется больше сеансов. Наиболее частое ослож нение— преходящая дисфагия; описано также развитие бактериемии. Дополнительный зонд может вызывать перфорацию пищевода. 8 местах наложения колец впо следствии могут развиться язвы. Кольца иногда соскаль зывают, вызывая массивное кровотечение.
Лигирование с помощью колец позволяет останавли вать острое кровотечение из варикозно-расширенных вен пищевода не менее эффективно, чем склеротерапия, однако его сложнее производить в условиях продолжающегося кровотечения. Оно предотвращает повторные эпизоды кро вотечения, но не влияет на выживаемость. Этот метод может заменить в целом более доступную эндоскопическую склеротерапию лишь в специализированных центрах.
Экстренные хирургические вмешательства.
С внедрением склеротерапии, вазоактивных препаратов, баллонной тампонады и особенно ТВПШ к хирургическим вмешательствам прибегаютзначительно реже. Показанием к ним в основном является неэффективность всех пере численных методов лечения. Кровотечение можно эффек тивно остановить с помощью экстренного портокавального шунтирования. Летальность, а также частота развития энцефалопатии в послеоперационном периоде значитель ны среди больных группы С. Если кровотечение массивное и рецидивирует после 2 процедур склеротерапии, методом выбора является ТВПШ. Альтернативные методы лече ния— экстренное формирование мезентерикокавального анастомоза, или наложение узкого (8 мм) портокавального шунта, или пересечение пищевода.
Экстренное пересечение пищевода с помощью сшивающего аппарата. Под общим обезболиванием производят переднюю гастротомию и вводят аппарат в нижнюю треть пищевода. Непосредственно выше кардии накладывают лигатуру, которая втягивает стен ку пищевода между головкой и телом аппарата. Затем прошивают и пересекают стенку пищевода. Аппарат с иссеченной стенкой пищевода извлекают. Рану желудка и передней брюшной стенки ушивают. Пересечение
пищевода с помощью аппарата всегда позволяет остановить кровотечение. Однако треть больных уми рают в период госпитализации от печеночной недоста точности. Операция не показана в профилактических целях или в плановом порядке. В течение 2 лет после операции варикозное расширение вен обычно рециди вирует и часто осложняется кровотечением.
Борьба с асцитом. В хирургический стационар больные циррозом печени с портальной гипертензией поступают с тяжелыми осложнениями, в большей части после безуспешного консервативного лечения. Одним из таких осложнений является асцит, который появляется на поздней стадии заболевания в 85% случаев. Асцит входит в триаду признаков портальной гипертензии. Появление асцита при относительно ста ционарной форме цирроза обычно рассматривается как перелом, как момент, указывающий на ухудшение состояния больного и на прогрессирование процесса. Значительная часть (42—73%) больных с асцитом поги бают в течение первого года, и лишь 20% живут более 2-х лет. Средняя продолжительность жизни у этих боль ных составляет от 5 месяцев до 3 лет.
Послеоперационная летальность у больных с асци том при сосудистых анастомозах достигает 52%. Единой тактики хирургического лечения больных циррозом печени с асцитом еще не выработано. Применяются операции, иногда диаметрально противоположные по механизму действия.
С целью коррекции гипопротеинемии у больных циррозом печени, осложненным асцитом, использует ся донорская плазма, белковые препараты: альбумин, альвезин, гидролизин и др. Использование донорской плазмы часто вызывает у этих больных аллергические и пирогенные реакции, повышает риск заражения ВИЧ, вирусами «В» и «С» и т.д. Риск инфицировать больного вирусом гепатита «В» составляет 1: 20000 переливаний донорской плазмы, гепатитом «С» — 1: 3300 перелива ний, ВИЧ — 1: 225 000 переливаний. Использование же альбумина, альвезина и подобных белковых препаратов не всегда доступно, т.к. этим ослабленным и истощен ным больным требуются многократные периодические вливания этих препаратов.
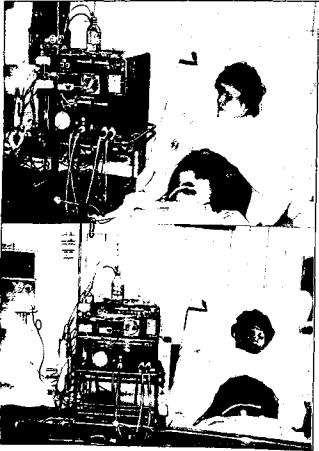
В асцитической жидкости (АЖ) содержится значи тельное количество белка плазмы (от 10 до 32 г/л), ами нокислоты, электролиты, гормоны, ферменты, витамины. Реинфузия АЖ позволяет стабилизировать состояние этих больных, уменьшает резистентность асцита к диуре тикам, вызывая в некоторых случаях эффект тормо жения вторичного накопления АЖ, улучшает белковый баланс крови. В данном случае стоит задача сократить ее объем, так как количество асцитической жидкости дости гает 15—20 литров и более, и приблизить ее по составу к плазме крови. Эта задача решается применением ультра фильтрации, которая позволяет удалить из асцитической жидкости излишнее количество воды и большую часть низкомолекулярных токсических соединений. ~~
Способ забора асцитической жидкости заключается в следующем: под местной анестезией 0,5% раствором
211
Сердечно-сосудистая хирургия
новокаина 10,0—15,0, выполняется пункция брюшной полости по средней линии на середине расстояния между пупком и лонным сочленением. В брюшную полость вводят катетер диаметром 1,4 мм, который при соединяют к аппарату «искусственная почка», и гемодиафильтр с микропорами 500—1500 дальтон. С целью достижения бактерицидного и вирусоцидного эффекта протекающую в контуре жидкость дополнительно под вергают воздействию аппарата для ультрафиолетового облучения с длиной волны 254 нанометра.
Полученную жидкость отправляют на биохими ческое и цитологическое исследование. Однократно забирается 10—15 литров асцитической жидкости, из которой получается 1—3 литра концентрата. Первые 500 мл концентрата вводятся внутривенно после забо ра (рис. 3), оставшаяся часть собирается в стерильные гемоконы по 500 мл и сохраняется при температуре +2...+4°С. В первые сутки после лапароцентеза концен трат вводится внутривенно до объема 1000 мл. После введения 1000 мл концентрата определяется уровень
1'ис. 3. Забор, ультрафильтрация и реинфузия кон аспи i ичсской жидкости
общего белка и белковых фракций в плазме крови. Было установлено, что введение 1000 мл концентрата асцитической жидкости позволяет повысить содержа ние общего белка до 58,8 + 8,4 г/л. Оставшаяся часть концентрата асцитической жидкости вводится дробно по 500—1000 мл интраоперационно и в первые сутки после хирургического лечения.
Реинфузия концентрата асцитической жидкости позволяет восполнить белковые потери, связанные с эвакуацией асцитической жидкости и с печеноч ной недостаточностью, добиться увеличения диуре за, стабилизировать течение асцитического синдрома и выполнить операцию наложения спленоренального венозного анастомоза.
Полученные результаты позволяют сделать заклю чение о том, что реинфузия концентрата асцитической жидкости может быть использована в качестве компо нента предоперационной подготовки и послеопераци онного ведения больных при операциях, выполняемых с целью коррекции синдрома портальной гипертензии. Многократное выполнение реинфузии концент рата асцитической жидкости позволило справиться с белковыми потерями и подготовить больных к такому тяжелому оперативному вмешательству, как наложение спленоренального венозного анастомоза.
Профилактика рецидивов кровотечения.
Повторное кровотечение из варикозно-расширенных вен развивается в течение 1 года у 25% больных группы А, у 50% — группы В и у 75% — группы С. Если склеротерапия неэффективна, в качестве меры экстренной помощи прибегают к шунтированию — формированию портокавального или спленоренального шунта либо к ТВПШ.
При циррозе печени и кровотечении из варикознорасширенных вен причиной смерти может быть не сама кровопотеря, а печеночно-клеточная недостаточность. В этих случаях единственным выходом является транс плантация печени. Выживаемость после трансплантации не зависит от того, проводилась ли ранее склеротерапия или портосистемное шунтирование. Выживаемость после склеротерапии с последующей трансплантацией печени выше, чем только после склеротерапии. Это, возможно, объясняется тем, что в центры трансплантации направля лись больные с меньшей степенью риска.
Наложенный ранее портокавальный шунт техничес ки затрудняет трансплантацию, особенно если при этом проводились манипуляции на воротах печени, Спленоренальные и мезентерикокавальные шунты, а также ТВПШ не являются противопоказанием к трансплантации печени. После трансплантации большинство гемодинзмических и гуморальных изменений, вызванных цирро зом, подвергается обратному развитию.
212
Портальная гипертензия
Литература |
|
принципы лечения больных портальной гипертензией. |
|||||
|
|
||||||
|
|
Актуальные проблемы гастроэнтерологии. Ростон/Д., |
|||||
1. Бебуришвили А.Г., Михин С. В. Дифференцированный подход |
2006, 116 с. |
|
|
|
|
|
|
к хирургическому лечению цирроза печени. Анналы хирур |
14. Кательницкий |
И.И., |
Лукьянов |
СВ., |
Хоронько |
Ю.В., |
|
гической гепатологии. Материалы 6-й международной |
|
Сапронова Н.Г., Кострюков В.К.,Ходаков В.В. Особенности |
|||||
конференции. Киев. 1998, т. 3, с. 34. |
|
предоперационной подготовки больных с синдромом пор |
|||||
2. Буланов КМ. Гемодинамические аспекты патогенеза пор |
|
тальной гипертензии. Сборник трудов международного |
|||||
тальной гипертензии при циррозе печени. Международная |
|
хирургического конгресса «Новые технологии в хирургии». |
|||||
конференция: Новые направления в гепатологии. СПб. |
|
Ростов/Д., 2005, с. 288. |
|
|
|
||
1996, с. 57. |
15. Кательницкий |
И.И., |
Сапронова |
Н.Г., |
Хоронько |
Ю.В. |
|
3. Борисов А.Е. Оценка эффективности допплерографии у |
|
Алгоритм обследования больных с портальной гипертен |
|||||
больных диффузными заболеваниями печени с синдромом |
|
зией. IV научная сессия Ростовского государственного |
|||||
портальной гипертензии. А.Е. Борисов, В.А. Кащенко, |
|
медицинского университета. Ростов/Д., 2004, с. 297. |
|||||
Е.Л. Васюкова, А.О. Новиченков. Вестн. хирургии |
16. Кательницкий |
И.И., |
Сапронова |
Н.Г., |
Хоронько |
Ю.В., |
|
им. И.И. Грекова. 2002, т. 161, № 2, с. 26—31. |
|
Лукьянов СВ. Артерио-венозные свищи ворот селезенки |
|||||
4. БюрроузЭ. Портальнаягипертензия: [Ст. из Великобритании] |
при циррозе печени, осложненном портальной гипертен |
||||||
Э. Бюрроуз. Рос. журнал гастроэнтерологии, гепатологии, |
|
зией. IV научная сессия Ростовского государственного |
|||||
калопроктологии. 2001, т. 11, № 4, с. 74—75. |
|
медицинского университета. Ростов/Д., 2004, с. 298. |
|||||
5. Васюкова Е.Л. Факторы риска возникновения кровотечений |
17. Кательницкий |
И.И., |
Сапронова |
Н.Г., |
Хоронько |
Ю.В., |
|
портального генезау больных циррозом печени. Автореф. |
|
Мещерякова А.А., Савина О.В. Современные аспекты лече |
|||||
дис. ... канд. мед. наук: 14.00.27. Санкт-Петербургская |
|
ния больных с портальной гипертензией. Сборник трудов |
|||||
мед. академия последипломного образования. Великий |
|
международного хирургического конгресса «Новые техно |
|||||
Новгород. 2002. |
|
логии в хирургии», Ростов/Д., 2005, с. 289. |
|
||||
6. Гранов A.M. и др. Эмболизация печеночной артерии при |
18. Углов Ф.Г., Корякина Т.О. Хирургическое лечение порталь |
||||||
лечении цирроза печени. Вестн. хирургии им. И.И. Грекова. |
|
ной гипертензии. Л., 1964. |
|
|
|
||
1984, № 2, с. 117—121. |
19. Чалый А.Н. Левосторонняя портальная гипертензия: пато |
||||||
7. Ерамишанцев А.К. Хирургическое лечение синдрома пор |
|
генез и лечение. Вестн. хирургии. 1997, № 6, с. 65—69. |
|||||
тальной гипертензии в России. А.К. Ерамишанцев. Рос. |
20. |
Шерлок Ш., Дули Дж. Заболевания печени и желчевыводя- |
|||||
журнал гастроэнтерологии, гепатологии, колопроктоло- |
|
щих путей. М., 1999. |
|
|
|
|
|
гии. 2001, т. 11, № 4, с. 75—77. |
21. |
Alexander L.G. Лечение асцита. TIPS. Симпозиум: Новые |
|||||
8. Логинов А.С., Блок Ю.Е. Хронические гепатиты и циррозы |
|
направления в гепатологии. СПб., 1996, с. 38. |
|
||||
печени. М.: Медицина, 1987, 272 с. |
22. |
Descos L, GauthierA. et. al. Hepato-gastroenterology. 1983, |
|||||
9. Лыткин М.И. О возможности реинфузии асцитической жид |
|
v. 30, p. 152. |
|
|
|
|
|
кости. Вестн. хирургии им. И.И. Грекова. 1972, № 7, 71 с. |
23. |
Kivelitz R, Loose D. Le Veen-Shunt. Portale Hypertension. |
|||||
10. Пациора М.Д. Хирургия портальной гипертензии. М., 1974, |
|
Diagnostic und Therapie. Weinheim. Deerfield Beach, Florida, |
|||||
407 с. |
|
Basel, 1983, p. 110—118. |
|
|
|
||
П. Пациора М.Д. и др. Спленэктомия у больных цирро |
24. Le Veen H.H., Wapnick S., Guinto R. Kinney m. Indications for |
||||||
зом печени, осложненным портальной гипертензией. |
|
peritoneo-jugular shunt for ascites. World J. Surg. 1978, v. 2, |
|||||
Хирургия. 1983, № 7, с. 60—63. |
|
/V? 3, p. 367—371. |
|
|
|
|
|
12. Подымова С.Д. Болезни печени. М.: Медицина, 1993, 554 с. |
25. |
Schilling J., Me Kee F., Wiet W. Experimental hepatic — portal |
|||||
13. Кательницкий И.И., Сапронова Н.Г., Хоронько Ю.В., |
|
artenovenous anastomoses. Jurg. Gynec, odrtet, 1950, v. 90, |
|||||
Лукьянов СВ., Алубаев С.А., Зарайченко Л.П. Современные |
|
p. 473. |
|
|
|
|
|
i
9 80лскций по хирургии |
213 |
|
ЭНДОВАСКУЛЯРНАЯ ХИРУРГИЯ: НАСТОЯЩЕЕ И БУДУЩЕЕ
С.А. Капранов
Рентгено-эндоваскулярная хирургия (РЭХ) представ ляет собой один из наиболее перспективных и динами чески развивающихся разделов современной медици ны. Bee основе лежат различные способы механичес кого или фармацевтического воздействия на сосуды, участвующие в кровоснабжении пораженных органов организма человека, чем и обеспечивается необходи мый лечебный эффект.
Сосудистая система организма человека представ ляет собой сеть своеобразных «дорог», покрывающую всю «карту» организма человека. Эти транспортные магистрали используются для проведения к поражен ным органам разнообразных миниатюрных катетерных инструментов под рентгенотелевизионным контролем, позволяющим детально увидеть механические объекты диаметром до 0,1 мм.
В зависимости от способа воздействия все интер венционные вмешательства можно условно разделить на следующие виды:
1.Восстановление просвета закупоренного со суда с помощью:
•растворения тромбов (медикаментозный тромболизис);
•разрушения и удаления тромбов (гидродинами ческим или механическим воздействием);
•захвата и удаления внутрисосудистых инород ных тел.
2.Восстановление анатомической геометрии сосуда благодаря:
•расширению просвета (дилатация баллонными катетерами, или стентирование металлически ми конструкциями);
вудалению патологических внутрисосудистых новообразований (атерэктомия).
3.Закупорка патологических сосудов и сосудис тых сообщений с помощью:
•механических окклюдеров (спиралей, отсоеди няемых баллончиков, синтетических эмболов, специальных окклюдеров);
вхимических или медикаментозных средств.
4.Фильтрация кровотока внутрисосудистыми фи льтрами и специальными захватывающими при способлениями.
В настоящее время для выполнения интервен ционных хирургических вмешательств используется несколько тысяч различных инструментов, позволяю щих добиться необходимого воздействия на патологи ческий очаг. При этом пропорционально техническому прогрессу в медицинской промышленности, разраба тывающей новые технические устройства для внутрисосудистого применения, расширяется и разнообразие рентгено-эндоваскулярных вмешательств.
За последние 3 десятилетия РЭХ достаточно широ ко и с успехом используется в сердечно-сосудистой хирургии, абдоминальной и торакальной хирургии, нейрохирургии, урологии, пульмонологии, гинеколо гии, флебологии, онкологии, а спектр интервенционных вмешательств стремительно растет.
В подавляющем большинстве случаев минимальная инвазивность, малая травматичность и высокая эффек тивность этих операций обеспечивают им приоритет перед традиционными способами хирургической кор рекции патологии сердца и магистральных сосудов, органов грудной и брюшной полостей, малого таза и черепа. С достаточной степенью уверенности можно утверждать, что XXI век станет «золотым веком» рент- гено-эндоваскулярной хирургии.
Основы РЭХ были заложены в начале XX столетия, когда в странах Европы и США W. Porstman, A. Coumand, D. Richards, S. Seldinger и многие другие предпринимали первые попытки катетеризации сосудов и полостей сер дца, прижизненной рентгеновской ангиографии, про водили эксперименты по изучению внутрисердечной гемодинамики.
В России одна из первых лабораторий рентгеноангиографии была создана в 1918 году в Ленинградском государственном рентгенологическом, радиологическом и раковом институте М.И. Пименовым. Первая ангиогра фия у человека выполнена в 1924 году С.А. Райнбергом.
Становлению РЭХ в нашей стране способствовал энтузиазм и предвидение перспектив развития этой новой области медицины известных российских хирур гов А.Н. Бакулева, Б.В. Петровского, B.C. Савельева, В.И. Бураковского, Е.Н. Мешалкина и многих других. На протяжении более 40 лет это направление медицины развивали основоположники современной РЭХ Ю.С. Лет-
214
Эидоаоскулярная хирургия: настоящее и будущее
росян, И.Х. Рабкин, В.И. Прокубовский, Ю.Д. Волынский, Л.С. Зингерман, В.К. Сухов, Ю.Ф. Некласов.
Патология аорты и магистральных артерий
Эндоваскулярное протезирование грудного отдела аорты
Первые клинические исследования по эндоваскулярному протезированию грудной аорты при ее аневризматическом поражении начались в 1992 году. В последующие 10 лет с накоплением опыта это вмешательство стали применять также при острых и хронических расслое ниях, пенетрации изъязвленной атеросклеротической бляшки, травматических повреждениях, аорто-бронхи- альных фистулах, микотических аневризмах, аневризмах после попыток лечения коарктации аорты.
В настоящий момент для эндопротезирования груд ной аорты наиболее часто используются 3 вида стен- тов-графтов: the TAG, или Thoracic Excluder (W.L. Gore & Associated), The Talent (AVE/Medtronic, Inc.), и the Zenith TX2 (Cook, Inc.). Они изготовлены из саморасширяюще гося нитинолового стентового каркаса с одностороннрим или двухсторонним (по типу сендвича) покрытием политетрафлюороетиленом (ПТФЕ). Доставляющее уст ройство имеет размер от 20 до 24 Fr.
Максимальный опыт клинического применения эндо протезирования при аневризмах грудной аорты опубли ковали в 2004 г. М. Makaroun et al. (142 операции) и R. Bell et al. (217 вмешательств). Технический успех операции составил соответственно 97,9 и 83%, летальность в течение 30 дней — 1,5 и 8,5%, отдаленная выживаемость — 75% в течение 2-х лет, подтекание крови мимо стента — 8,8%.
Наиболее успешные результаты при расслоении грудного отдела аорты были достигнуты С. Nienaber et al. (2004), которому в 100% случаев удалось полно стью восстановить истинный просвет грудной аорты у 105 пациентов. При этомуровеньлетальности втечение 30 суток после эндоваскулярного вмешательства соста вил лишь 2,9%, а в течение последующих 32,4 месяца были живы 89,5% оперированных пациентов.
Эндоваскулярное протезирование брюшного отдела аорты
Традиционным методом лечения аневризм брюшной аорты вплоть до настоящего времени остается хирурги ческая операция. Только на территории США в 2000 году было выполнено более 30 000 операций по поводу абдо
минальных аневризм. Однако, несмотря на усовершенс твованную технику оперативных вмешательств, уровень интраоперационной летальности не удается снизить ниже 4—6%, а при экстренных операциях — 50—60%, Решение проблемы наметилось в 1991 году, когда Juan Parodi первым выполнил эндоваскулярное лечение аневризмы брюшной аорты у человека, после чего нача лось стремительное внедрение этого метода в широкую
клиническую практику.
Первые исследования клинических результатов пока зали, что эндоваскулярный доступ при лечении аневризм брюшной аорты по сравнению с результатами тради ционного хирургического лечения значительно снижа ет послеоперационную летальность, сопровождается сопоставимой средней выживаемостью в течение 1 года, снижает время пребывания больных в стационаре, спо собствует ранней реабилитации больных и имеет малое количество осложнений (Rutherford R. etal., 2004).
В настоящее время установлено, что почти половина всех пациентов с данной патологией может быть изле чена в будущем с помощью эндоваскулярного доступа (Bush R. et al., 2003). В 1997 году G. Dorros с соавт. систе матизировали показания и противопоказания кэндоваскулярному протезированию аневризм брюшной аорты.
Большую серию из 200 пациентов, перенесших эндопротезирование брюшной аорты при ее аневризмах, доложили в 2000 году G. Becker с соавт. Успех вмеша тельства составил 96%. 30-дневная летальность не пре вышала 2,5%, включая 1,4% у неотягощенных больных и 5,5% у больных с тяжелыми сопутствующими заболева ниями. У 17% больных отмечены нефатальные осложне ния, включающие инфаркт миокарда, сердечную недо статочность, ангину, гипертонию, тромбоз глубоких вен нижних конечностей и другие. Средняя продолжитель ность пребывания больных в стационаре при эндоваскулярном лечении составила от 2-х до 4-х суток.
С накоплением большого клинического опыта эндо васкулярного стентирования при аневризмах брюшной аорты, к сожалению, было установлено, что, несмотря на преимущества этого метода лечения по сравнению с традиционными операциями, его отдаленные результаты достаточно дискутабельны (Matsumura J. et al., 2003).
Эндоваскулярные вмешательства на терминальном отделе аорты и подвздошных артериях
История развития эндоваскулярного лечения окклюзионно-стенотических поражений артерий таза и нижних конечностей начинается с 1964 года, когда Ch. Dotter впервые описал наблюдения случайного про-
215
Сердечно-сосудистая хирургии
ведения катетера через окклюзированный подвздош ный артериальный сегмент, а год спустя он же исполь зовал систему коаксиальных катетеров 12 Fr в диаметре для восстановления перфузии конечности у пожилого пациента, который отказался от ампутации. Позднее эти катетеры были модифицированы Т. Staple и G. Van Andel, которые использовали конические дилататоры. Через 10 лет A. Gruentzig разработал двухпросветный баллонный катетер для дилатации сосудов, который позволял дилатировать сужение до диаметра, большего чем размер небольшой артериотомии, использующейся для введения катетера. Эти эпохальные открытия про ложили путь техническому решению и совершили рево люцию в использовании баллонной дилатации в самых различных сосудах организма человека.
В настоящее время эндоваскулярные вмешатель ства имеют статус непререкаемого приоритета при восстановлении проходимости артерий таза и тер минального отдела аорты. В мировой практике отда ленный успех стентирования подвздошных артерий составляет от 45 до 95% в течение 5 лет (в зависимости от уровня имплантации стента), что в 1,5 раза пре вышает аналогичный показатель при использовании хирургического шунтирования. R. Reyes с соавт. (1997) сообщили о результатах первичного эндоваскулярного стентирования хронических окклюзии подвздошных артерий после проводниковой реканализации с уров нем технического успеха 92%, в результате чего прохо димость артерий была восстановлена в 88% случаев. По мнению Е. Lee с соавт. (2000), результаты эндовас кулярного вмешательства не зависят от локализации и протяженности атеросклеротического поражения подвздошных артерий.
Одним из основных преимуществ эндоваскулярных вмешательств при окклюзионно-стенотических пора жениях подвздошных артерий и терминального отдела аорты, в отличие от традиционных способов хирурги ческой коррекции, является возможность их повторного применения (J. De Vries et al., 2004). P. Feugier с соавт. в 2003 году сообщили о клинически успешных повтор ных вмешательствах на подвздошных артериях у 9,9% пациентов с рестенозами.
Частота осложнений эндоваскулярных вмешательств при эндоваскулярном лечении поражений терминально го отдела аорты и подвздошных артерий не превышает 4—6%. Они включают острую окклюзию, формирование псевдоаневризм подвздошных артерий, образование артерио-венозных фистул, разрыв подвздошной арте рии и дистальную эмболизацию рыхлыми тромботическими массами или частицами атеросклеротических бляшек (Strecker Е., 1996; Dyet J. et al., 1997).
Добиться восстановления просвета окклюзироеанных подвздошных артерий можно с помощью эндоваскулярной механической тромбэктомии. Наиболее часто используются системы Oasis (Boston Scientific/MediTech), Angiojet/Xpendor (Possis Medical), Hydrolyser (Cordis Endovascular) и Amplatz thrombectomy device (Microvena). По механизму воздействия эти приспособ ления предназначены для: 1) разрушения, 2) распыле ния, 3) смещения, 4) эвакуации тромбов из сосудов или шунтов (Stainken В., 2003).
Улучшению отдаленных результатов баллонной дила тации и стентирования подвздошных артерий способс твует предварительное эндоваскулярное удаление ате росклеротических бляшек из сосуда с помощью прямой, ротационной и эвакуаторной атерэктомии (Orlic 0„ 2003).
Эндоваскулярные вмешательства на артериях нижних конечностей
В 1994 году J. Cardella с соавт. разработали стандар ты эндоваскулярного лечения при поражении бедрен- но-подколенного сегмента, в которых были определены требования и технические условия для выполнения ангиопластики, включая описание необходимого инс трументария, техники вмешательств, минимизации дозы облучения и других.
Детализация показаний и противопоказаний к эндоваскулярной ангиопластике бедренно-подколен- ного сегмента была проведена Обществом кардиоваскулярных и интервенционных радиологов (Society of Cardiovascularand Interventional Radiology) в 1990 году. Они были одобрены в 1994 году Американской сердеч ной ассоциацией (American Heart Association) и вошли в «Руководство по ангиопластике брюшной аорты и сосудов нижних конечностей» (Guidelines for periph eral transluminal angioplasty of the abdominal aorta and lower extremity vessels).
Для оценки эффективности ангиопластики R. Ruther ford (1986) разработал стандартные критерии, которые были в последующем модифицированы G. Becker (1991). Они включали шкалу оценки от «-3» до «+3» баллов в зависимости от степени улучшения клинических симп томов и повышения плече-лодыжечного индекса.
Т. Clark с соавт. (2001) для оценки эффективности бедренно-подколенной ангиопластики провели обсле дование 259 пациентов, из которых 57% страдали пере межающей хромотой, у 79% из них был выявлен сте ноз. Первичная проходимость после эндоваскулярного вмешательства в течение 1 года отмечена у 87% и в течение 3 лет — у 69% больных. Авторы установили,что
216
Эндоваскулярная хирургия: настоящее и будущее
основной причиной неудовлетворительных результатов являлась непроходимость дистальных отделов тибиальных артерий.
В исследовании G. Becker, посвященном изучению результатов ангиопластики вне зависимости от лока лизации поражения, на серии 4662 пациентов было установлено, что уровень госпитальной летальности при эндоваскулярном лечении не превышает 0,23%, а осложнения, требующие хирургической коррекции, развиваются лишь у 2,5% больных.
Использование внутрисосудистых стентов при анги опластике бедренно-подколенных артерий не вызвало значительного увеличения ее эффективности. G. Muradin (2001) при проведении метаанализа 19 серий, включающих 923 ангиопластики и 473 стентирования, установил, что у пациентов с перемежающей хромо той и стенозами поверхностной бедренной артерии 3-летняя проходимость после ангиопластики соста вила 61%, при стентировании — 66%. При окклюзиях эти показатели составили соответственно 48 и 64%. Лучшие результаты были достигнуты при имплантации в поверхностные бедренные и подколенные артерии пок рытых ПТФЕ стентов-графтов. R. Saxon с соавт. (2003) опубликовали данные о 28 пациентах с первичной про ходимостью стентов у 87% в течение 2 лет, а Т. Jahnle et al. (2003) — о 63 больных с длиной поражения артерий более 11 см, у которых проходимость покрытых стентов в течение 2 лет была сохранена в 74% случаев.
Для улучшения отдаленных результатов стентирова ния поверхностных бедренных и подколенных артерий было предложено имплантировать стенты с лекарс твенным покрытием (сиролимус, паклитаксел). Первое проспективное рандомизированное исследование на серии из 18 пациентов со стентами SMART (Johnson & Johnson, Cordis) (Duda S. et al., 2002) показало, что за счет подавления пролиферации через 6 месяцев после вмешательства диаметр артерии составил 4,95 мм после имплантации лекарственных стентов и 4,31 мм при использовании обычных эндопротезов.
В качестве альтернативного метода лечения окклю зии бедренно-подколенного сегмента J. Lammer с соавт. (1991) предложили использовать реканализацию с помощью сапфирового YAG-лазера. При небольшой протяженности поражения сосудов результаты этого вмешательства были достаточно перспективными. На серии из 338 пациентов с окклюзией бедренноподколенных артерий длиной 8,5 см автору удалось восстановить проходимость у 85% пациентов, а ос ложнения, потребовавшие экстренных хирургических вмешательств, были отмечены лишь в 1,5% случаев. В течение 3-х лет проходимость сосудов была сохра
нена у 57% пациентов. Однако при длине окклюзии поверхностной бедренной артерии более 10 см резуль таты лазерной реканализации оказались неудовлетво рительными.
Уровень осложнений эндоваскулярных вмешательств на бедренно-подколенном артериальном сегменте, по данным J. McDermott с соавт. (1991), невысок и включа ет тромбоз сосуда (2%), дистальную эмболизацию (2%), ложную аневризму (0,3—2,0%), артерио-венозную фис тулу (0,1—0,3%) и разрыв артерии (0,3—3,0%).
Реканализация артерий голени
Чрескатетерные вмешательства на артериях голени стали возможными в конце 1990-х годов только после внедрения в клиническую практику инструментов мало го диаметра, применяющихся для эндоваскулярного лечения коронарных заболеваний.
В настоящее время для восстановления проходи мости артерий голени наиболее часто применяют изо лированную ангиопластику с помощью монорельсовых систем баллонных катетеров с диаметром несущей части не более 4 Fr, с баллоном диаметром от 2 до 4 мм и длиной 60—100 мм, которые возможно провести по проводнику 0,010—0,018 дюйма.
Наибольший клинический опыт эндоваскулярной баллонной ангиопластики артерий голени принадле жит G. Dorros с соавт., которые в 2001 году сообщили о выполнении вмешательства у 235 пациентов с критичес кой ишемией нижних конечностей в возрасте от 40 до 86 лет. Автору удалось добиться устранения симптомов ишемии нижних конечностей у 91% пациентов при сро ках наблюдения до 5 лет.
С. White в 1998 году для ликвидации окклюзии тибиальных артерий использовал циркулярную атерэктомию устройством Arrow-Fishell (Arrow International) с минимальным количеством осложнений. Аналогичных результатов добились и Т. Zeller с соавт. (2004), которые выполнили атерэктомию на сосудах диаметром до 2 мм у 33 пациентов с помощью специально разработанных катетеров Silverhawk. В 15 случаях эндоваскулярное вмешательство было дополнено баллонной ангиопла стикой. Технический успех операции составил 97%, и в течение последующих 6 месяцев проходимость артерий голени сохранялась у 94% больных.
Для реканализации тибиальных артерий с успе хом используется и лазерная техника ангиопласти ки. В процессе LAC I—И исследования эффективности этого метода при критической ишемии нижних конеч ностей (Laird 3. et al., 2004), включавшего 155 паци ентов, у 41% из них было констатировано поражение
217
Сердечно-сосудистая хирургия
тибиальных артерий. Лазерная реканализация была достигнута у 99% больных и дополнена ангиопластикой
у96% из них. Устранение симптомов ишемии отмечено в
95% наблюдений в течение 6 последующих месяцев. G. Ansel с соавт. (2004) для ангиопластики артерий
голени применили так называемые режущие катетеры
упациентов, 71% из которых имели критическую ише мию нижних конечностей, 8 2 % — вновь возникшие стенозы и 18%— стенозы внутри ранее имплантиро ванных стентов. В течение 1 года после вмешательства устранение клинических симптомов отмечено у 89,5% больных.
Одним из наиболее современных и активно разра батываемых направлений эндоваскулярного лечения поражений артерий голени является брахитерапия. К. Krueger с соавт. (2004) выполнили рандомизирован ное контролируемое исследование с использованием внутрисосудистого гамма-облучения с последующей ангиопластикой у 15 пациентов. Контрольная группа также включала 15 больных. В течение 24 месяцев 5 пациентов контрольной группы и 2 пациента основ ной группы имели менее 50% рестенозов. Тяжесть стенозов составила 9,6 ± 43,5 в группе с облучением и 34,9 ± 28,1 в контрольной группе, что подтверждает перспективность данного направления эндоваскулярной хирургии.
Эндоваскулярные вмешательства при гемангиомах и сосудистых мальформациях
Основными направлениями эндоваскулярных вмеша тельств при сосудистых мальформациях является либо эмболизация участвующих в их образовании сосудов, либо разобщение патологических соустий между арте риальной и венозной системой.
При гемангиомах, локализующихся в области головы, приводящих к косметической инвалидизации детей (Onesti G. et al., 2003), и массивном печеночном гемангиоматозе, сопровождающемся 80% летальнос тью при выраженной перегрузке правых отделов сер дца (WarmannS. et al., 2003), в большинстве случаев используется эмболизация частицами гельформа, ПВА, акриловым клеем, а также проксимальная эмболизация спиралями.
Артерио-венозная фистула требует эндоваскулярной окклюзии самой фистулы или выключения сег мента артерии, которая является ее источником. Выбор эмболизационного приспособления или материала пре допределяется анатомическим строением сосудов. По мнению A. Berenstein с соавт., наиболее эффективны
отделяемые макроспирали или баллоны, которые могут быть репозиционированы в оптимальное положение для достижения максимального клинического эффекта. В последние годы для разобщения артерио-венозных соустий стали применять имплантацию стентов-граф- тов (CriadoE. et al., 1997).
Артерио-венозные мальформации. В настоящее время методом выбора при лечении подобной патологии является чрескатетерная эмболизация проксимальной части питающего артериального сосуда гельформом, отделяемыми спиралями или баллонами. Наиболее при емлемым, недорогим и не требующим специфических доставляющих катетеров эмболизатом является абсо лютный 95% спирт, внедренный в широкую клиническую практику W. Yakes с соавт. (1996). В 2000 году A. Sadato с соавт. при лечении артерио-венозных мальформации применили цианоакрилат (быстрополимеризующийся клей) в сочетании с маслорастворимым контрастным веществом, позволившим добиться предпочтительных по сравнению с другими эмболизирующими вещества ми результатов, контролировать дозу и место введения препарата.
Практически при любой локализации артерио-веноз ных мальформации эмболизация различными препа ратами сопровождается высокой клинической резуль тативностью. При поражении почек эндоваскулярное вмешательство является абсолютной альтернативой хирургической операции (Steckman D. et al., 2003), при тазовой локализации у женщин позволяет избежать гис терэктомии (Markoff G. etaL, 1986), а при артерио-веноз ных мальформациях конечностей с успехом использует ся в комбинации с хирургическими вмешательствами на проксимальных отделах питающих сосудов.
При венозных мальформациях эндоваскулярное лечение предполагает окклюзию питающих патологи ческий венозный регион артерий либо склеротерапию (Puig S. et al., 2003). При синдроме Клиппеля—Треноне и синдроме Паркс-Вебера эндоваскулярное лечение может устранить косметические проявления с помощью лазерной облитерации (Waner M., 2003).
Эндоваскулярные вмешательства на коронарных артериях
Первая коронарная ангиопластика, выполненная в 1977 году Andreas Gruentzig в Кантонском госпи тале в Цюрихе (Швейцария), явилась кульминацией десятилетних исследований, посвященных достижению наилучших результатов этого вмешательства.
Первоначально успех коронарной ангиопластики был невысоким и достигал лишь 59% с достаточно высо-
218
Эндоваскулярная хирургии: настоящее и будущее
ким уровнем серьезных осложнений у 18% пациентов (Holmes D. et al., 1988). В последующем разработка стандартов подготовки специалистов, усовершенство вание ангиографических аппаратов и специфического инструментария повысили процент успеха эндоваскулярного вмешательства до 90—95% с минимизацией уровня осложнений (менее 3%). В настоящее время Американская сердечная ассоциация установила, что на территории США в 2003 году выполнено более 1 000 000 коронарных ангиопластик (Heart and Stroke Facts: American Heart Association — 2003), и она используется намного более часто, чем традиционная шунтирующая коронарная хирургия.
Недостатком изолированной коронарной баллонной ангиопластики является рестеноз у 30—45% пациентов, развивающийся в течение 3 месяцев после эндоваскулярного вмешательства. Для преодоления этого недо статка было предложено коронарное стентирование. Первый коронарный стент Palmaz-Schatz, разрешенный к применению FDA в 1994 году, улучшил результаты ангиопластики коронарной патологии. Клинический успех коронарного стентирования непокрытыми стентами в раннем периоде превышает 90%. Принципиальной проблемой при их использовании является подострый тромбоз, частота которого составляет 0,5—1,6% в тече ние 14 суток с максимальной опасностью в течение первых 5 дней после стентирования и зависит от типа стента, состояния периферического сосудистого русла, сопровождающей медикаментозной терапии, а в позд нем периоде — рестеноз, опасность которого провере на в 2-х проспективных рандомизированных исследо ваниях (Fishman D. et al., 1994; Serruys P. et al., 1994), достоверно показавших преимущества стентирования перед баллонной ангиопластикой.
Революцию в эндоваскулярной коронарной хирур гии произвели так называемые «лекарственно-покрытые стенты» («drug-eluting stent»), которые представляют собой стандартный металлический стент, на который нанесен полимерный слой, содержащий импрегнированные цитостатические препараты, подавляющие1 проли ферацию неоинтимы и препятствующие развитию рестеноза. Покрытые стенты критически снизили частоту рестенозов, обусловленных утолщением стенки сосуда в связи с пролиферацией интимы. В SIRIUS исследовании (Moses J. et al., 2003) покрытые сиролимусом коронарные стенты в отдаленном периоде привели к рестенозу лишь у 3,2% пациентов, в то время как аналогичная патоло гия вновь возникла у 35% после имплантации обычных металлических стентов. Такие же результаты были отме чены и в TAXUS-IV исследовании (Stone G. et al., 2004) с показателями в сопоставимых группах 7,9 и 26%.
Благодаря внедрению в клиническую практику стен тов с лекарственным покрытием, в настоящее время это вмешательство с успехом применяется при критических клинических ситуациях с поражением ствола коронар ных сосудов, бифуркационных стенозах, многососудистых (более 3-х сегментов) стенозах. Отлажена техника анги опластики в виде «У», «Т»-образного размещения коро нарных сосудистых эндопротезов, оригинальная методика «crush» стентирования, позволяющие добиться клиничес кого эффекта в самых запущенных случаях атеросклеротического поражения коронарных артерий. Исследование ARTS-I (1202 больных) и ARTS-II (607 больных) (Arterial Revascularization Therapy Study) показало, что при исполь зовании покрытых стентов уровень смертности, инфарктов миокарда и ишемии был значительно меньше по сравнению
сгруппой оперированных больных (Sirruys P. et al., 2001).
Вноябре 2000 года FDA разрешило к примене нию устройство для брахитерапии, основой которого являлась локальная «у» (Leon M. et al., 2001) или «р» (Raisner A. et al., 2000) радиация, предотвращающая пролиферацию интимы внутри имплантированных коро нарных стентов. При применении этого метода лечения процент рестенозов составил 17—32%, что сопоставимо
срезультатами применения покрытых стентов по про центу рестенозов (Kastrati A. et al., 2005).
Вкачестве альтернативного стентированию способа эндоваскулярного лечения заболеваний коронарных артерий была также предложена и ротационная атерэктомия с помощью ротаблатора (Boston Scientific). Однако первые публикации, свидетельствующие о 95% эффективности этого вмешательства и минимальном (1%) уровне осложнений, не показали явных отличий ротационной атерэктомии в частоте рестенозов внутри стента (Dietz U. et al., 2002). Направленная атерэктомия
спомощью катетера Симпсона (Simpson AtheroCath, DVI, Inc), no результатам исследования Coronary Angioplasty Versus Excisional Atherectomy Trial (CAVEAT), также не выявила преимуществ этого эндоваскулярного вмеша тельства перед ангиопластикой (Topol E. et al., 1993).
Заболевания магистральных вен
Эндоваскулярные вмешательства при синдроме Педжета—Шреттера
Еще в I960—1970-х годах J. Adams с соавт. устано вили, что при консервативном лечении пациентов с син дромом Педжета—Шреттера у 10% из них развивается легочная тромбоэмболия, у 4 % — венозная гангрена, и у 70% заболевание приводит к стойкому нарушению
219
Сердечно-сосудистая хирургия
функции верхней конечности. Попытки хирургической реконструкции также не привели к кардинальному реше нию проблемы в связи с достаточно высокой травматичностью. Неудовлетворительные результаты созда ли предпосылки к внедрению в клиническую практику методов эндоваскулярной дезобструкции, включающих регионарный катетерный тромболизис, баллонную дилатацию и стентирование подключичной и подмышечной вен. Эффективность эндоваскулярного восстановления проходимости магистральных вен верхних конечностей достигает 87—93%. Однако R. Beygui с соавт. (1997) и G. Meier с соавт. (1996) обратили внимание, что в отда ленном периоде отмечается частая поломка подключич ных стентов, что ограничивает их применение, особенно у больных молодого возраста. В связи с этим авторы рекомендовали перед имплантацией эндопротезов при синдроме Педжета—Шреттера выполнять резекцию одного ребра. Исключением из этого правила являются пациенты со сдавлением подключичной вены злокачес твенными новообразованиями, у которых стентирование подключичной вены может являться исключительным методом лечения.
Эндоваскулярные вмешательства при окклюзии верхней полой вены
После пионерских работ J. Rosch с соавт. (1992), применивших венозное стентирование у 22 больных с синдромом ВПВ, к настоящему времени опубликовано более сотни научных работ, посвященных изучению результатов этого эндоваскулярного вмешательства. D. Yim et al. (2000) отметили, что технический успех стентирования с помощью Gianturco Z stent достигает 81%, Wallstent — 86% и сопровождается полным уст ранением симптомов сдавления ВПВ у 68% больных. S. Qanadti с соавт. (1999) и J. Rosenblum с соавт. (1994) успешно применили стентирование ВПВ у пациентов с доброкачественными причинами окклюзии (цент ральные катетеры, послелучевой фиброз, имплантация ЭКС, доброкачественные опухоли). Для облегчения проведения стента в зону стриктуры ВПВ S. Кее с соавт. (1998) рекомендуют предварительно проводить реги онарный тромболизис, однако вместе с тем обращают внимание на увеличение риска серьезных геморраги ческих осложнений эндоваскулярного лечения.
Эндоваскулярные вмешательства при окклюзии нижней полой вены
При острых тромбозах НПВ общепринятым методом эндоваскулярного восстановления проходимости явля
ется регионарный катетерный тромболизис, эффек тивность которого достигает 89—93% (Angle Д. et al., 1998). В случаях хронических окклюзии эндоваскулярное лечение подразумевает более сложную технику вмешательства с комбинированным использованием механической реканализации, тромболизиса и стен тирования НПВ, которое приводит к восстановлению проходимости сосуда у 73—78% пациентов (Razavi M. et al., 2000). В последние годы в связи со стреми тельным увеличением числа пациентов, перенесших пересадку печени, одной из хирургических проблем является стриктура венозных сосудистых анастомозов. В подобных клинических ситуациях S. Weeks et al. (2000) с успехом применил имплантацию Gianturco Z stent, что во всех случаях позволило снизить давление в НПВ, а у 88,9% пациентов полностью устранить сим птомы.
Эндоваскулярные вмешательства при стенозах подвздошных вен
Еще в 1851 году R. Virchov впервые описал повыше ние частоты тромбоза левой общей подвздошной вены в зоне ее пересечения с правой общей подвздошной артерией. Через 100 лет R. May и J. Thurner (1957) при исследовании 430 трупов у 22% из них обнаружили обструктивные «шпоры», которые гистологически были представлены хроническим воспалительным разраста нием интимы вследствие повторного повреждения комп рессией подвздошной артерией. Впоследствии F. Cockett с соавт. (1967) при клиническом обследовании 57 паци ентов с тромбозом подвздошной вены подтвердили первоначальный генез заболевания, связанный с синд ромом подвздошной компрессии, получившим название синдрома Мея-Тюрнера (May-Thurner syndrome).
Для лечения острого тромбоза при синдроме МеяТюрнера используется катетерный тромболизис, бал лонная ангиопластика и стентирование. По данным G. O'Sullivan с соавт. (2000) и N. Patel с соавт. (2000), технический успех эндоваскулярного лечения является абсолютным (100%), а его эффективность и сохранение проходимости подвздошных вен в течение 1 года дости гают 90—93,9%.
Эндоваскулярные вмешательства при окклюзии печеночных вен
Нарушение венозного оттока из ткани печени, или синдром Бадда—Киари (Budd—Chiari syndrome), обус ловлено стенозами и окклюзиями печеночных вен либо сегмента НПВ между печенью и правым предсердием.
220
